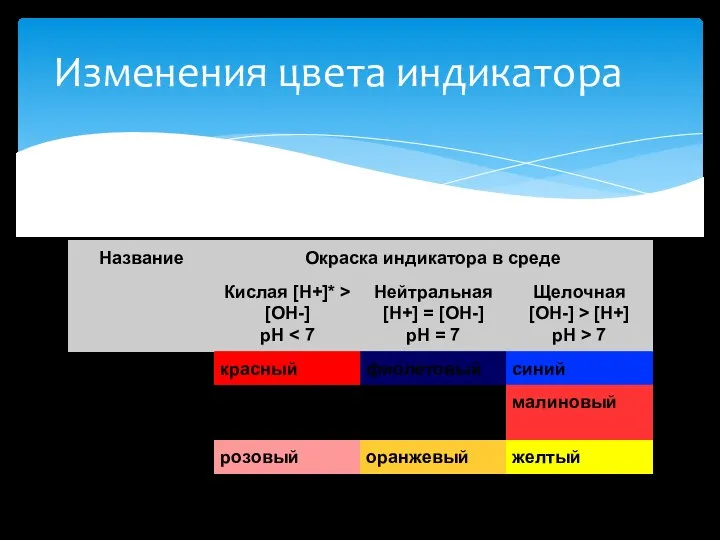
Диссоциация
NaOH = Na+ + OH-
Ca(OH)2 = CaOH+ + OH-
CaOH+
= Ca2+ + OH-
Ca(OH)2 = Ca2+ + 2OH-
Щёлочи (позднелат. alkali — «щёлочь» (который, в свою очередь, происходит от арабского al quala — «пепел растений») — гидроксиды щелочных,щёлочноземельных металлов и аммония. К щёлочам относят хорошо растворимые в воде основания. При диссоциации щёлочи образуют анионы OH− и катион металла.
К щёлочам относятся гидроксиды металлов подгрупп Iа и IIа (начиная с кальция) периодической системы, например NaOH (едкий натр), KOH (едкое кали), Ba(OH)2(едкий барит). В качестве исключения можно отнести к щелочам гидроксид одновалентного таллия TlOH, который хорошо растворим в воде и является сильным основанием. Едкие щёлочи — тривиальное название гидроксидов лития LiOH, натрия NaOH, калия КОН, рубидия RbOH, и цезия CsOH.
Щелочами являются
А . Ba(OH)2 Б. Fe(OH)3 В. KOH Г. Al(OH)3 Д. Cu(OH)2 Е. HNO3
1)А, Г 2) Б, Д 3) В, Е 4) А, В








 Растворы Электролитическая диссоциация
Растворы Электролитическая диссоциация  Спирти. Одноатомні насичені спирти (алканоли)
Спирти. Одноатомні насичені спирти (алканоли) Тема урока: Химические свойства алкенов. Получение.
Тема урока: Химические свойства алкенов. Получение. Химические реакции. Скорость химической реакции
Химические реакции. Скорость химической реакции Гидролиз солей
Гидролиз солей Лекция 4. Методы количественного химического анализа
Лекция 4. Методы количественного химического анализа Устойчивость и коагуляция золей
Устойчивость и коагуляция золей Феноли. Застосування в медицині та повсякденному житті
Феноли. Застосування в медицині та повсякденному житті Взаимодействие частиц вещества
Взаимодействие частиц вещества Интересные свойства редких металлов
Интересные свойства редких металлов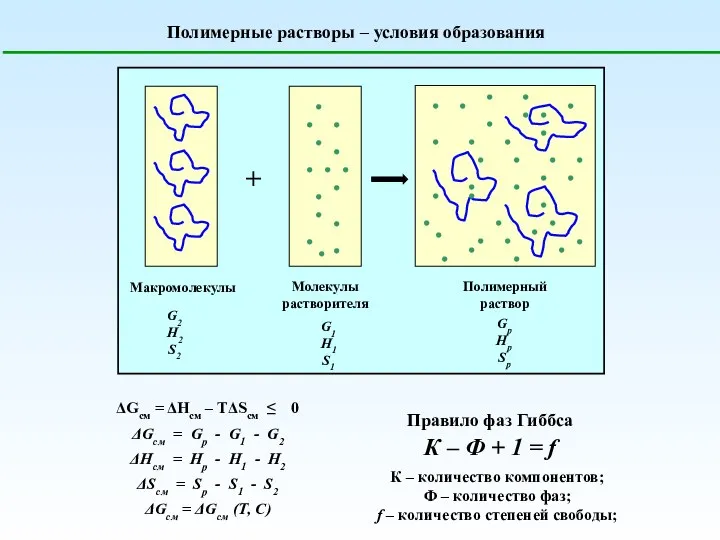 Полимерные растворы. Условия образования
Полимерные растворы. Условия образования Алюминий и его соединения
Алюминий и его соединения ДВА «ПОДАРКА» ЧЕЛОВЕКА САМОМУ СЕБЕ
ДВА «ПОДАРКА» ЧЕЛОВЕКА САМОМУ СЕБЕ  В мире криссталлов
В мире криссталлов Атомна одиниця маси. Відносна атомна маса хімічних елементів.
Атомна одиниця маси. Відносна атомна маса хімічних елементів.  Оксиды. Бинарное соединение. Степень окисления у неметаллов
Оксиды. Бинарное соединение. Степень окисления у неметаллов Получение силикагеля, модифицированного бензоксазолами
Получение силикагеля, модифицированного бензоксазолами Презентация по Химии "Жири" - скачать смотреть бесплатно
Презентация по Химии "Жири" - скачать смотреть бесплатно Системы эвтектического типа
Системы эвтектического типа Карбоновые кислоты и их гетерофункциональные производные: гидрокси- и оксокарбоновые кислоты
Карбоновые кислоты и их гетерофункциональные производные: гидрокси- и оксокарбоновые кислоты Презентация Простые вещества химия 8 класс
Презентация Простые вещества химия 8 класс Крахмал (C6H10O5)n
Крахмал (C6H10O5)n Липиды. Классификация липидов
Липиды. Классификация липидов ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА № 65 Г. МАРИУПОЛЯ
ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА № 65 Г. МАРИУПОЛЯ Физические методы исследования в химии
Физические методы исследования в химии Лаборатория «Полимеры для биологии»
Лаборатория «Полимеры для биологии» ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА «ПАЛИТРА СРЕДНЕВЕКОВОГО ХУДОЖНИКА» Автор: Екатерина Буянкина, 5 «А» МОУ СОШ № 9 Руководитель: Анна Вла
ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА «ПАЛИТРА СРЕДНЕВЕКОВОГО ХУДОЖНИКА» Автор: Екатерина Буянкина, 5 «А» МОУ СОШ № 9 Руководитель: Анна Вла Практическая работа №2. «Наблюдение за горящей свечой»
Практическая работа №2. «Наблюдение за горящей свечой»