Содержание
- 2. Выберите класс неорганических соединений нажатием левой клавиши мыши. Дополнительные сведения по теме раздела находятся в приложении
- 3. ОКСИДЫ Для выбора следующего класса неорганических соединений нажмите левой клавишей мышки на «домик» ОПРЕДЕЛЕНИЕ. ОБЩАЯ ФОРМУЛА
- 4. ОСНОВАНИЯ Для выбора следующего класса неорганических соединений нажмите левой клавишей мышки на «домик» ОПРЕДЕЛЕНИЕ. ОБЩАЯ ФОРМУЛА
- 5. КИСЛОТЫ Для выбора следующего класса неорганических соединений нажмите левой клавишей мышки на «домик» ОПРЕДЕЛЕНИЕ. ОБЩАЯ ФОРМУЛА
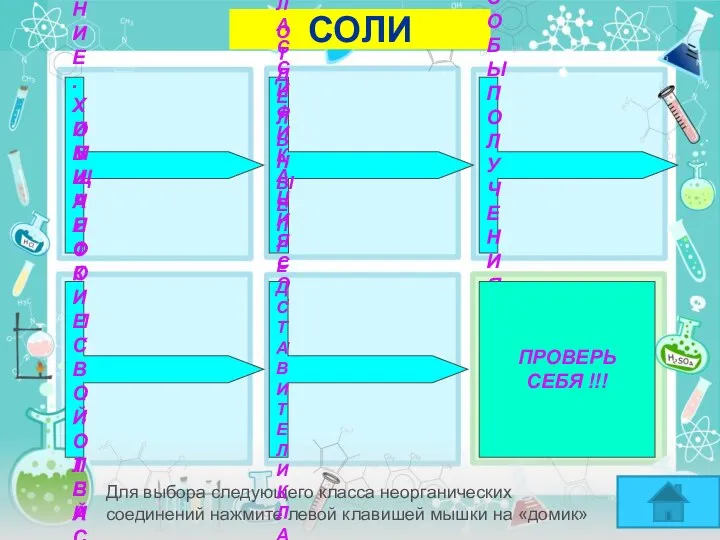
- 6. СОЛИ Для выбора следующего класса неорганических соединений нажмите левой клавишей мышки на «домик» ОПРЕДЕЛЕНИЕ. ОБЩАЯ ФОРМУЛА
- 7. Э+n O-2 Оксиды это сложные вещества, состоящие из двух элементов, один из которых кислород n =
- 8. Ме+n (OH)n Oснования - это сложные вещества, состоящие из атомов металлов и гидроксильных групп ОН. n
- 9. Кислоты это сложные вещества, которые состоят из атомов водорода и кислотного остатка Н+ Кост-n Значение n
- 10. Соли это сложные вещества, молекулы которых состоят из атомов металла и кислотного остатка Ме+m Кост-n m
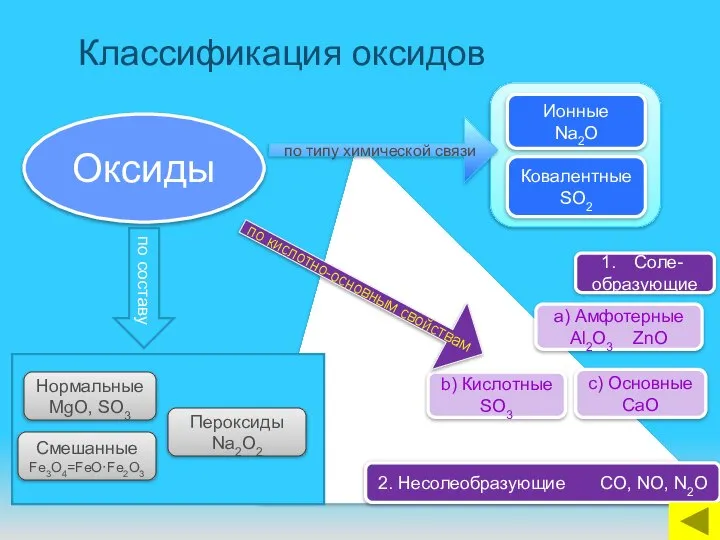
- 11. Классификация оксидов Оксиды Ковалентные SO2 Ионные Na2O Смешанные Fe3O4=FeO·Fe2O3 Пероксиды Na2O2 Нормальные MgO, SO3 2. Несолеобразующие
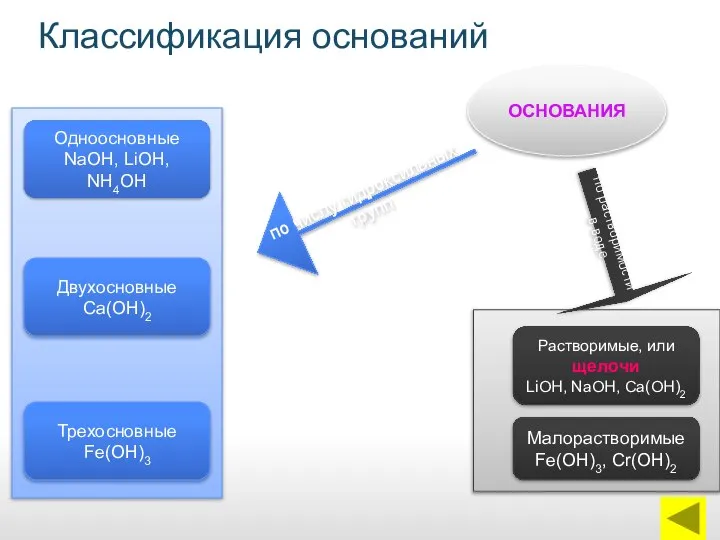
- 12. Классификация оснований ОСНОВАНИЯ Одноосновные NaОН, LiОН, NН4ОН Двухосновные Са(ОН)2 Трехосновные Fe(ОН)3 Растворимые, или щелочи LiОН, NаОН,
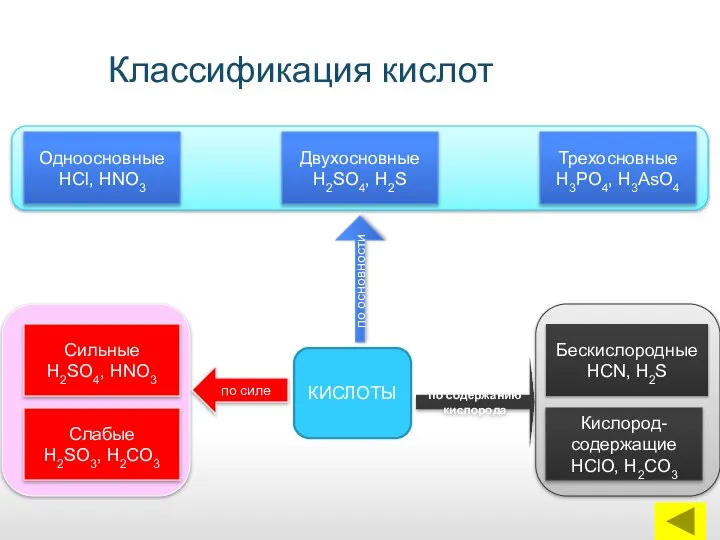
- 13. Классификация кислот КИСЛОТЫ Одноосновные НСl, НNО3 Сильные Н2SO4, НNО3 Слабые Н2SО3, Н2СО3 Кислород-содержащие НСlО, Н2СО3 Бескислородные
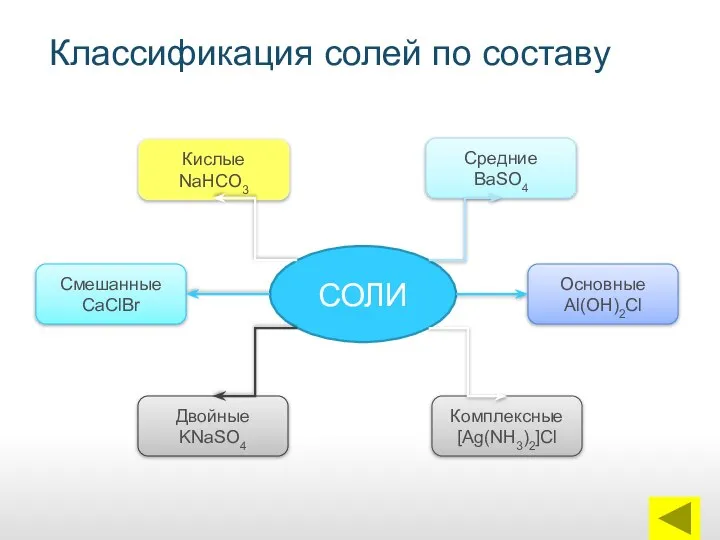
- 14. Классификация солей по составу СОЛИ Кислые NaHCO3 Смешанные CaClBr Двойные KNaSO4 Средние BaSO4 Основные Al(OH)2Cl Комплексные
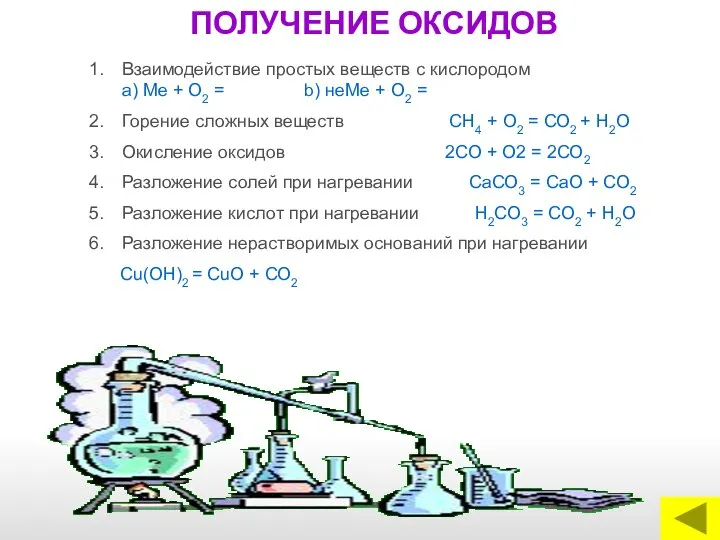
- 15. ПОЛУЧЕНИЕ ОКСИДОВ Взаимодействие простых веществ с кислородом a) Me + O2 = b) неМе + О2
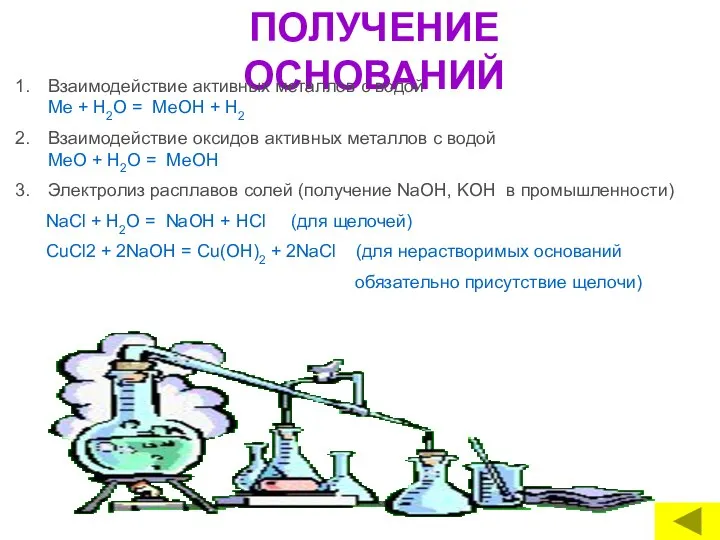
- 16. ПОЛУЧЕНИЕ ОСНОВАНИЙ Взаимодействие активных металлов с водой Me + Н2O = МеОН + Н2 Взаимодействие оксидов
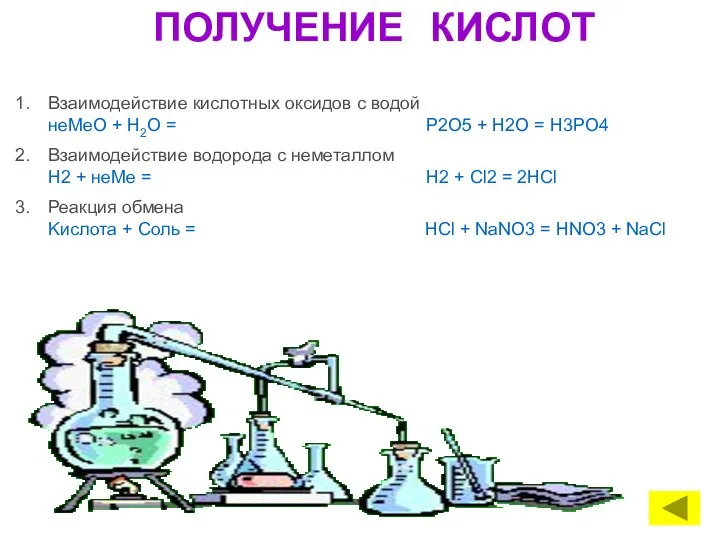
- 17. ПОЛУЧЕНИЕ КИСЛОТ Взаимодействие кислотных оксидов с водой неMeО + Н2O = P2O5 + H2O = H3PO4
- 18. ПОЛУЧЕНИЕ СОЛЕЙ Взаимодействием: Металла с неметаллом Са + Сl2 = СаСl Основного оксида с кислотным оксидом
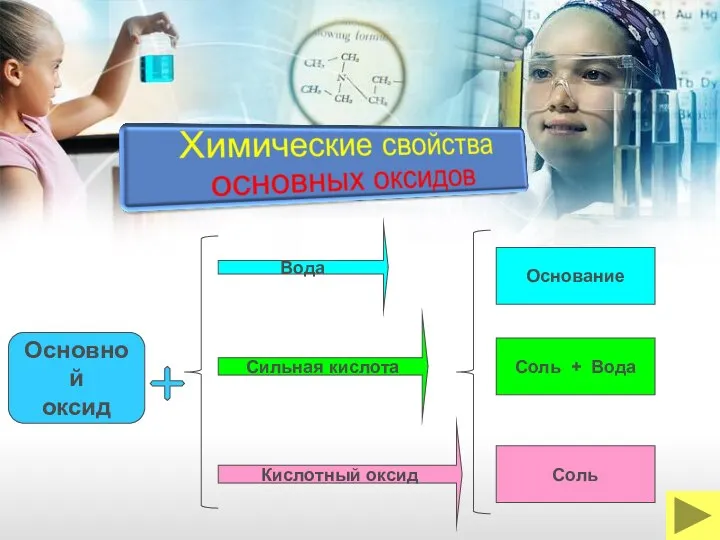
- 19. Вода Основной оксид Сильная кислота Кислотный оксид Основание Соль + Вода Соль
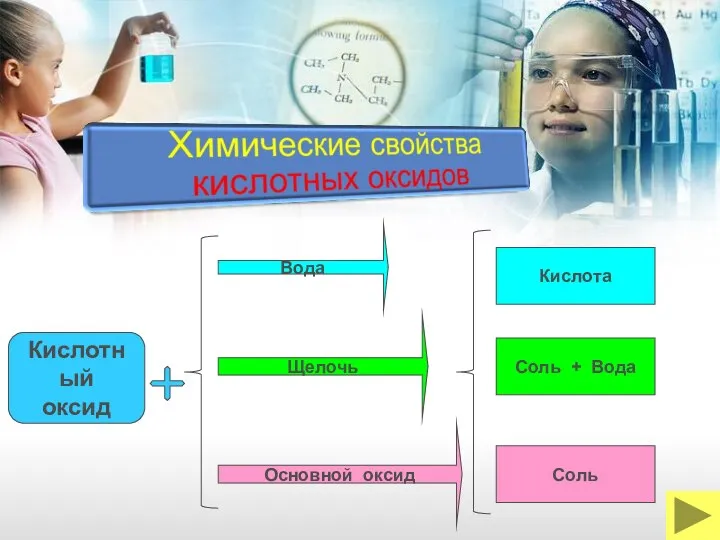
- 20. Вода Кислотный оксид Щелочь Основной оксид Кислота Соль + Вода Соль
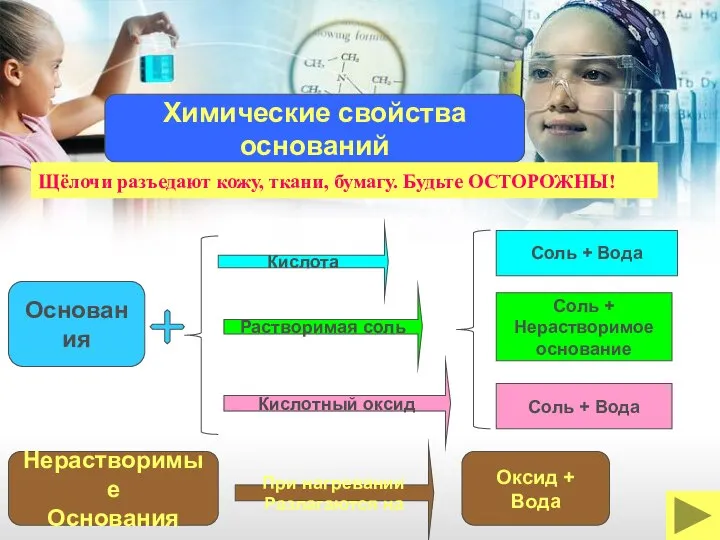
- 22. Кислота Основания Растворимая соль Кислотный оксид Соль + Вода Соль + Нерастворимое основание Соль + Вода
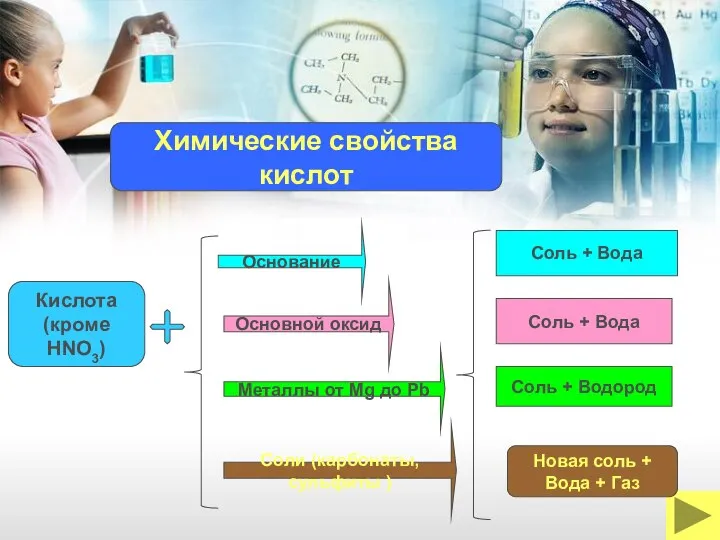
- 23. Основание Кислота (кроме HNO3) Металлы от Mg до Pb Основной оксид Соль + Вода Соль +
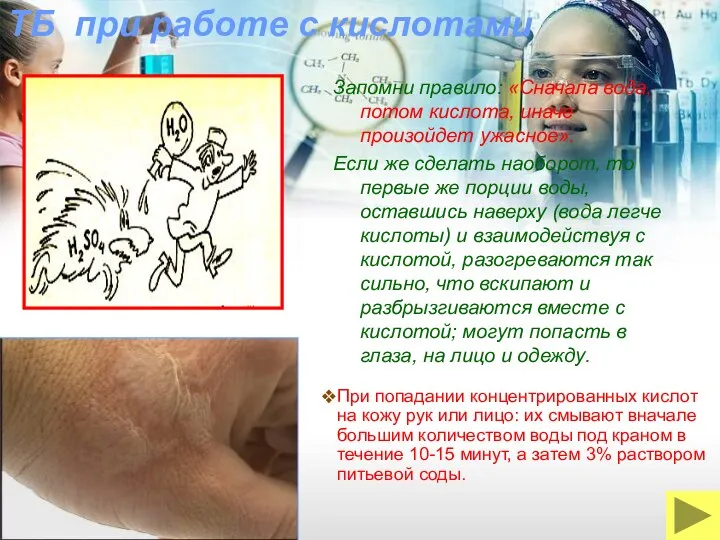
- 24. ТБ при работе с кислотами Запомни правило: «Сначала вода, потом кислота, иначе произойдет ужасное». Если же
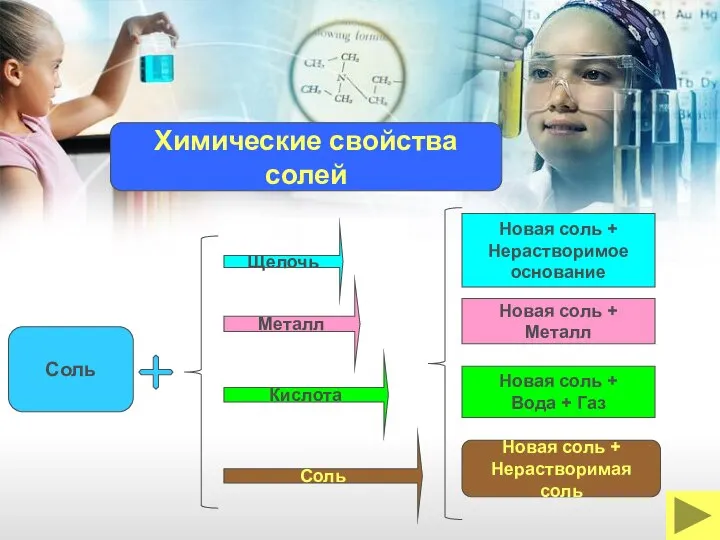
- 25. Щелочь Соль Кислота Металл Новая соль + Нерастворимое основание Новая соль + Вода + Газ Новая
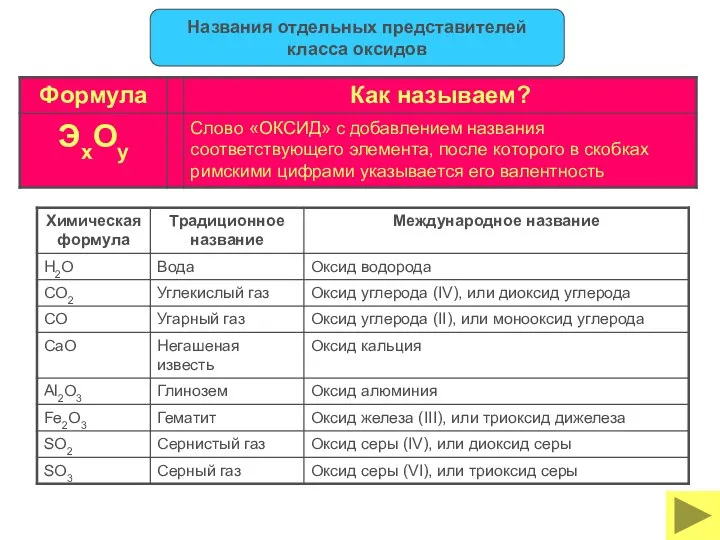
- 26. Названия отдельных представителей класса оксидов
- 28. Скачать презентацию






 Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Типы химических реакций
Типы химических реакций Dmitri Ivanovich Mendeleev
Dmitri Ivanovich Mendeleev Способы перегонки
Способы перегонки Эпоксидные смолы
Эпоксидные смолы Строение и свойства углеводов и липидов
Строение и свойства углеводов и липидов Свойства, получение и применение алканов. Циклоалканы
Свойства, получение и применение алканов. Циклоалканы Історія відкриття періодичної системи хімічних елементів Д. І. Меделєєва
Історія відкриття періодичної системи хімічних елементів Д. І. Меделєєва Введение. Классификации в аналитической химии. Типы реакций, применяемых в аналитической химии
Введение. Классификации в аналитической химии. Типы реакций, применяемых в аналитической химии Золото
Золото Актуальні питання і перспективи створення вікових ліків в Україні
Актуальні питання і перспективи створення вікових ліків в Україні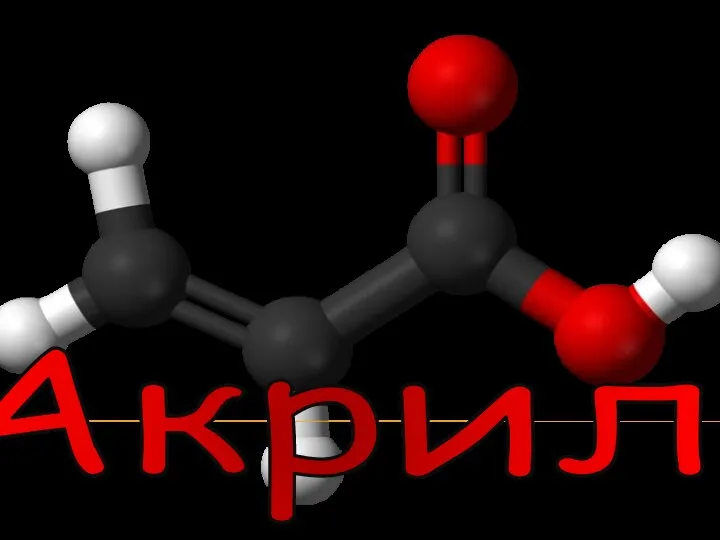 Акрил
Акрил  Основные характеристики химического равновесия:
Основные характеристики химического равновесия: Строение атома. Строение электронных оболочек атомов
Строение атома. Строение электронных оболочек атомов МУНИЦИПАЛЬНОЕ КАЗЕННОЕ ОБРАЗОВАТЕЛЬТНОЕ УЧРЕЖДЕНИЕ «СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №7» п.ВЛАДИМИРОВКА СТАВРОПОЛЬСКОГО КРА
МУНИЦИПАЛЬНОЕ КАЗЕННОЕ ОБРАЗОВАТЕЛЬТНОЕ УЧРЕЖДЕНИЕ «СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №7» п.ВЛАДИМИРОВКА СТАВРОПОЛЬСКОГО КРА Амедео Авогадро (1776-1856)
Амедео Авогадро (1776-1856) Дифференциация и индивидуализация как важный фактор повышения качества знаний обучающихся по химии
Дифференциация и индивидуализация как важный фактор повышения качества знаний обучающихся по химии Вещества. Классификация веществ
Вещества. Классификация веществ Высокомолекулярные соединения (ВМС)
Высокомолекулярные соединения (ВМС) Химия и производство
Химия и производство Полимеры и мономеры
Полимеры и мономеры Изучение влияния азотсодержащих удобрений на качество продукции по содержанию нитратов
Изучение влияния азотсодержащих удобрений на качество продукции по содержанию нитратов Неекономiчний фермент
Неекономiчний фермент Работу выполнил: ученик 11 класса Палкин Денис
Работу выполнил: ученик 11 класса Палкин Денис Имеет ли вода форму
Имеет ли вода форму Стероиды. Дицетин-холестерин-ацилтрансферазная реакция
Стероиды. Дицетин-холестерин-ацилтрансферазная реакция Описание основных типов магматических горных пород
Описание основных типов магматических горных пород Mass transfer process in chemical technologies
Mass transfer process in chemical technologies