Содержание
- 2. Органическая химия. Классическое определение науки органической химии дал немецкий химик К.Шорлеммер более 150 лет назад. «Органическая
- 3. Органическая химия. Состав Строение Свойства Применение Это логика и причинно-следственная связь всего курса органической химии. Главным
- 4. Органическая химия. На сегодняшний день органическая химия – один из самых крупных и важных разделов химии.
- 5. Особенности строения соединений углерода. Специфика органических соединений: Углерод – единственный элемент ПСХЭ, атомы которого способны образовывать
- 6. Электронное строение атома углерода. Теория строения органического вещества позволяет сделать вывод относительно углерода в связи с
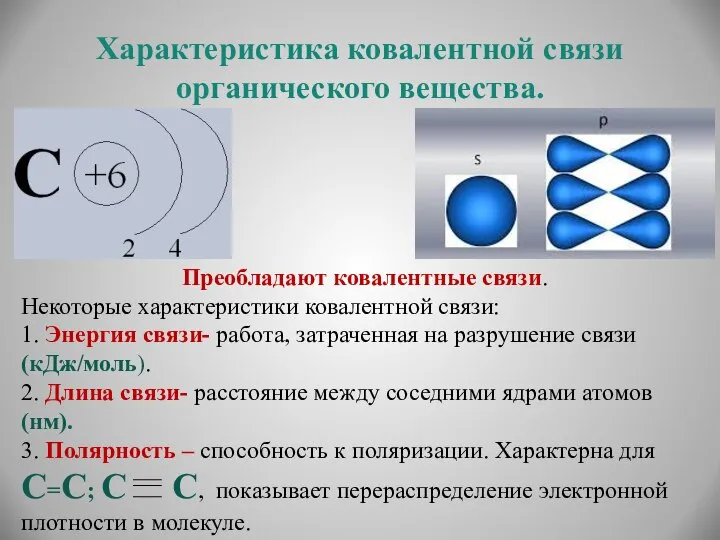
- 7. Характеристика ковалентной связи органического вещества. Преобладают ковалентные связи. Некоторые характеристики ковалентной связи: 1. Энергия связи- работа,
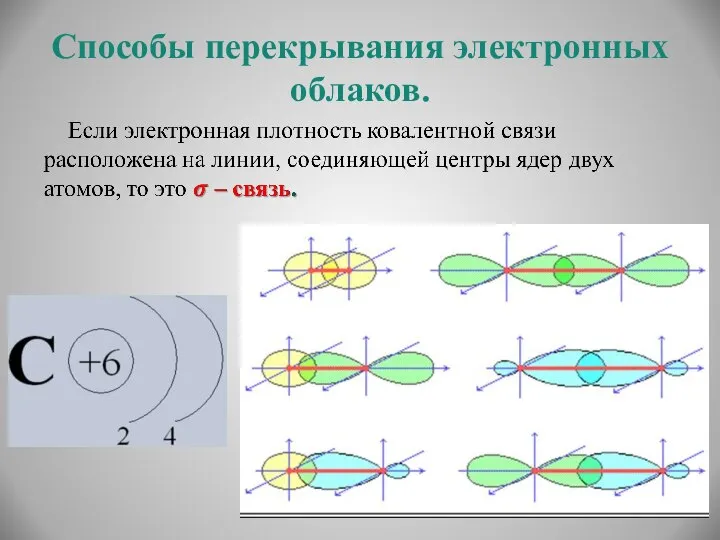
- 8. Способы перекрывания электронных облаков.
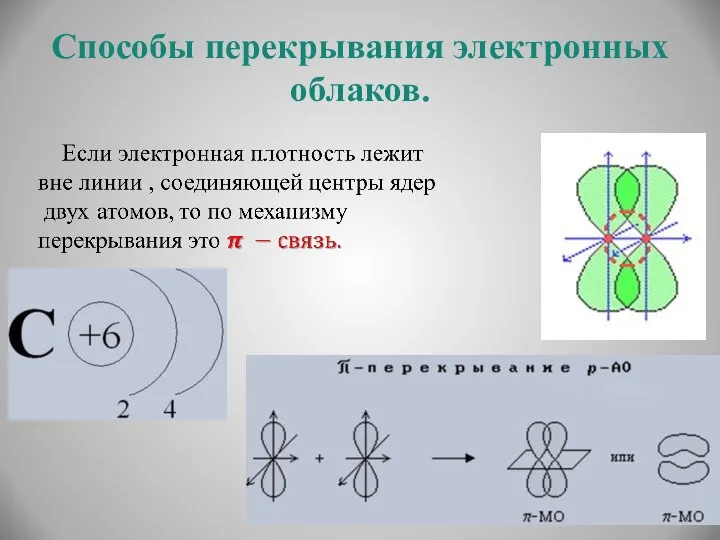
- 9. Способы перекрывания электронных облаков.
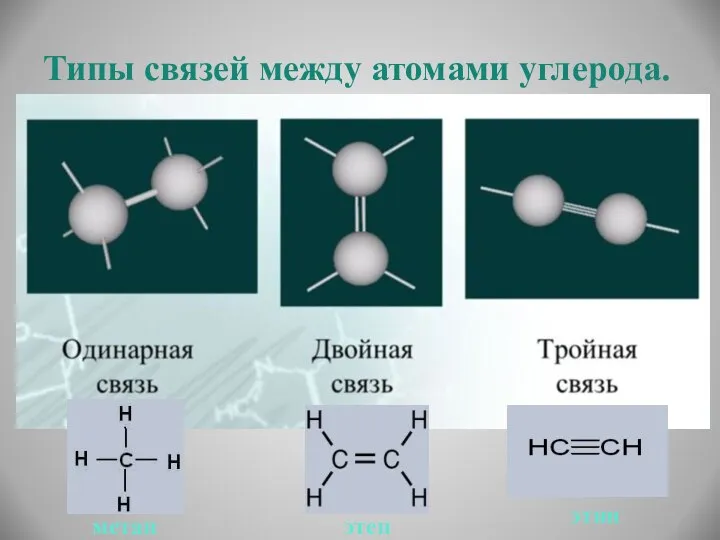
- 10. Типы связей между атомами углерода. метан этен этин
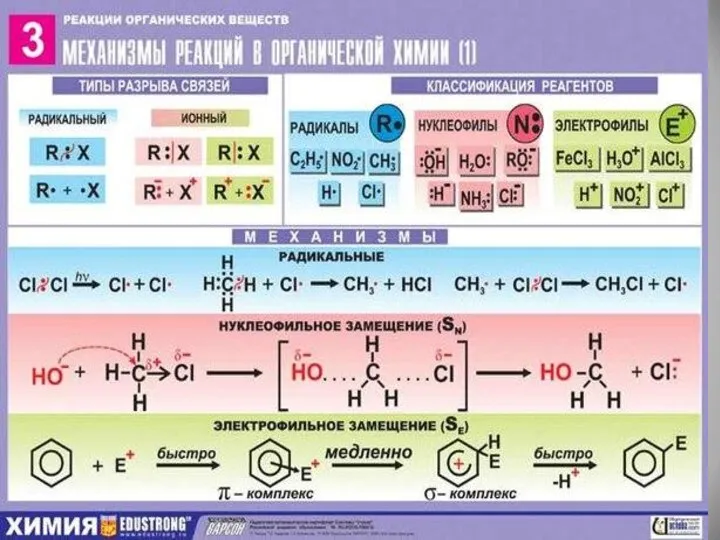
- 11. Способы разрыва ковалентной связи. Гомолитический (симметричный) – разрыв связи, при котором каждый атом получает по одному
- 12. Гибридизация атома углерода. Лайнус Карл Полинг (28.02.1901- 19.08.1994) Американский ученый. Первым успешно предсказал вторичную структуру белка.
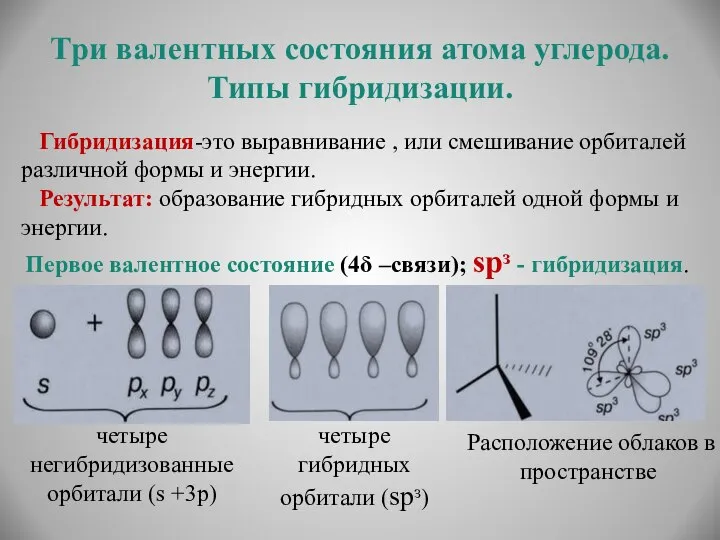
- 13. Три валентных состояния атома углерода. Типы гибридизации. Гибридизация-это выравнивание , или смешивание орбиталей различной формы и
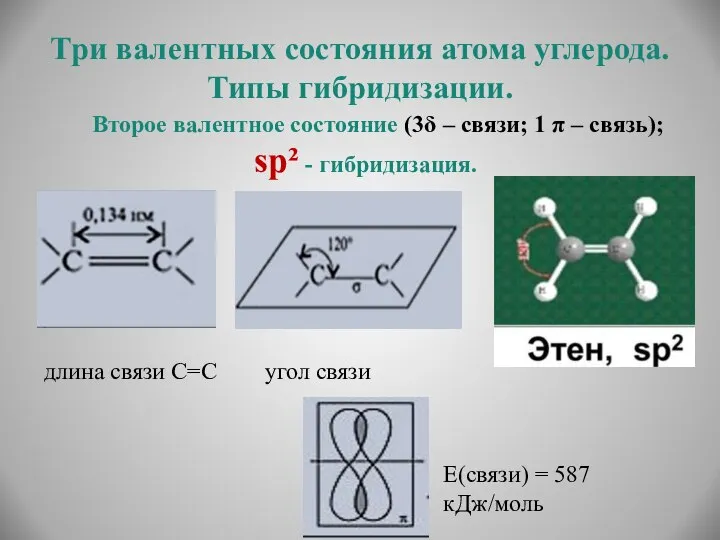
- 14. Три валентных состояния атома углерода. Типы гибридизации. Второе валентное состояние (3δ – связи; 1 π –
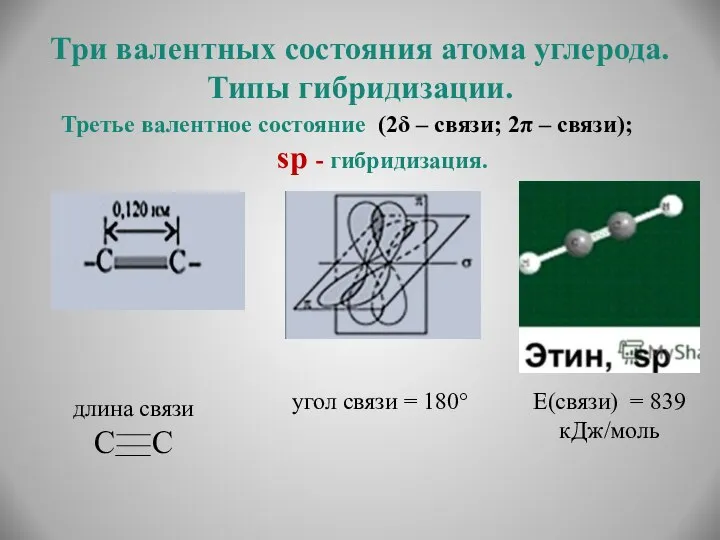
- 15. Три валентных состояния атома углерода. Типы гибридизации. Третье валентное состояние (2δ – связи; 2π – связи);
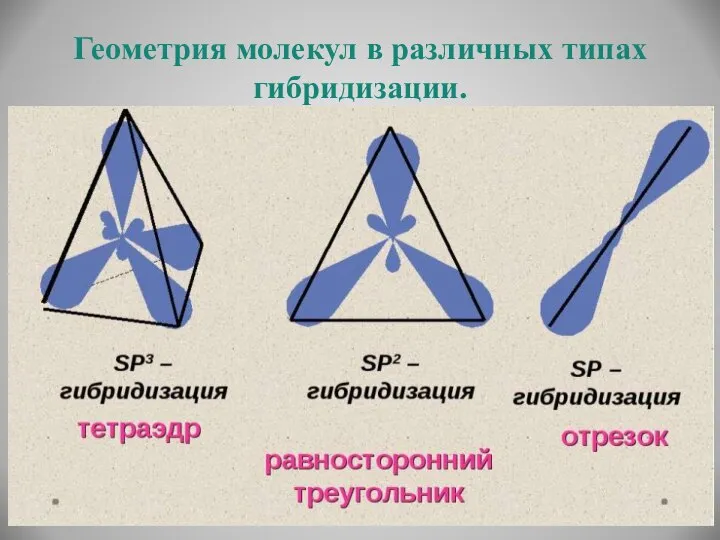
- 16. Геометрия молекул в различных типах гибридизации.
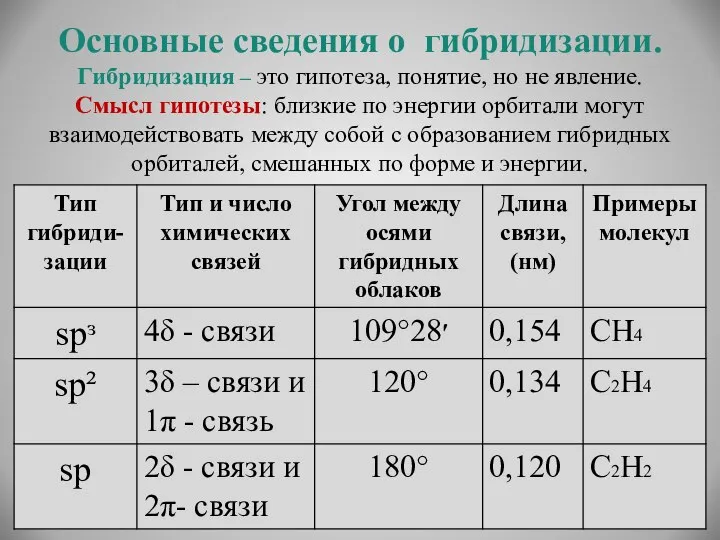
- 17. Основные сведения о гибридизации. Гибридизация – это гипотеза, понятие, но не явление. Смысл гипотезы: близкие по
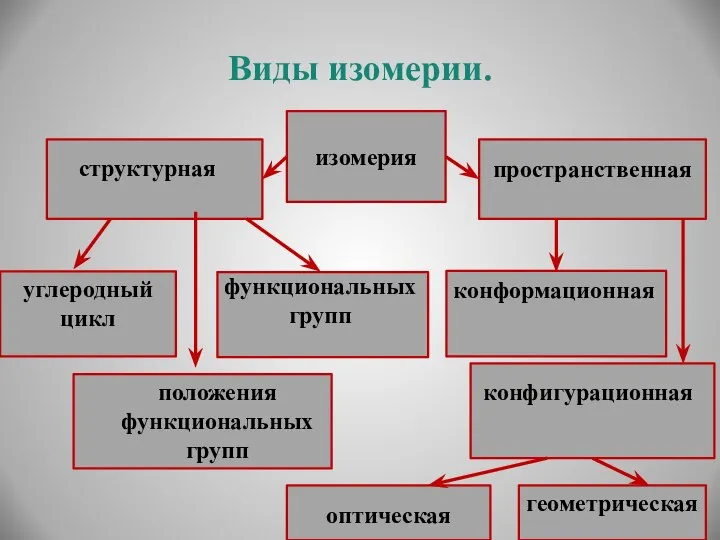
- 18. Виды изомерии. изомерия структурная пространственная углеродный цикл функциональных групп положения функциональных групп конфигурационная оптическая геометрическая конформационная
- 19. Классификация углеводородов.
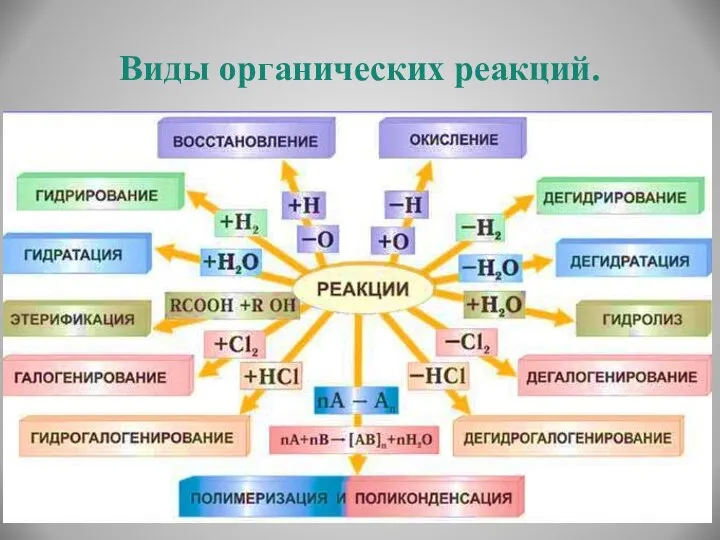
- 20. Виды органических реакций.
- 23. Скачать презентацию








 Презентация по Химии "синтетичні миючі засоби" - скачать смотреть бесплатно
Презентация по Химии "синтетичні миючі засоби" - скачать смотреть бесплатно Строение атома (8 класс)
Строение атома (8 класс) Топливо и его характеристики
Топливо и его характеристики Химический элемент сера
Химический элемент сера Важнейшие минералы
Важнейшие минералы Прикладная химия. Теплоперенос в химических реакторах и теплообменники
Прикладная химия. Теплоперенос в химических реакторах и теплообменники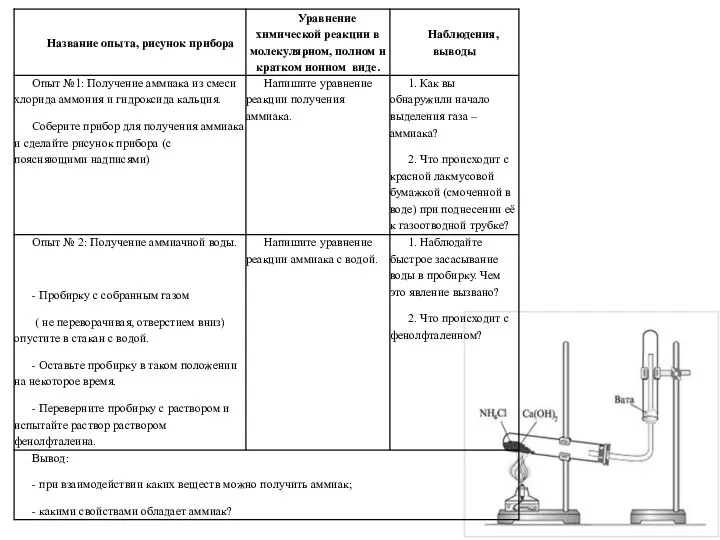 Получение аммиака и изучение его свойств
Получение аммиака и изучение его свойств Обобщение и систематизация знаний по теме: Общая характеристика химических элементов и химических реакций
Обобщение и систематизация знаний по теме: Общая характеристика химических элементов и химических реакций Виды присадок к моторному топливу. Керосин
Виды присадок к моторному топливу. Керосин Хром. Использование хрома
Хром. Использование хрома Азот
Азот Свойства солёной воды. Море у меня в стакане
Свойства солёной воды. Море у меня в стакане Изомеризация легких парафиновых углеводородов. Термогидрокаталитические процессы. Гидроочистка нефтяного сырья
Изомеризация легких парафиновых углеводородов. Термогидрокаталитические процессы. Гидроочистка нефтяного сырья Ячеечная модель реакторов
Ячеечная модель реакторов Предмет химии. Вещества и их физические свойства
Предмет химии. Вещества и их физические свойства Кислые породы повышенной щелочности и щелочные
Кислые породы повышенной щелочности и щелочные Сера. Аллотропные модификации
Сера. Аллотропные модификации Oxygen
Oxygen Что Вы ожидаете от занятия? Отметьте своё настроение.
Что Вы ожидаете от занятия? Отметьте своё настроение.  Получение и реакции пиразина
Получение и реакции пиразина Контроль в процессе обучения химии на старшей ступени школы
Контроль в процессе обучения химии на старшей ступени школы Химические явления. Уравнения химических реакций
Химические явления. Уравнения химических реакций Пестициды. Применение пестицидов
Пестициды. Применение пестицидов Химико-технологические процессы современных производств. Лекция №3
Химико-технологические процессы современных производств. Лекция №3 Методы контроля и анализа веществ
Методы контроля и анализа веществ Химия элементов VA группы
Химия элементов VA группы Гормоны
Гормоны Тест по неметаллам
Тест по неметаллам