Содержание
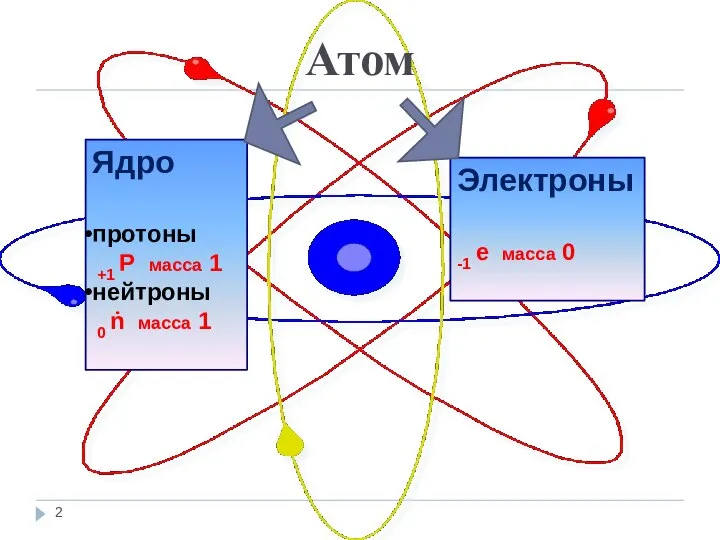
- 2. Атом Ядро протоны +1 Р масса 1 нейтроны 0 ṅ масса 1 Электроны -1 е масса
- 3. Запомни! Порядковый номер элемента = заряд ядра атома = числу протонов = числу электронов. Число нейтронов
- 4. Распределение электронов по уровням N=2n2 формула для вычисления количества электронов на энергетических уровнях. 1Й уровень -
- 5. Распределение электронов по уровням 1 уровень: 2ē
- 6. Распределение электронов по уровням 1 уровень: 2ē 2 уровень:8ē
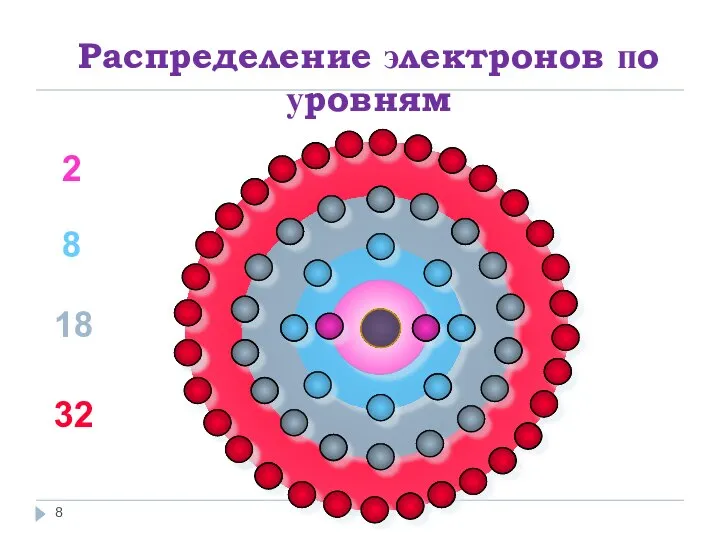
- 7. Распределение электронов по уровням 1 уровень-2 2 уровень-8 3 уровень-18
- 8. Распределение электронов по уровням 2 8 18 32
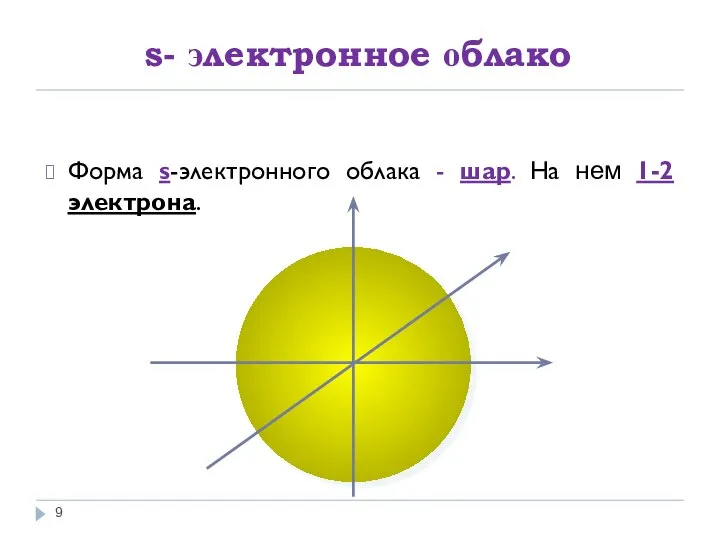
- 9. s- электронное облако Форма s-электронного облака - шар. На нем 1-2 электрона.
- 10. p- электронное облако Форма p-электронного облака - объёмная восьмёрка. На нем от 1 до 6 электронов.
- 11. Атом водорода №1 №1 - 1 электрон, 1 период - 1 слой, 1 группа –1 электрон
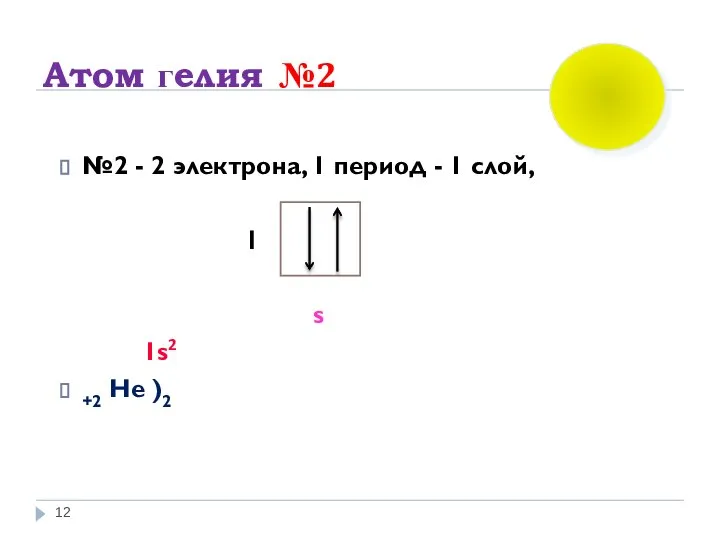
- 12. Атом гелия №2 №2 - 2 электрона, 1 период - 1 слой, I s 1s2 +2
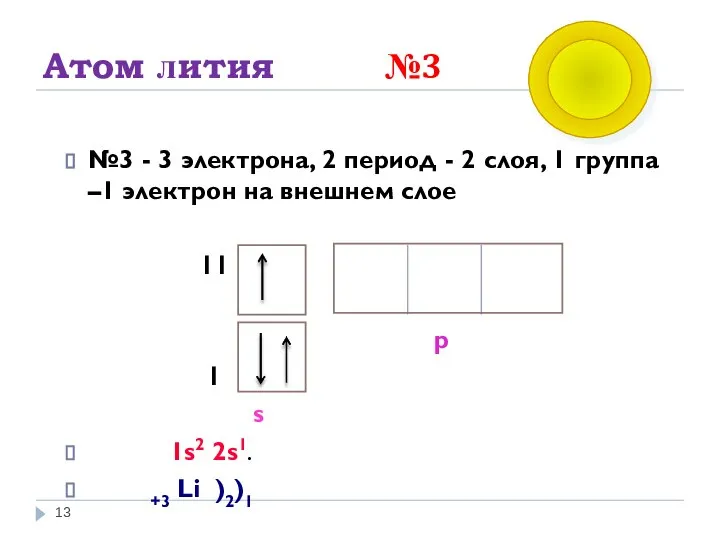
- 13. Атом лития №3 №3 - 3 электрона, 2 период - 2 слоя, 1 группа –1 электрон
- 14. Атом бериллия №4 №4 - 4 электрона, 2 период - 2 слоя, 2 группа – 2
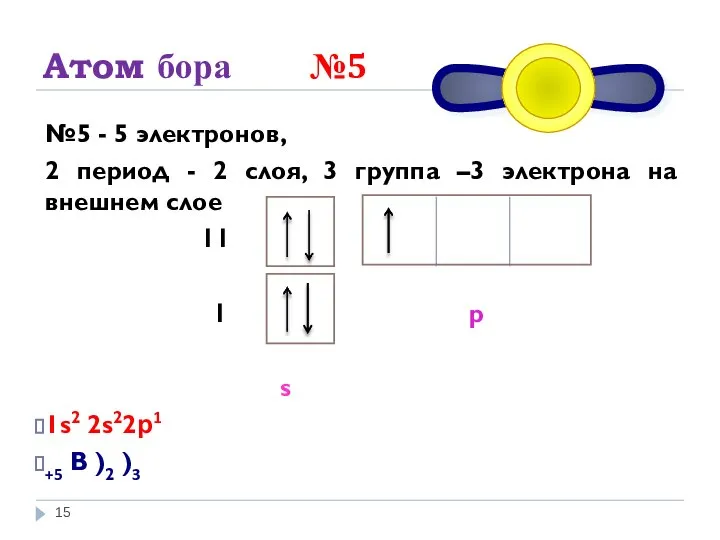
- 15. Атом бора №5 №5 - 5 электронов, 2 период - 2 слоя, 3 группа –3 электрона
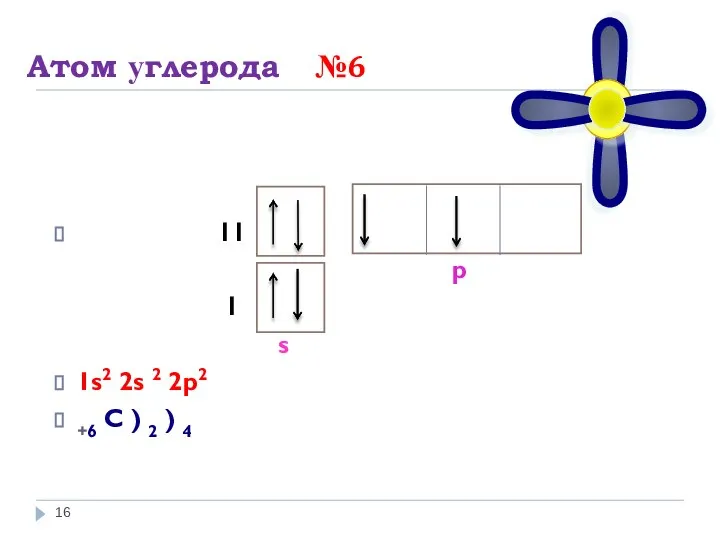
- 16. Атом углерода №6 I I р I s 1s2 2s 2 2p2 +6 С ) 2
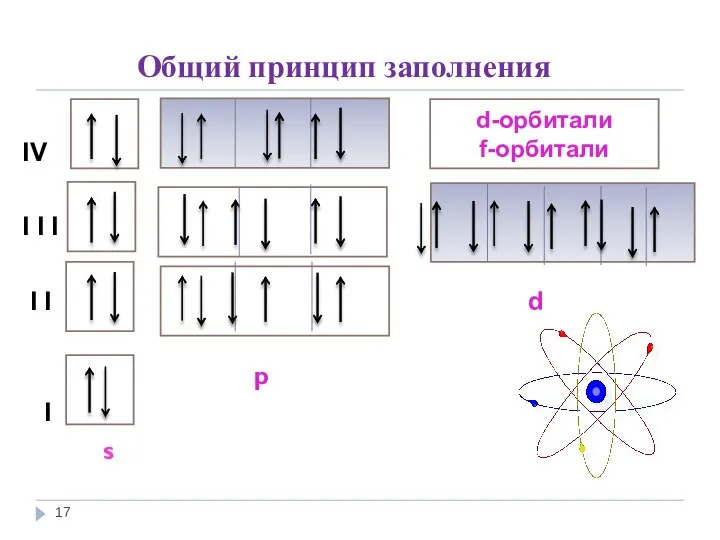
- 17. Общий принцип заполнения IV I I I I I d р I s d-орбитали f-орбитали
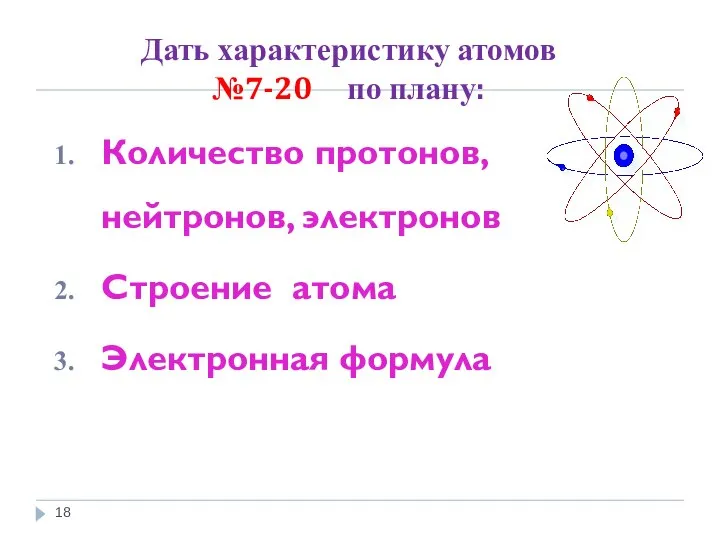
- 18. Дать характеристику атомов №7-20 по плану: Количество протонов, нейтронов, электронов Строение атома Электронная формула
- 20. Скачать презентацию








 Пищевые кислоты Выполнил: Черепнин Евгений Группа: ТХ-921
Пищевые кислоты Выполнил: Черепнин Евгений Группа: ТХ-921  Продовольча проблема і хімія Сочнєвої Ірини 11-А
Продовольча проблема і хімія Сочнєвої Ірини 11-А  Биоэнергетика. Современное представление о биологическом окислении
Биоэнергетика. Современное представление о биологическом окислении Непредельные углеводороды
Непредельные углеводороды Химическое равновесие и химическая кинетика
Химическое равновесие и химическая кинетика Презентация по Химии "Токсикологическая химия" - скачать смотреть
Презентация по Химии "Токсикологическая химия" - скачать смотреть  Жидкостно-сцинтилляционная спектроскопия
Жидкостно-сцинтилляционная спектроскопия Разбор заданий
Разбор заданий Автомобильные бензины
Автомобильные бензины Опасность озоновых дыр
Опасность озоновых дыр Начало нанотехнологической эры. Фуллерены
Начало нанотехнологической эры. Фуллерены Железо и его соединения
Железо и его соединения  Презентация по Химии "Спирты. Польза и вред" - скачать смотреть
Презентация по Химии "Спирты. Польза и вред" - скачать смотреть  Галогены
Галогены Металлическая связь. Агрегатные состояния вещества
Металлическая связь. Агрегатные состояния вещества Комплексные соединения. Природа химической связи: метод молекулярных орбиталей
Комплексные соединения. Природа химической связи: метод молекулярных орбиталей Решение задач на массовую долю вещества
Решение задач на массовую долю вещества Штучні і синтетичні волокна
Штучні і синтетичні волокна  Химические свойства спиртов
Химические свойства спиртов Три состояния вещества
Три состояния вещества Презентация по Химии "КОРРОЗИЯ МЕТАЛЛОВ" - скачать смотреть бесплатно
Презентация по Химии "КОРРОЗИЯ МЕТАЛЛОВ" - скачать смотреть бесплатно Химические свойства и применение кислорода
Химические свойства и применение кислорода Синильная Кислота - циановодород
Синильная Кислота - циановодород Окислительно-восстановительные реакции с участием органических веществ
Окислительно-восстановительные реакции с участием органических веществ Классификация реагентов и реакций в органической химии. (Лекция 4)
Классификация реагентов и реакций в органической химии. (Лекция 4) Химическая связь. Метод молекулярных орбиталей
Химическая связь. Метод молекулярных орбиталей Зависимость свойств химических элементов от положения в ПСХЭ
Зависимость свойств химических элементов от положения в ПСХЭ Метаболизм липидов
Метаболизм липидов