Содержание
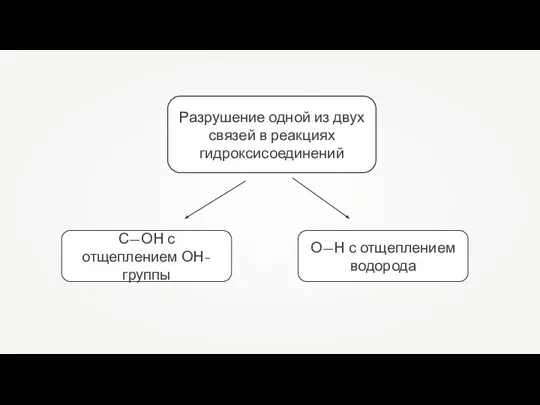
- 2. Разрушение одной из двух связей в реакциях гидроксисоединений
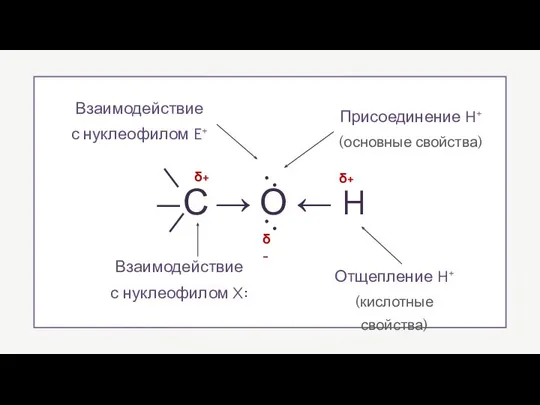
- 3. —С → О ← H .. .. δ+ δ+ δ- Отщепление H+ (кислотные свойства) Взаимодействие с
- 4. Гидроксисоединения могут вступать в многочисленные реакции, давая различные классы соединений.
- 5. Общие закономерности реакций спиртов: – реакционная способность первичных одноатомных спиртов выше, чем вторичных; – вторичные спирты
- 6. Взаимодействие с активными металлами (щелочными и щёлочноземельными) При взаимодействии с активными металлами спирты проявляют свойства слабых
- 7. Алкоголяты химически не стабильны и при действии воды гидролизуются с образованием спирта и гидроксида металла. C2H5OК
- 8. Спирты не взаимодействуют с растворами щелочей.
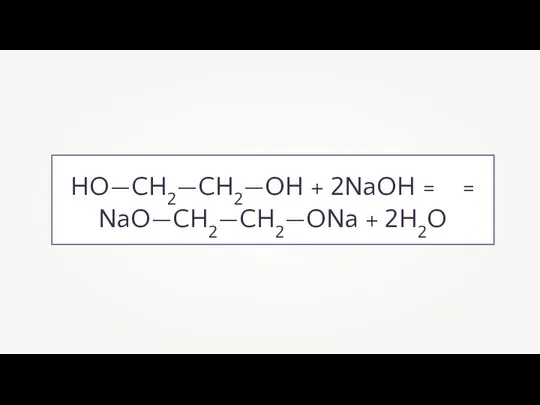
- 9. HO—CH2—CH2—OH + 2NaOH = = NaO—CH2—CH2—ONa + 2H2O
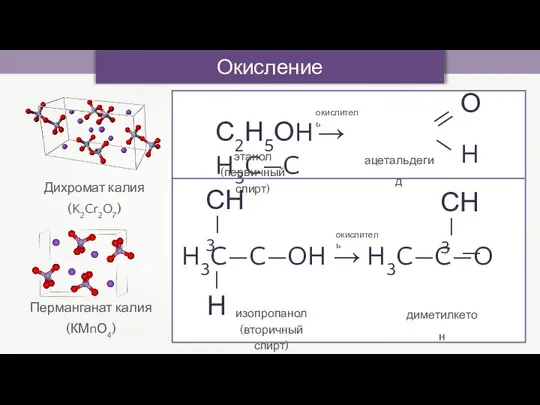
- 10. Окисление спиртов Дихромат калия (K2Cr2O7) Перманганат калия (КМnО4) С2Н5ОH → H3C—C — — H О —
- 11. Восстановление спиртов Восстановление спиртов приводит к образованию углеводородов, содержащих то же количество атомов углерода, что и
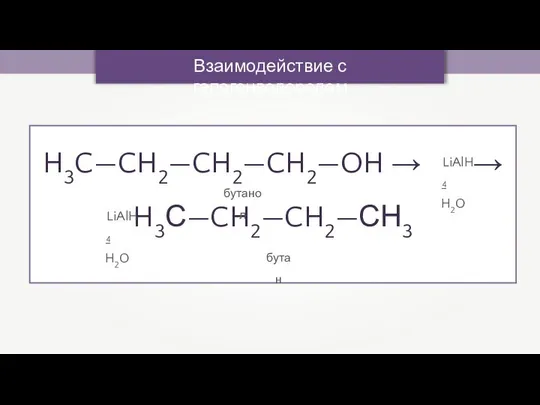
- 12. Взаимодействие с галогенводородом H3C—CH2—CH2—CH2—OH → → H3С—CH2—CH2—СН3 LiAlH4 - H2O LiAlH4 - H2O бутанол бутан
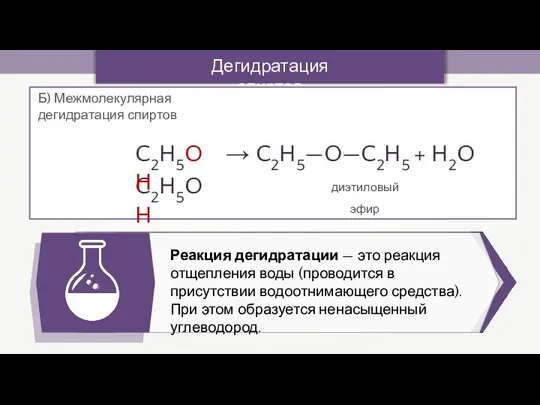
- 13. Дегидратация спиртов Реакция дегидратации — это реакция отщепления воды (проводится в присутствии водоотнимающего средства). При этом
- 14. Дегидратация спиртов Реакция дегидратации — это реакция отщепления воды (проводится в присутствии водоотнимающего средства). При этом
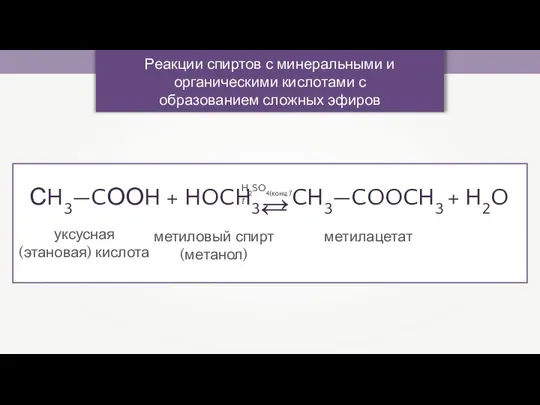
- 15. Реакции спиртов с минеральными и органическими кислотами с образованием сложных эфиров СH3—CООH + HOCH3 CH3—COOCH3 +
- 16. Горение спирта С2Н5ОН + 3О2 → 2СО2 + 3Н2О ∆Н = -1374 кДЖ
- 17. Спирты можно использовать для получения всевозможных органических соединений, применяемых в качестве органических растворителей при производстве полимеров,
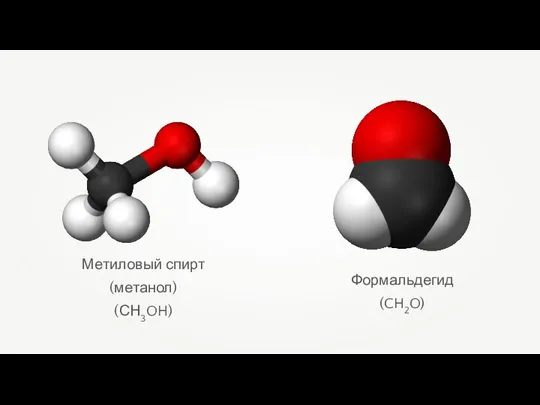
- 18. Метиловый спирт (метанол) (СН3OH) Формальдегид (CH2O)
- 19. Большие объёмы метанола используют при добыче и транспорте природного газа.
- 20. Метанол — наиболее токсичное соединение среди всех спиртов.
- 21. Этанол — исходное соединение для получения ацетальдегида, уксусной кислоты, а также для производства сложных эфиров карбоновых
- 22. Этанол — основной компонент всех спиртных напитков, его широко применяют в медицине как дезинфицирующее средство. VanHelsing.16
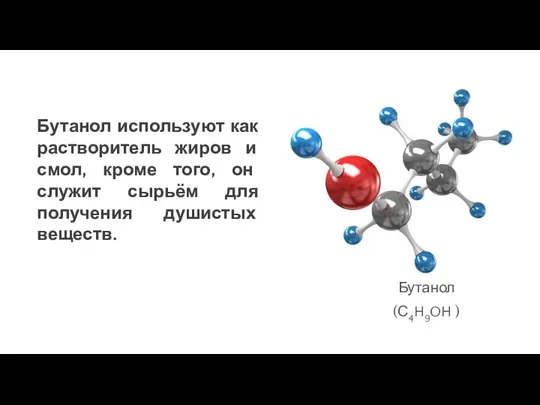
- 23. Бутанол используют как растворитель жиров и смол, кроме того, он служит сырьём для получения душистых веществ.
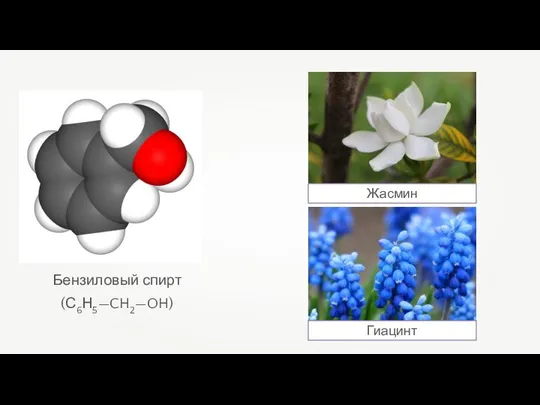
- 24. Бензиловый спирт (С6Н5—CH2—OH) Жасмин Гиацинт
- 26. Скачать презентацию












 Презентация Соединения химических элементов 8 класс.
Презентация Соединения химических элементов 8 класс.  Презентация по Химии "Волокнистые материалы вокруг нас" - скачать смотреть
Презентация по Химии "Волокнистые материалы вокруг нас" - скачать смотреть  Уксусная кислота. Продуценты. Практическое использование
Уксусная кислота. Продуценты. Практическое использование Электроды 1 рода
Электроды 1 рода Анилин. История создания
Анилин. История создания Применение кремния
Применение кремния Состав, свойства и перегонка нефти. Нефтепродукты
Состав, свойства и перегонка нефти. Нефтепродукты Металдар. металдардың периодтық жүйедегі орны. Металдардың құрылысы
Металдар. металдардың периодтық жүйедегі орны. Металдардың құрылысы Предельные углеводороды
Предельные углеводороды Строение электронных оболочек атомов химических элементов 8 класс
Строение электронных оболочек атомов химических элементов 8 класс Количество вещества. Молярная масса. Задачи
Количество вещества. Молярная масса. Задачи Курс хімії за 11 клас
Курс хімії за 11 клас Темір. Жалпы сипаттама. Периодтық жүйедегі орны және атом құрылысы
Темір. Жалпы сипаттама. Периодтық жүйедегі орны және атом құрылысы Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение
Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение Химия ғажайыптар әлемі
Химия ғажайыптар әлемі КРАХМАЛ и ЦЕЛЛЮЛОЗА (С6Н10О5)n
КРАХМАЛ и ЦЕЛЛЮЛОЗА (С6Н10О5)n Нітратна кислота. Нітрати Підготувала:Рибальчук Вікторія
Нітратна кислота. Нітрати Підготувала:Рибальчук Вікторія  Введение в общую химию. Основные понятия химии
Введение в общую химию. Основные понятия химии Качественные и количественные методы обработки хроматограмм
Качественные и количественные методы обработки хроматограмм Алкильные, амидные и тетраметилалюминатные комплексы редкоземельных элементов с тридентатным амидинатным лигандом. Синтез
Алкильные, амидные и тетраметилалюминатные комплексы редкоземельных элементов с тридентатным амидинатным лигандом. Синтез Plastics. General characteristics. Classification. Composition. The main types of plastics, their appointment
Plastics. General characteristics. Classification. Composition. The main types of plastics, their appointment Оксид цинка
Оксид цинка Презентация по Химии "Озоновый слой - щит Земли" - скачать смотреть
Презентация по Химии "Озоновый слой - щит Земли" - скачать смотреть  Презентация по Химии "«Основания»" - скачать смотреть
Презентация по Химии "«Основания»" - скачать смотреть  Кристалл Гришина Л.А., учитель физики МКС(К) ОУ С (К) ОШ 37 I II вида г. Новосибирск
Кристалл Гришина Л.А., учитель физики МКС(К) ОУ С (К) ОШ 37 I II вида г. Новосибирск Сверхпроводимость как явление микромира
Сверхпроводимость как явление микромира Электролиз. Урок химии 11 класс
Электролиз. Урок химии 11 класс Неорганические соединения галогенов
Неорганические соединения галогенов