Содержание
- 2. Дихромат калия K2Cr2O7 Дихромат калия K2Cr2O7 Оксид никеля (II) NiO Оксид магния MgO Магний Золото Медь
- 3. Химическая связь - взаимодействие между атомами, приводящее к образованию устойчивой системы - молекулы, иона, кристалла Л.
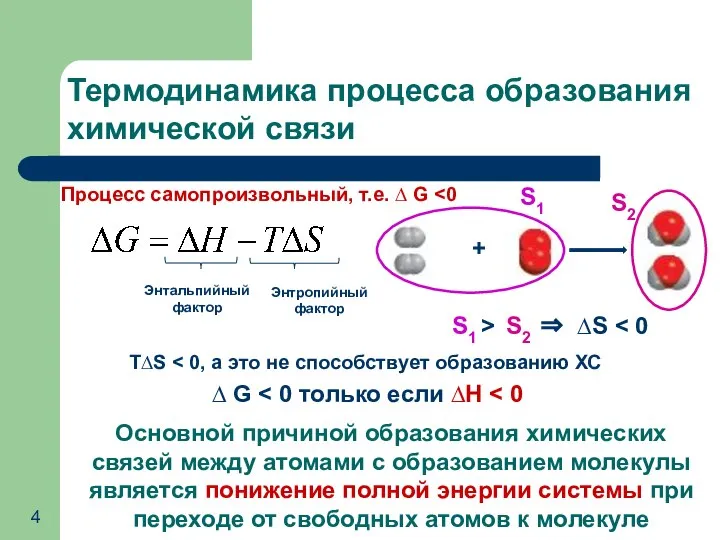
- 4. Термодинамика процесса образования химической связи Процесс самопроизвольный, т.е. ∆ G S1 > S2 ⇒ ∆S Т∆S
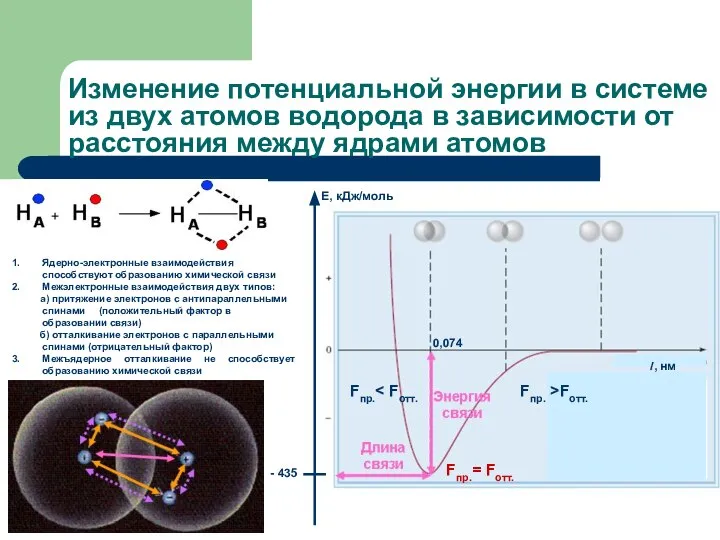
- 5. Изменение потенциальной энергии в системе из двух атомов водорода в зависимости от расстояния между ядрами атомов
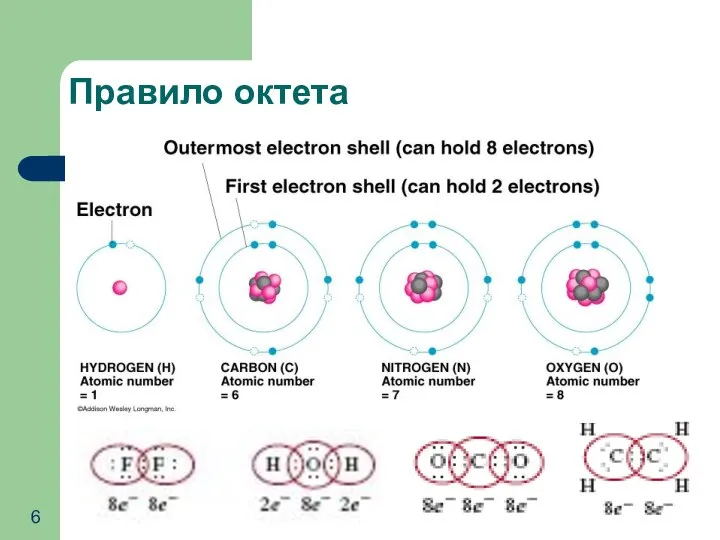
- 6. Правило октета
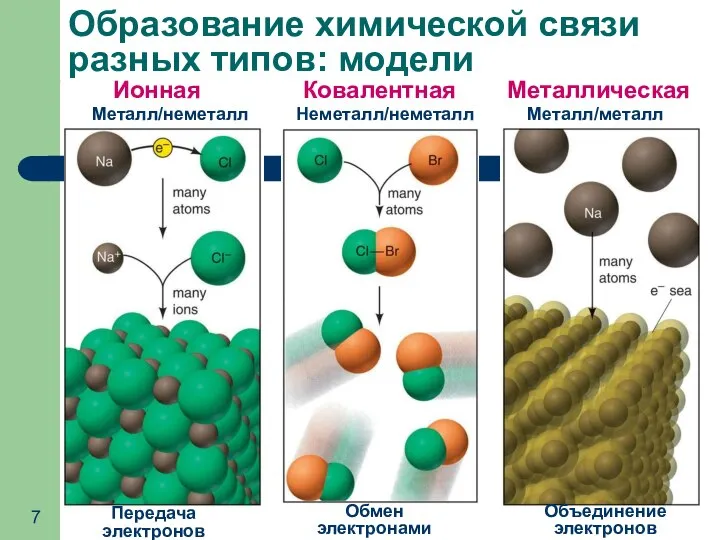
- 7. Образование химической связи разных типов: модели Передача электронов Обмен электронами Объединение электронов Ионная Ковалентная Металлическая Металл/неметалл
- 8. Ионная связь: Энергия кристаллической решетки Энергия кристаллической решетки – энергия, необходимая для превращения 1 моль твердого
- 9. Hard, rigid solids at room temperature High melting point Dissolve in polar solvents (if soluble) Solutions
- 10. Ковалентная связь Атомы, образующие ковалентную связь, обобществляют электроны Каждая ковалентная связь образуется 2 общими электронами В
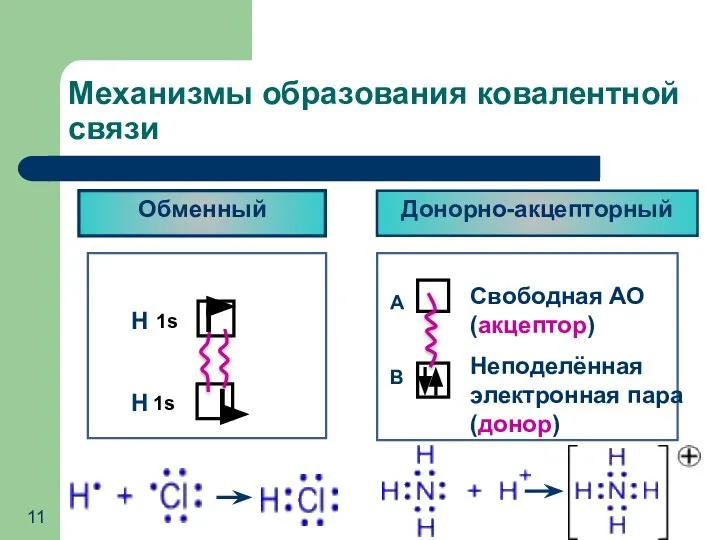
- 11. Механизмы образования ковалентной связи Обменный Донорно-акцепторный
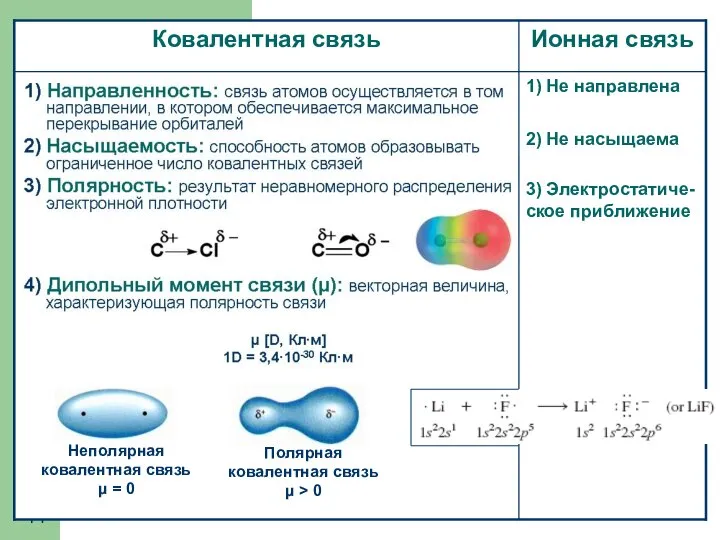
- 12. Характеристики ковалентной связи 1) Длина связи – расстояние между центрами связанных атомов 2) Валентный угол –
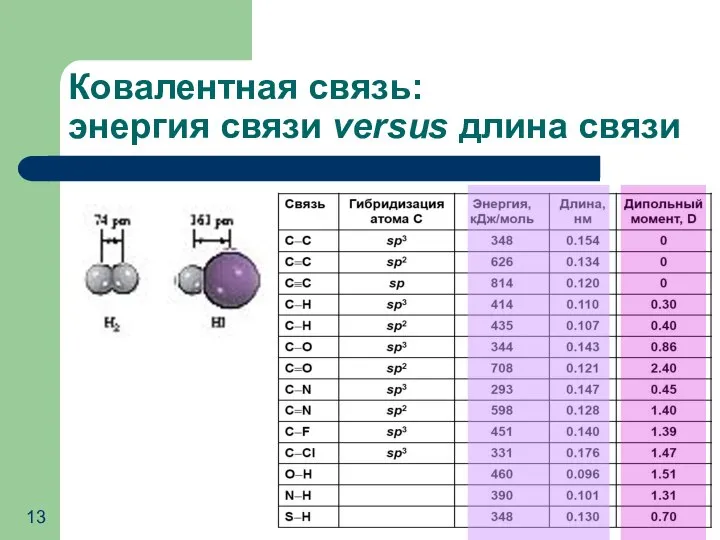
- 13. Ковалентная связь: энергия связи versus длина связи
- 14. 1) Не направлена 2) Не насыщаема 3) Электростатиче-ское приближение
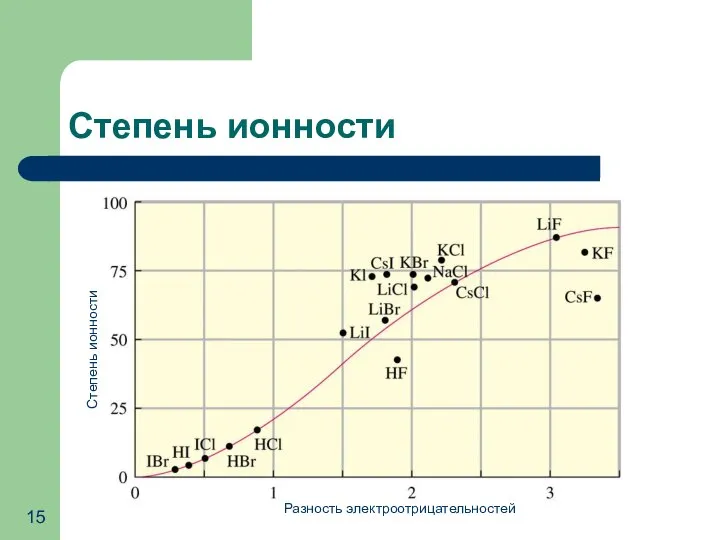
- 15. Степень ионности Разность электроотрицательностей Степень ионности
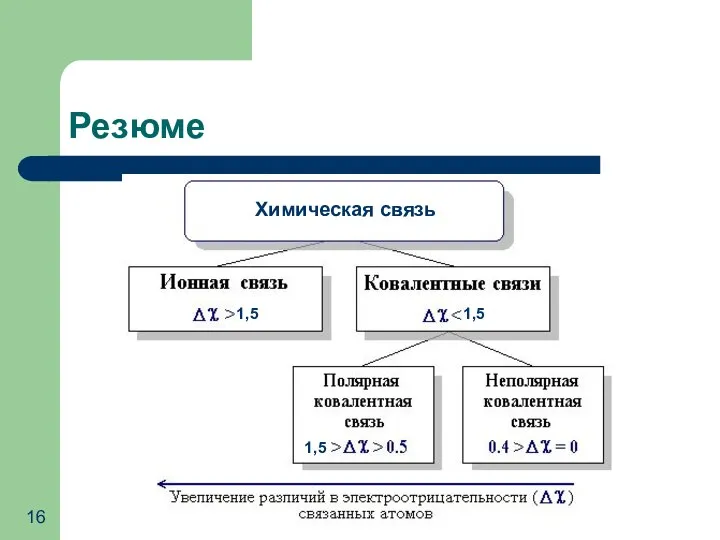
- 16. Резюме
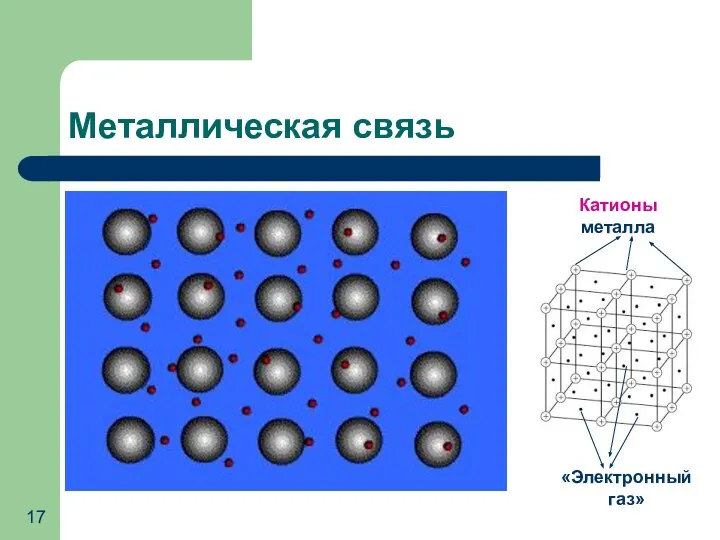
- 17. Металлическая связь Катионы металла «Электронный газ»
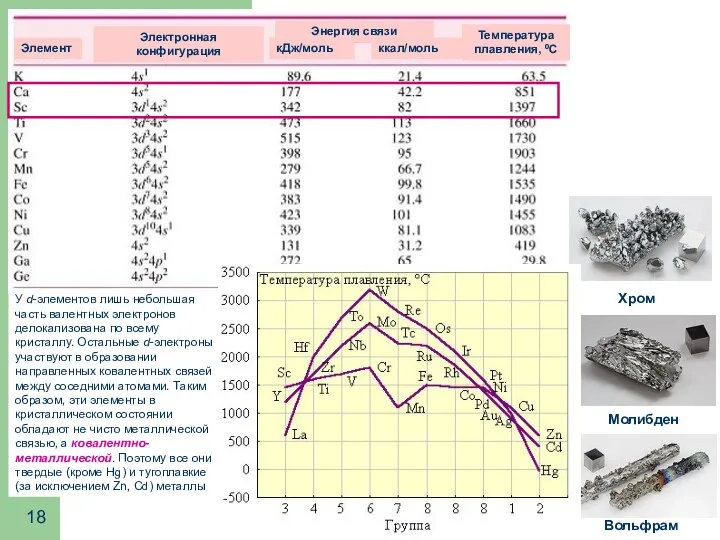
- 18. У d-элементов лишь небольшая часть валентных электронов делокализована по всему кристаллу. Остальные d-электроны участвуют в образовании
- 19. Межмолекулярные взаимодействия Водородная связь Слабые межмолекулярные взаимодействия (силы Ван-дер-Ваальса) Диполь-дипольные Ион-дипольные Дисперсионные
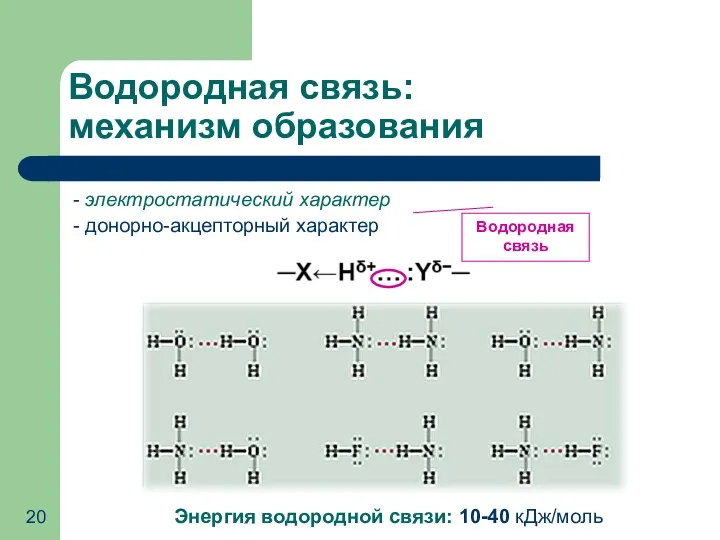
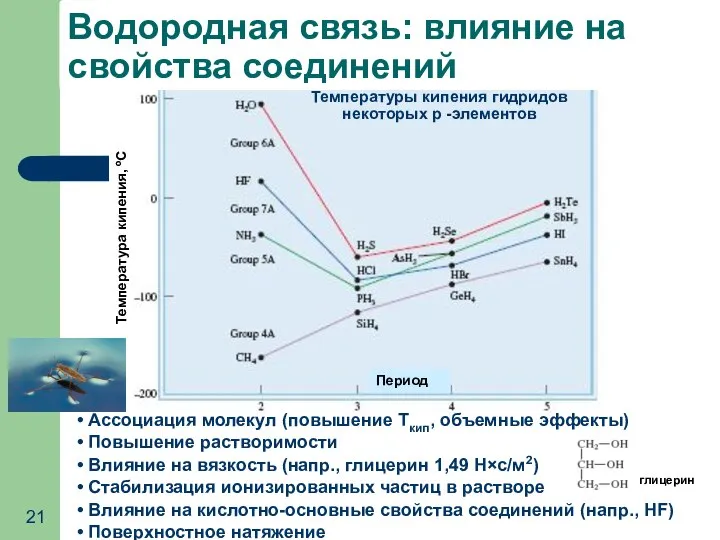
- 20. Водородная связь: механизм образования - электростатический характер - донорно-акцепторный характер Энергия водородной связи: 10-40 кДж/моль Водородная
- 21. Ассоциация молекул (повышение Ткип, объемные эффекты) Повышение растворимости Влияние на вязкость (напр., глицерин 1,49 Н×с/м2) Стабилизация
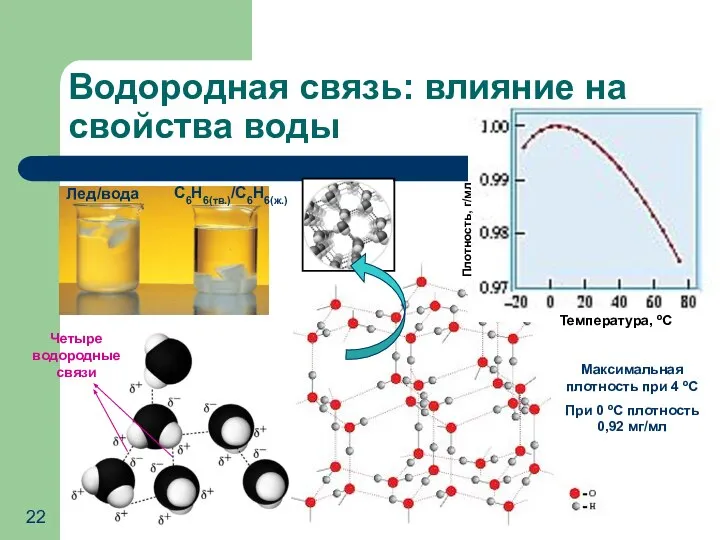
- 22. Водородная связь: влияние на свойства воды Лед/вода С6Н6(тв.)/С6Н6(ж.) Температура, ºС Плотность, г/мл Четыре водородные связи Максимальная
- 23. Ориентационные силы, диполь-дипольное притяжение Осуществляется между молекулами, являющимися постоянными диполями E ~ 1/r3 Дисперсионное притяжение (лондоновские
- 25. Скачать презентацию








 Лекция № 18 Тема: Равновесия комплексообразования и их роль в аналитической химии
Лекция № 18 Тема: Равновесия комплексообразования и их роль в аналитической химии Электрохимические методы. Потенциометрический анализ объектов окружающей среды
Электрохимические методы. Потенциометрический анализ объектов окружающей среды Излучение и поглощение света атомами. Виды спектров, спектральный анализ
Излучение и поглощение света атомами. Виды спектров, спектральный анализ Презентация по Химии "Анализ тенденций развития химии" - скачать смотреть
Презентация по Химии "Анализ тенденций развития химии" - скачать смотреть  Загальна характеристика галогенів. (Тема 7)
Загальна характеристика галогенів. (Тема 7) Иммунохимические методы. Иммуноферментный анализ (ИФА )
Иммунохимические методы. Иммуноферментный анализ (ИФА ) ПРЕЗЕНТАЦІЯ З ХІМІЇ НА ТЕМУ: АЦЕТИЛЕН
ПРЕЗЕНТАЦІЯ З ХІМІЇ НА ТЕМУ: АЦЕТИЛЕН  Основы промышленной экологии. Занятие 2
Основы промышленной экологии. Занятие 2 Переосаждение. (Глава 4. § 20. Задача 12)
Переосаждение. (Глава 4. § 20. Задача 12)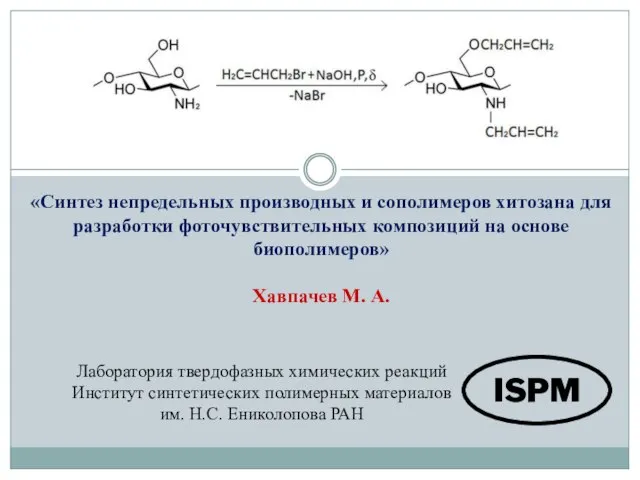 Синтез непредельных производных и сополимеров хитозана для разработки фоточувствительных композиций на основе биополимеров
Синтез непредельных производных и сополимеров хитозана для разработки фоточувствительных композиций на основе биополимеров Органическая химия
Органическая химия Woda jako rozpuszczalnik
Woda jako rozpuszczalnik Интересные факты о нефти
Интересные факты о нефти Пантотен қышқылы (В3 дәрумені)
Пантотен қышқылы (В3 дәрумені) Номенклатура и изомерия Соловова Е.А., учитель химии высшей квалификационной категории МОУ «СОШ №15 г. Балашова Саратовской облас
Номенклатура и изомерия Соловова Е.А., учитель химии высшей квалификационной категории МОУ «СОШ №15 г. Балашова Саратовской облас Амины
Амины Качество питьевой воды
Качество питьевой воды Глина. Минералы, содержащиеся в глинах
Глина. Минералы, содержащиеся в глинах Производные пиррозилидина. (Лекция 6)
Производные пиррозилидина. (Лекция 6) Lekcii_ - 2017-lech_ped 11
Lekcii_ - 2017-lech_ped 11 Производство низших олефинов
Производство низших олефинов Введение в экологическую токсикологию
Введение в экологическую токсикологию «Химия в искусстве»
«Химия в искусстве»  Гранулометрический метод контроля
Гранулометрический метод контроля Гидролиз солей урок химии (11 класс) частный случай реакции ионного обмена одно из химических свойств солей
Гидролиз солей урок химии (11 класс) частный случай реакции ионного обмена одно из химических свойств солей Кислоты и основания. (Лекция 16)
Кислоты и основания. (Лекция 16) Презентация по Химии "Интересные факты из Д. И. Менделеева" - скачать смотреть
Презентация по Химии "Интересные факты из Д. И. Менделеева" - скачать смотреть  Типы химических реакций в органической химии
Типы химических реакций в органической химии