Содержание
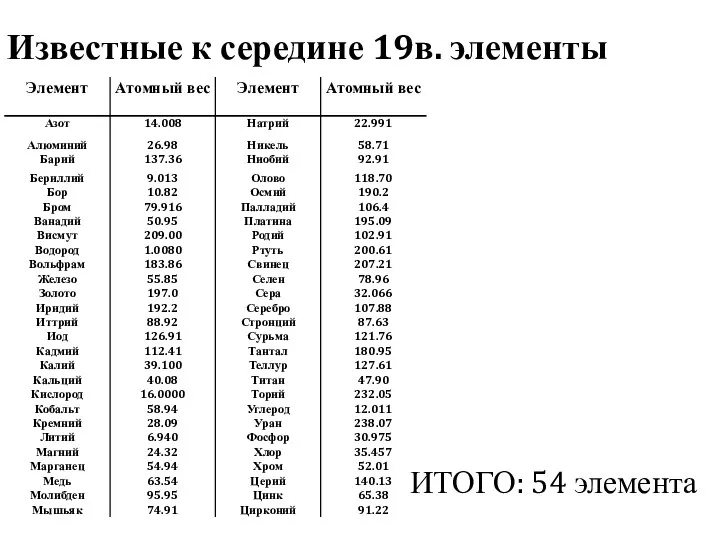
- 2. Известные к середине 19в. элементы ИТОГО: 54 элемента
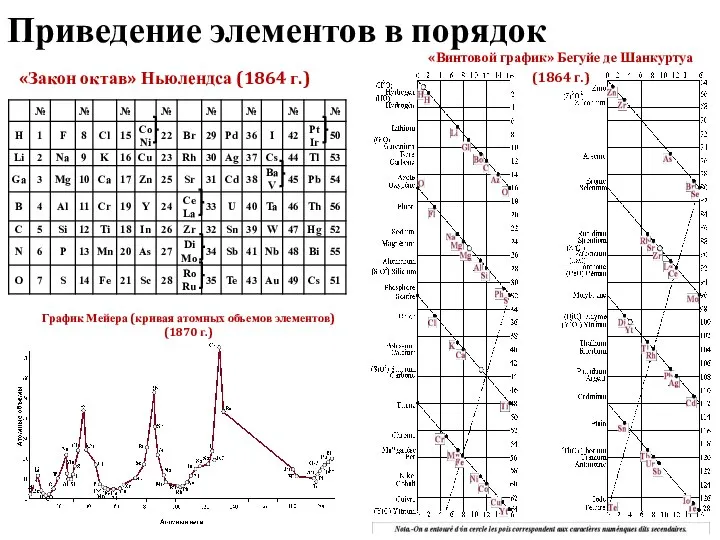
- 3. Приведение элементов в порядок «Закон октав» Ньюлендса (1864 г.) «Винтовой график» Бегуйе де Шанкуртуа (1864 г.)
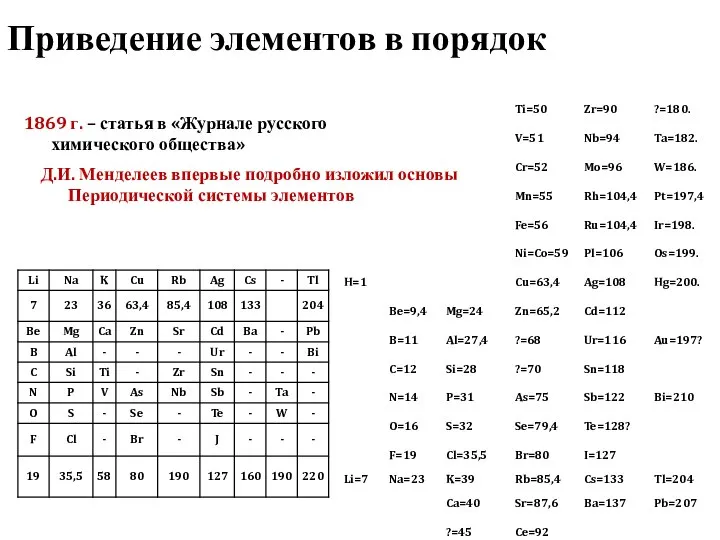
- 4. Но въ ней, мнЂ кажется, уже ясно выражается примђнимость выставляемаго мною начала ко всей совокупности элементов,
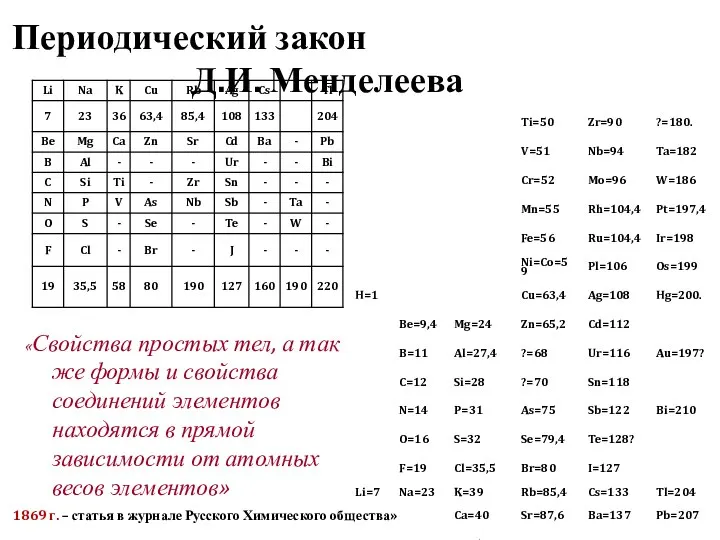
- 5. Периодический закон Д.И. Менделеева «Свойства простых тел, а так же формы и свойства соединений элементов находятся
- 6. Строение атома Атом – мельчайшая неделимая частица вещества V век до нашей эры Демокрит Э. Резерфорд
- 7. Строение атома Атом – сложная электромагнитная система, включающая элементарные частицы - нуклоны (протоны, нейтроны) и электроны
- 8. Квантово-механическая модель атома Л. де Бройль 1924 г. …волновые и корпускулярные свойства квантовой частицы фундаментальным образом
- 9. Квантово-механическая модель атома Величина, пропорциональная вероятности нахождения электрона в некотором объеме, окружающем точку с координатами x,
- 10. Квантовые числа
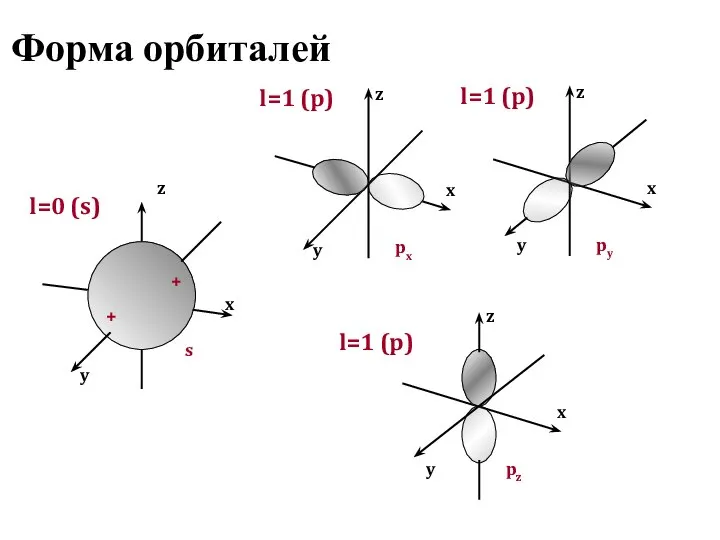
- 11. Форма орбиталей y x z l=0 (s) s + + y x z px l=1 (p)
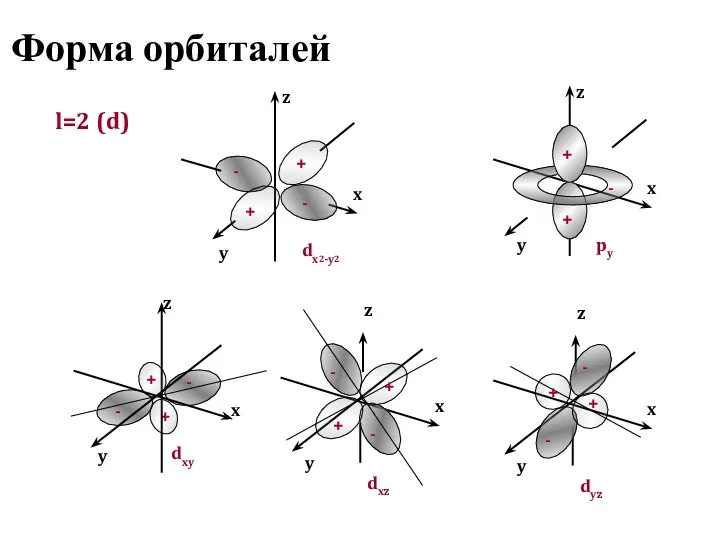
- 12. Форма орбиталей l=2 (d) + y x z dx2-y2 y x z py y x z
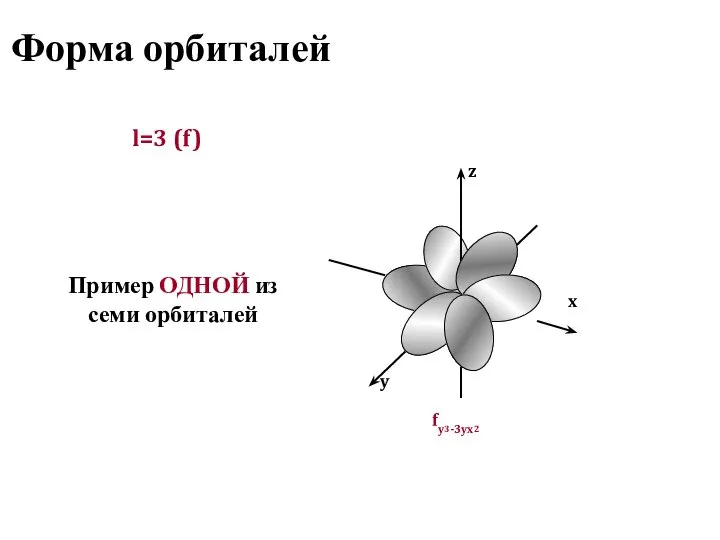
- 13. Форма орбиталей l=3 (f) Пример ОДНОЙ из семи орбиталей
- 14. Основные принципы заполнения орбиталей электронами Zэфф – на электрон внешнего уровня действует заряд меньшего истинного заряда
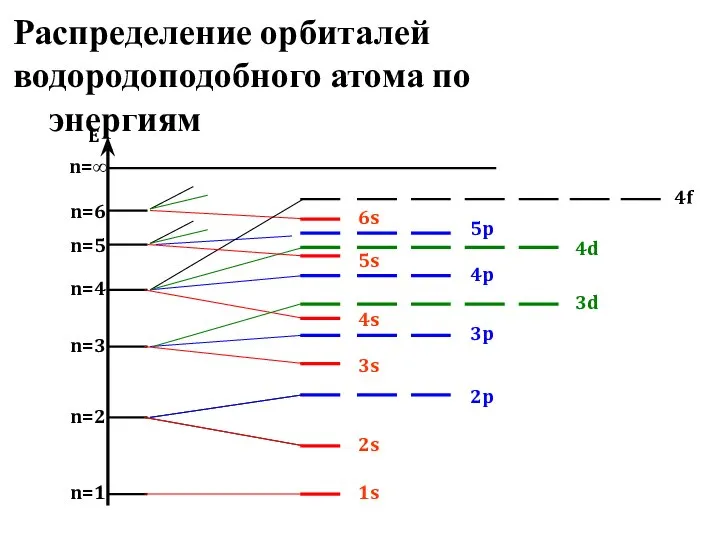
- 15. Распределение орбиталей водородоподобного атома по энергиям
- 16. Основные принципы заполнения орбиталей электронами Принцип наименьшей энергии В многоэлектронном атоме стабильной является такая конфигурация, для
- 17. Основные принципы заполнения орбиталей электронами Принцип Паули В атоме не существует двух электронов, состояние которых описывается
- 18. Примеры построения электронных конфигураций атомов
- 19. Основные характеристики атомов Размер атома Энергетические характеристики, включая потенциал ионизации и сродство к электрону Спектральные характеристики
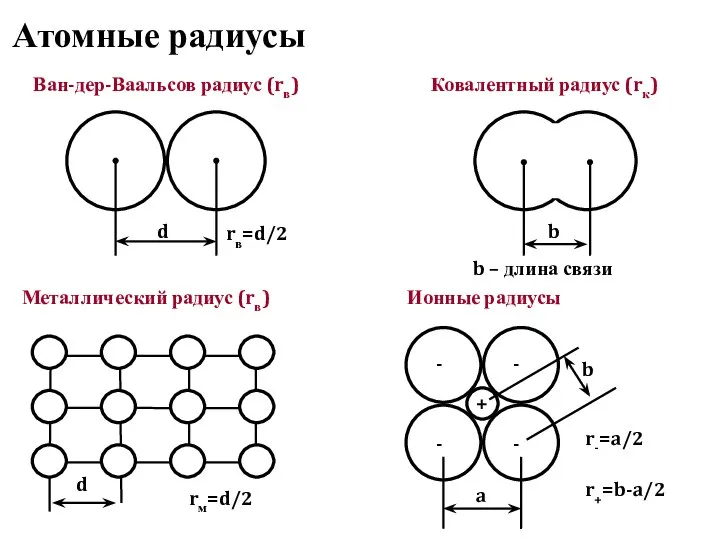
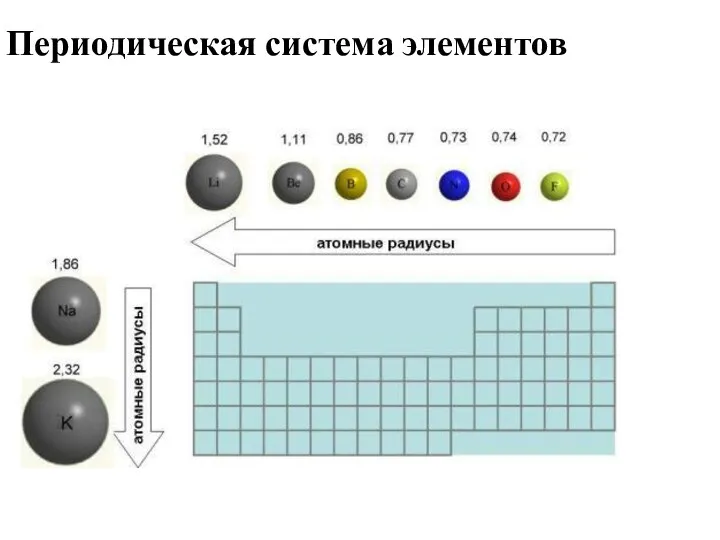
- 20. Атомные радиусы d r+=b-a/2 Ван-дер-Ваальсов радиус (rв) b Ковалентный радиус (rк) rв=d/2 b – длина связи
- 21. Потенциал ионизации Сродство к электрону Минимальная энергия, которую необходимо затратить для удаления электрона из атома, находящегося
- 22. Магнитный момент μэфф – Эффективный магнитный момент Z Z>>30 – основной вклад: спин-орбитальное взаимодействие – суммарный
- 23. Но въ ней, мнЂ кажется, уже ясно выражается примђнимость выставляемаго мною начала ко всей совокупности элементов,
- 24. Периодический закон Д.И. Менделеева «Свойства простых веществ, а так же формы и свойства соединений элементов находятся
- 25. Периодическая система элементов
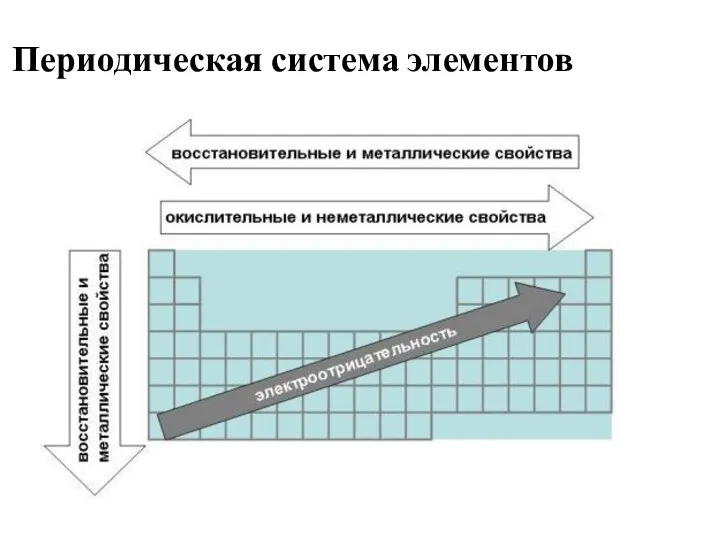
- 26. Периодическая система элементов
- 28. Скачать презентацию














 ОБЩАЯ ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ ЛИТЕРАТУРА: Мухленов И.П. «Общая химическая технология» - М.: Высшая школа, 1984, ч.1-2, 264с. Гутник С.
ОБЩАЯ ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ ЛИТЕРАТУРА: Мухленов И.П. «Общая химическая технология» - М.: Высшая школа, 1984, ч.1-2, 264с. Гутник С. Поли- и гетерофункциональные соединения
Поли- и гетерофункциональные соединения Проектно-исследовательская деятельность обучающихся. Часть 2
Проектно-исследовательская деятельность обучающихся. Часть 2 Строение электронных оболочек атомов химических элементов 8 класс
Строение электронных оболочек атомов химических элементов 8 класс Аренкарбонільні комплекси металів у реакціях перфлюороалкілювання та деароматизації
Аренкарбонільні комплекси металів у реакціях перфлюороалкілювання та деароматизації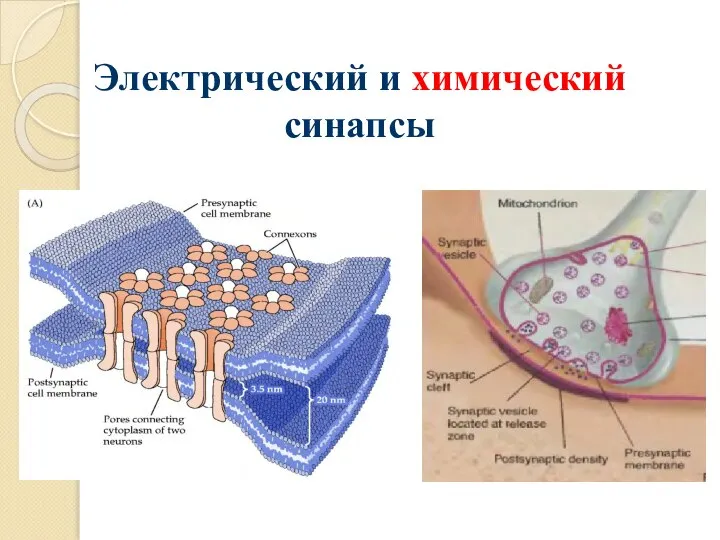 Электрический и химический синапсы
Электрический и химический синапсы Атом құрылысы
Атом құрылысы Твердофазное восстановление металлов и образование карбидов из хромовых концентратов Аганозерского месторождения
Твердофазное восстановление металлов и образование карбидов из хромовых концентратов Аганозерского месторождения Основы электрохимии
Основы электрохимии Химический диктант
Химический диктант Буферные растворы
Буферные растворы Гетероатомные соединения нефти
Гетероатомные соединения нефти Шкідливі хімічні речовини, забруднювачі атмосфери
Шкідливі хімічні речовини, забруднювачі атмосфери Амфотерні оксиди та гідроксиди
Амфотерні оксиди та гідроксиди Железо. Свойства железа, получение
Железо. Свойства железа, получение Амедео Авогадро
Амедео Авогадро Методы защиты металлов от электрохимической коррозии. Классификация методов защиты
Методы защиты металлов от электрохимической коррозии. Классификация методов защиты Современные оборудования в лаборатории
Современные оборудования в лаборатории Фосфор
Фосфор Железо от начала времен до конца средних веков
Железо от начала времен до конца средних веков Комплексные соединения
Комплексные соединения солі в природі Солі препарати замінення атомів водної кислоти
солі в природі Солі препарати замінення атомів водної кислоти  «ШАРИКИ СЧАСТЬЯ» Неустроева Светлана Габдульхатовна, учитель I категории, МБОУ «СОШ №31», г.Нижнекамск
«ШАРИКИ СЧАСТЬЯ» Неустроева Светлана Габдульхатовна, учитель I категории, МБОУ «СОШ №31», г.Нижнекамск Oxygen, O2
Oxygen, O2 Гидрохимические определения. Методы определения растворенного кислорода в воде
Гидрохимические определения. Методы определения растворенного кислорода в воде Нафталин
Нафталин Адам ағзасындағы химиялық элементтер
Адам ағзасындағы химиялық элементтер Насыпная плотность, методы определения, примеры
Насыпная плотность, методы определения, примеры