Содержание
- 2. Расчет рН растворов электролитов проводится по следующим (упрощенным) формулам: сильных одноосновных кислот pH = – lgC
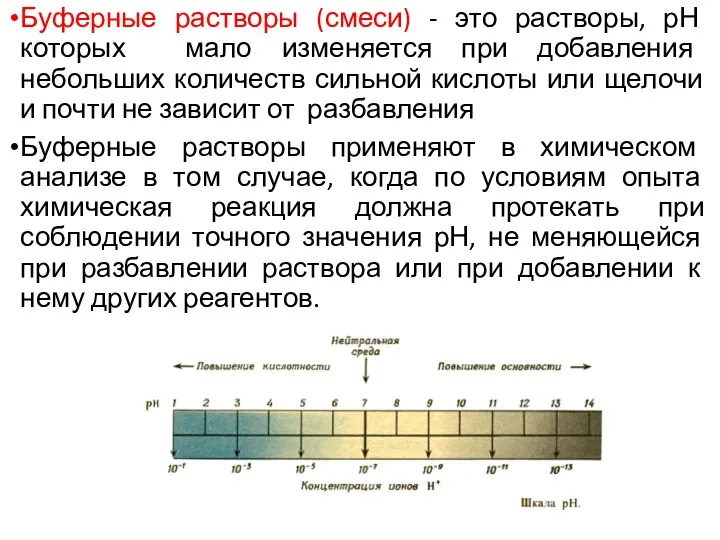
- 3. Буферные растворы (смеси) - это растворы, рН которых мало изменяется при добавления небольших количеств сильной кислоты
- 4. Роль буферных систем в живых организмах В процессе метаболизма в нашем организме выделяется много кислот –
- 5. Виды буферных смесей : слабая кислота и ее соль, слабое основание и его соль, кислая и
- 6. 1. Ацетатный буфер: 3. Фосфатный буфер: 2. Бикарбонатный буфер: Аммиачный буфер: Классификация: а) кислотные б) основные
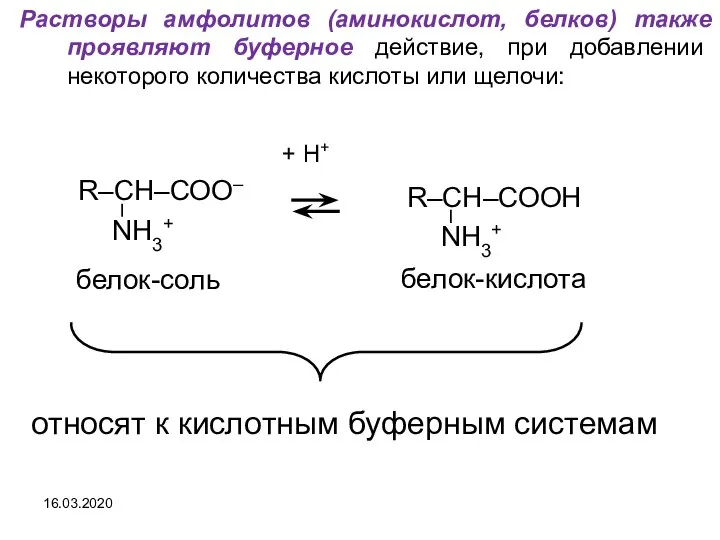
- 7. 16.03.2020 + Н+ белок-соль белок-кислота относят к кислотным буферным системам Растворы амфолитов (аминокислот, белков) также проявляют
- 8. Причина возникновения в растворах нового качества – буферного действия – заключается в совмещении протолитических равновесий (в
- 9. Например, ацетатная буферная система состоит из СН3СООН и СН3СООNa. В результате полной диссоциации соли в растворе
- 10. Если к раствору добавить сильное основание, то гидроксид-ионы будут нейтрализоваться слабой кислотой с образованием молекул воды:
- 11. Или этот процесс можно представить схематично. В ацетатном буферном растворе устанавливается равновесие: СH3COOH ↔ H+ +
- 12. Буферная смесь поддерживает рН постоянным только при условии, что количество прибавляемых к раствору сильной кислоты или
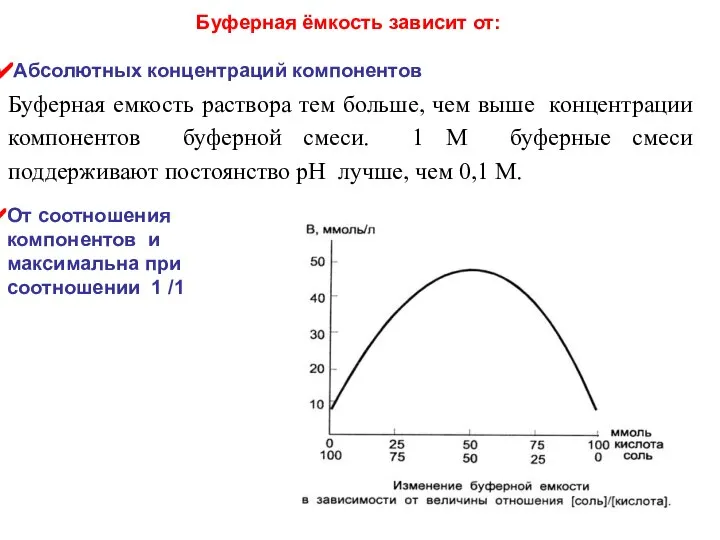
- 13. Буферная емкость по отношению к кислоте (Вкисл.) определяется концентрацией (количеством эквивалентов) компонента с основными свойствами; буферная
- 14. Буферная емкость раствора тем больше, чем выше концентрации компонентов буферной смеси. 1 М буферные смеси поддерживают
- 15. Буферные растворы можно приготовить двумя способами: Частичной нейтрализацией слабого электролита сильным электролитом: СН3СООН(избыток) + NaOH; NaOH(избыток)
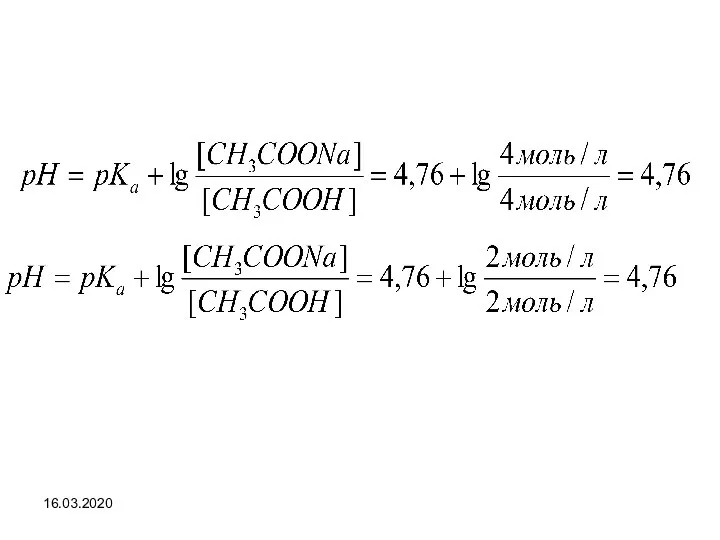
- 16. для кислотных буферных растворов: 16.03.2020 Расчет рН буферных растворов производят по уравнению Гендерсона-Гассельбаха
- 17. где – показатель константы диссоциации кислоты , [соли] и [кислоты] – молярные равновесные концентрации соли и
- 18. для основных буферных растворов: 16.03.2020
- 19. где – показатель константы диссоциации основания , [соли] и [осн] – молярные равновесные концентрации соли и
- 20. 16.03.2020 Буферные растворы, состоящие из двух солей, одна из которых (более кислая) выполняет роль сопряженной кислоты,
- 21. Уравнение нельзя применять : если концентрации компонентов отличаются более чем в 100 раз; если кислота (основание)
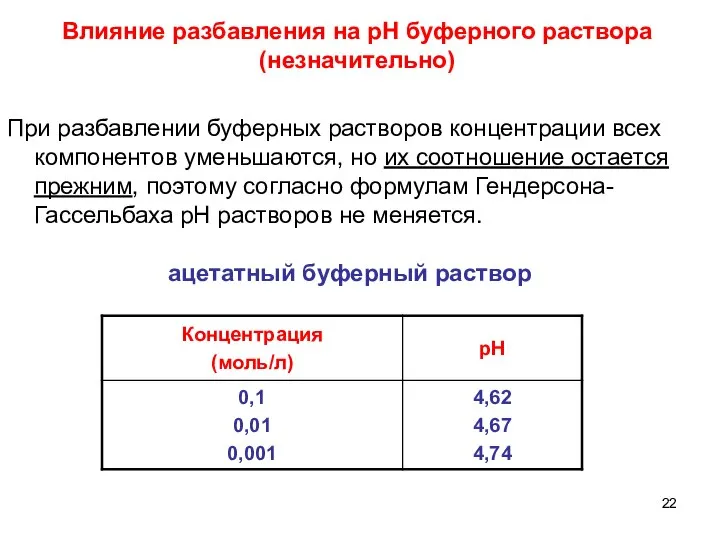
- 22. Влияние разбавления на рН буферного раствора (незначительно) ацетатный буферный раствор При разбавлении буферных растворов концентрации всех
- 23. 16.03.2020
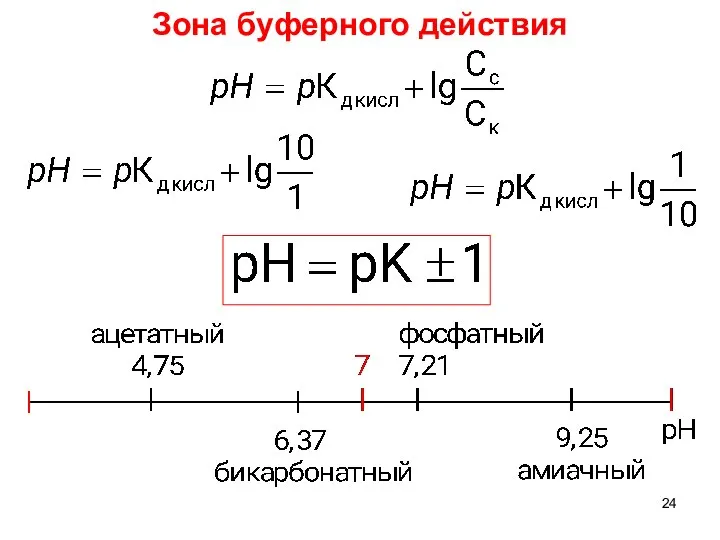
- 24. Зона буферного действия
- 25. Приготовление буферных растворов с заданным значением рН Задача. Приготовить раствор с рН = 7,36. Необходимо изменить
- 26. Рассчитаем, во сколько раз концентрация соли должна быть больше:
- 27. Буферные системы крови Из кишечника и тканей в кровь при обмене веществ постоянно поступают различные кислоты:
- 28. ЗАДАЧИ
- 29. Задача 1. Определить рН раствора, получившегося в результате смешения равных объемов растворов 0,12 М СН3СООН и
- 31. Скачать презентацию












![где – показатель константы диссоциации кислоты , [соли] и [кислоты] –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/630770/slide-16.jpg)

![где – показатель константы диссоциации основания , [соли] и [осн] –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/630770/slide-18.jpg)







 Калій. Знаходження в періодичній системі і основні характеристики
Калій. Знаходження в періодичній системі і основні характеристики Сплав золота и серебра - электрум
Сплав золота и серебра - электрум Неметаллы. Обобщение. Открытый урок
Неметаллы. Обобщение. Открытый урок Альдегиды. 10 класс
Альдегиды. 10 класс Химические свойства кислот в свете теории электролитической диссоциации
Химические свойства кислот в свете теории электролитической диссоциации Процессы коксования
Процессы коксования Основные понятия и законы химии. Эквивалент. Закон эквивалентов. Закон титрования
Основные понятия и законы химии. Эквивалент. Закон эквивалентов. Закон титрования Сейсморазведка
Сейсморазведка Классы неорганических веществ
Классы неорганических веществ Кислоты
Кислоты Анализ физико-химических свойств синтетических моющих средств (СМС) и их значение в жизни человека
Анализ физико-химических свойств синтетических моющих средств (СМС) и их значение в жизни человека Алканы. Пропан
Алканы. Пропан Фізичні властивості етилену й ацетилену. Отримання алкенів та алкінів. Хімічні властивості: відношення до розчинів кислот, л
Фізичні властивості етилену й ацетилену. Отримання алкенів та алкінів. Хімічні властивості: відношення до розчинів кислот, л Соединения галогенов
Соединения галогенов Соединения фосфора: оксид фосфора (V). Ортофосфорная кислота и ее соли
Соединения фосфора: оксид фосфора (V). Ортофосфорная кислота и ее соли Свойства ковалентной связи Гибридизация Поляризация Направленность Насыщаемость
Свойства ковалентной связи Гибридизация Поляризация Направленность Насыщаемость Презентация по Химии "Изучение жидких средств для мытья посуды" - скачать смотреть
Презентация по Химии "Изучение жидких средств для мытья посуды" - скачать смотреть  Степень окисления ОВР
Степень окисления ОВР Ионные кристаллы
Ионные кристаллы  Процессы формирования водородной плазмы в зоне резания
Процессы формирования водородной плазмы в зоне резания Каучуки. Гума Виконала учениця 11-Б класу Гуленко Катерина
Каучуки. Гума Виконала учениця 11-Б класу Гуленко Катерина  Строение соединений d-элементов
Строение соединений d-элементов Аттестационная работа. Сравнение механизма действия некоторых популярных антацидных лекарственных препаратов
Аттестационная работа. Сравнение механизма действия некоторых популярных антацидных лекарственных препаратов Нефть. Образование нефти
Нефть. Образование нефти Вторичная переработка нефти. Лекция 9
Вторичная переработка нефти. Лекция 9 Поняття про хімічні засоби захисту рослин (11 клас)
Поняття про хімічні засоби захисту рослин (11 клас) Катализаторы и катализ
Катализаторы и катализ Кислородосодержащие органические соединения
Кислородосодержащие органические соединения