Содержание
- 2. Открытие Периодического закона В основу своей классификации химических элементов Д.И. Менделеев положил два их основных и
- 3. Открытие Периодического закона При этом он обнаружил, что свойства элементов в некоторых пределах изменяются линейно (монотонно
- 4. Первый вариант Периодической таблицы На основании своих наблюдений 1 марта 1869 г. Д.И. Менделеев сформулировал периодический
- 5. Периодический закон Д.И. Менделеева Если написать ряды один под другим так, чтобы под литием находился натрий,
- 6. Периодический закон Д.И. Менделеева Современная трактовка Периодического закона: Свойства химических элементов и образуемых ими соединений находятся
- 7. Периодическая система состоит из ячеек, в которых есть символ химического элемента, его название, порядковый номер и
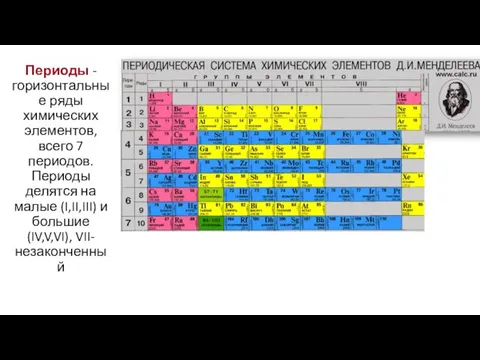
- 9. Периоды - горизонтальные ряды химических элементов, всего 7 периодов. Периоды делятся на малые (I,II,III) и большие
- 10. Каждый период (за исключением первого) начинается типичным металлом (Li, Nа, К, Rb, Cs, Fr) и заканчивается
- 11. Группы - вертикальные столбцы элементов с одинаковым числом электронов на внешнем электронном уровне, равным номеру группы.
- 12. Переходные элементы В ТАБЛИЦЕ ОБЫЧНО ВЫДЕЛЕНЫ ОТДЕЛЬНЫМ ЦВЕТОМ. ЗДЕСЬ окрашены в голубой цвет. Элементы главных подгрупп
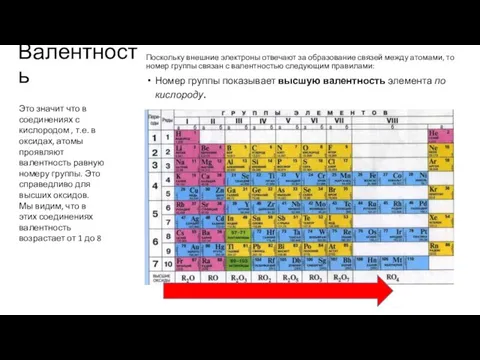
- 14. Валентность Поскольку внешние электроны отвечают за образование связей между атомами, то номер группы связан с валентностью
- 15. Валентность Элементы IV, V, VI и VII групп образуют летучие водородные соединения. Номер группы показывает валентность
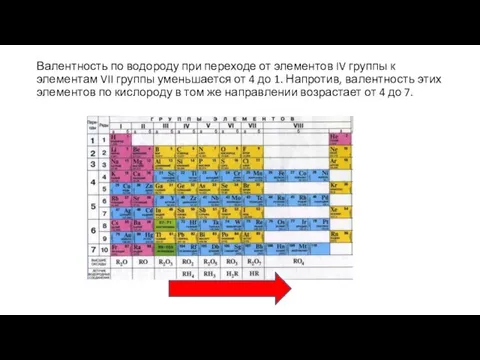
- 16. Валентность по водороду при переходе от элементов IV группы к элементам VII группы уменьшается от 4
- 17. Задание: Назовите в каком периоде и в какой группе, подгруппе находятся следующие химические элементы: Натрий, Медь,
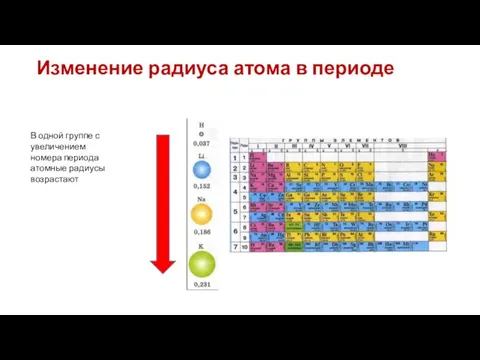
- 18. Изменение радиуса атома в периоде Радиус атома уменьшается с увеличением зарядов ядер атомов в периоде. В
- 19. Изменение радиуса атома в периоде В одной группе с увеличением номера периода атомные радиусы возрастают
- 20. Изменение радиусов атомов в таблице Д.И. Менделеева В правом верхнем углу располагаются элементы с наименьшим радиусом
- 21. Задание: Сравните радиусы следующих химических элементов: Литий, натрий, калий Бор, углерод, азот Кислород, Сера, селен Йод,
- 22. Электроотрицательность Электроотрицательность - это способность атома притягивать электронную плотность. Электроотрицательность в периоде увеличивается с возрастанием заряда
- 23. Электроотрицательность в группе увеличивается с уменьшением числа электронных слоев атома (снизу вверх). Самым электроотрицательным элементом является
- 25. Задание: Сравните ЭО следующих химических элементов: Натрий и кислород Углерод и водород Кислород и фтор Бор
- 26. Окислительно-восстановительные свойства Восстановительные свойства атомов - способность терять электроны при образовании химической связи. Окислительные свойства атомов
- 28. Скачать презентацию





















 Вода и ее свойства
Вода и ее свойства Исследование уравнения сжимаемости при высоких плотностях газов на примере аргона
Исследование уравнения сжимаемости при высоких плотностях газов на примере аргона Газовые законы. Расчетные задачи
Газовые законы. Расчетные задачи Нуклеиновые кислоты Презентация по химии
Нуклеиновые кислоты Презентация по химии Предмет химии. Вещества
Предмет химии. Вещества Основные понятия химии
Основные понятия химии Природный газ
Природный газ Химический элемент - америций
Химический элемент - америций Оксиди неметалічних елементів
Оксиди неметалічних елементів  Строение атома
Строение атома Горючие полезные ископаемые, топливно-энергетические ресурсы
Горючие полезные ископаемые, топливно-энергетические ресурсы Презентация по Химии "Теория Витализма" - скачать смотреть бесплатно
Презентация по Химии "Теория Витализма" - скачать смотреть бесплатно Зелёные камни
Зелёные камни Кислород. Общая характеристика и нахождение в природе. 8 класс
Кислород. Общая характеристика и нахождение в природе. 8 класс Аттестационная работа. Групповой урочный проект "Кислородсодержащие органические вещества"
Аттестационная работа. Групповой урочный проект "Кислородсодержащие органические вещества" Презентация по Химии "Вода. Знакомая незнакомка" - скачать смотреть
Презентация по Химии "Вода. Знакомая незнакомка" - скачать смотреть  Характеристика химического элемента на основании его положения в Периодической системе химических элементов Д.И. Менделеева
Характеристика химического элемента на основании его положения в Периодической системе химических элементов Д.И. Менделеева Оксиды. Классификация. Получение. Свойства
Оксиды. Классификация. Получение. Свойства Первоначальные химические понятия
Первоначальные химические понятия Властивості та застосування полімерів. Підготували учні 10 класу
Властивості та застосування полімерів. Підготували учні 10 класу  Ерітінділер түрлері. Идеал ертітінділер және реал ерітінділер. Ерітіндінің пайыздық концентрациясына eсептер
Ерітінділер түрлері. Идеал ертітінділер және реал ерітінділер. Ерітіндінің пайыздық концентрациясына eсептер Фармакология и токсикология этилового спирта
Фармакология и токсикология этилового спирта Презентація по хімії на тему:БУДІВЕЛЬНІ МАТЕРІАЛИ
Презентація по хімії на тему:БУДІВЕЛЬНІ МАТЕРІАЛИ  Химическая связь
Химическая связь Системный анализ и моделирование процессов. Горение паро-газо-воздушного облака
Системный анализ и моделирование процессов. Горение паро-газо-воздушного облака Формы парфюмерно-косметической продукции
Формы парфюмерно-косметической продукции Производство водорода
Производство водорода Підгрупа карбону
Підгрупа карбону