Содержание
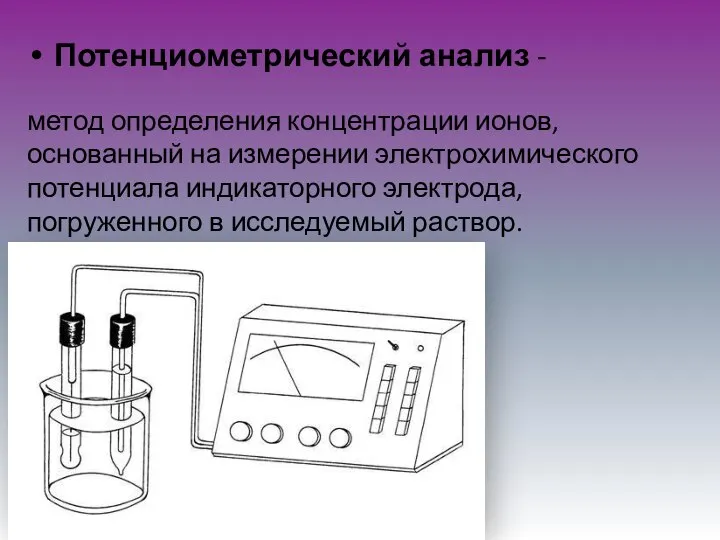
- 2. Потенциометрический анализ - метод определения концентрации ионов, основанный на измерении электрохимического потенциала индикаторного электрода, погруженного в
- 3. Е = Е0 + 0.058lgCМе +n /n Е = Е0 + 0.058lg([Ok]/[B])/n
- 4. Первый вариант Это измерение потенциала электрода, погруженного в исследуемый раствор, и вычисление концентрации определяемых ионов по
- 5. Второй вариант Это метод потенциометрического титрования. Сущность метода заключается в том,что в исследуемый раствор погружают индикаторный
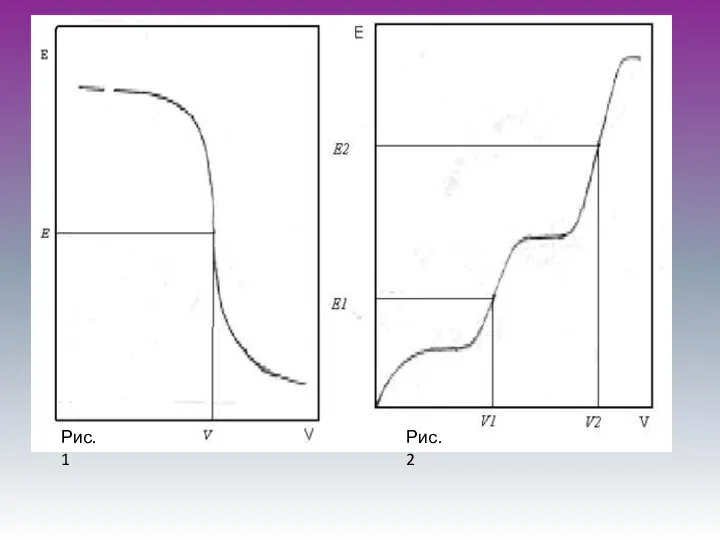
- 6. Рис.1 Рис.2
- 7. Потенциометрическое титрование Можно титровать окрашенные растворы, когда цветные индикаторы не применимы. Легко можно определить, не прибегая
- 8. Классификация потенциометрических методов анализа 1. Методы осаждения и комплексообразования. Примеры: титрование галогенидов нитратом серебра; титрование катионов
- 9. Индикаторными электродами называют электроды, применяемые для определения активности ионов в растворе. Индикаторный электрод соединяют с другим
- 10. Требования Обратимость, т.е. потенциал электрода должен изменяться с изменением активности (концентрации) ионов в растворе в соответствии
- 12. Скачать презентацию
![Е = Е0 + 0.058lgCМе +n /n Е = Е0 + 0.058lg([Ok]/[B])/n](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1399775/slide-2.jpg)






 Этанол (этиловый спирт)
Этанол (этиловый спирт) Кометика Liv Delano - презентация_
Кометика Liv Delano - презентация_ Хемосинтез. Автотрофное питание
Хемосинтез. Автотрофное питание Сложные эфиры в жизни человека
Сложные эфиры в жизни человека Вода. Физические и химические свойства воды
Вода. Физические и химические свойства воды Углеводы. 10 класс
Углеводы. 10 класс Презентация Свойства черных и цветных металлов
Презентация Свойства черных и цветных металлов  Количество вещества. Молярная масса. Задачи
Количество вещества. Молярная масса. Задачи Растворы. Гетерогенные равновесия растворов с осадком
Растворы. Гетерогенные равновесия растворов с осадком Тема урока "Основания" - презентация_
Тема урока "Основания" - презентация_ “ КОРОЗІЯ МЕТАЛІВ. ЗАХИСТ ВІД КОРОЗІЇ ” Підготував: Учень 10-А класу ЗОШ №25 м. Луцька Матвійчук Роман
“ КОРОЗІЯ МЕТАЛІВ. ЗАХИСТ ВІД КОРОЗІЇ ” Підготував: Учень 10-А класу ЗОШ №25 м. Луцька Матвійчук Роман  Хімічні добавки. Е-числа
Хімічні добавки. Е-числа Оксиды
Оксиды Вуглеводи, як компонент їжі. Їхня роль в організмі людини
Вуглеводи, як компонент їжі. Їхня роль в організмі людини Тема: Липиды. Лекция № 2 для студентов 2 курса
Тема: Липиды. Лекция № 2 для студентов 2 курса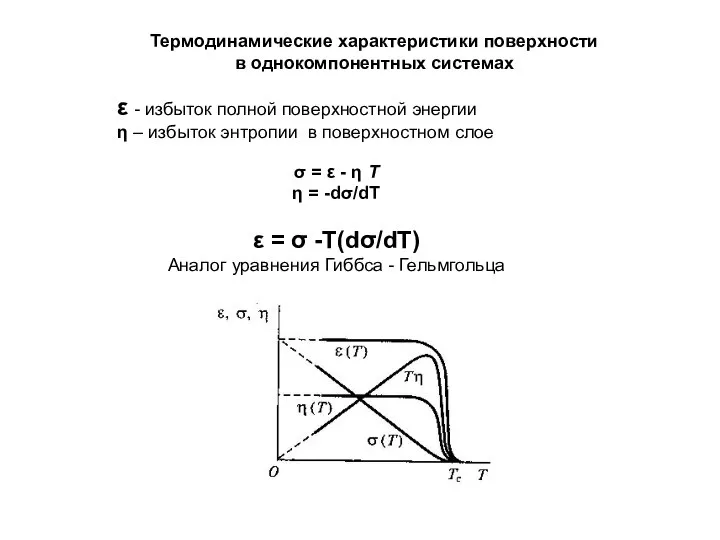 Презентация по Химии "Термодинамические характеристики поверхности" - скачать смотреть
Презентация по Химии "Термодинамические характеристики поверхности" - скачать смотреть  Строение электронных оболочек атомов
Строение электронных оболочек атомов Тотықтырғыштар
Тотықтырғыштар Производная в химии
Производная в химии Классификация кислот
Классификация кислот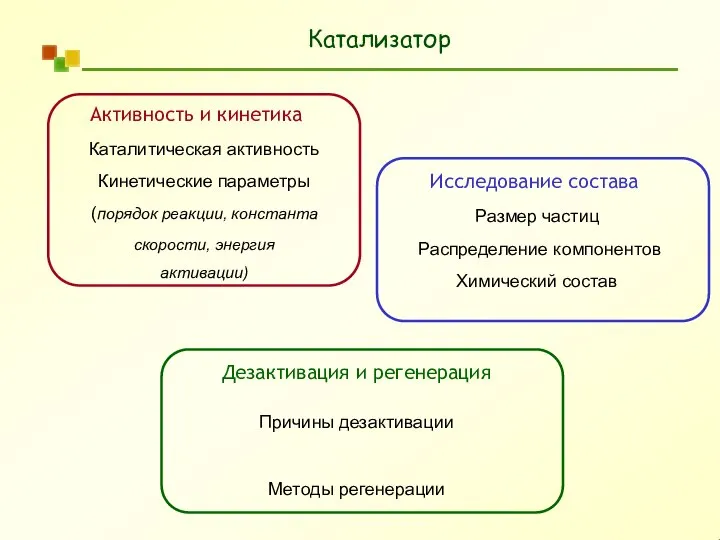 Катализатор. Анализ кинетических данных
Катализатор. Анализ кинетических данных Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений Биотрансформация чужеродных соединений в организме. (Лекция 5)
Биотрансформация чужеродных соединений в организме. (Лекция 5) Презентация по Химии "Ферменты. Роль и функции" - скачать смотреть
Презентация по Химии "Ферменты. Роль и функции" - скачать смотреть  Краткая история химии
Краткая история химии Презентация по Химии "Дмитро Менделєєв" - скачать смотреть бесплатно
Презентация по Химии "Дмитро Менделєєв" - скачать смотреть бесплатно Методы разделения и концентрирования
Методы разделения и концентрирования Л3.12 Композицитонные материалы
Л3.12 Композицитонные материалы