Содержание
- 2. Гетерогенные равновесия растворов с осадком [Ca2+], [CO32−] - равновесные концентрации ионов в растворе; [CaCO3] - концентрация
- 4. Связь между произведением растворимости и растворимостью осадка Обозначим молярную растворимость вещества через “S” . Тогда раствор
- 6. В присутствии одноименных ионов равновесие смещается в сторону образования осадка (эффект одноименного иона). AgNO3 Ag +
- 7. В присутствии сильных электролитов, не содержащих общих ионов, подвижность ионов в растворе уменьшается и равновесие смещается
- 9. Образование осадков - реакции обмена
- 10. Условие образования осадка: произведение концентраций ионов в растворе должно быть больше, чем величина произведения растворимости данного
- 17. ГИДРОЛИЗ СОЛЕЙ обменная реакция ионов соли с молекулами воды, приводящей к образованию молекул и ионов новых
- 19. Среда нейтральная, рН=7
- 24. Соль гидролизуется полностью и необратимо если она образована: - легколетучей или труднорастворимой кислотой (константа диссоциации не
- 25. Глубина гидролиза Показателем глубины протекания гидролиза является степень гидролиза. Глубина гидролиза зависит от соотношений значений константы
- 30. Гидролиз соли можно усилить также нагревая или разбавляя ее раствор. Гидролиз усиливается при нагревании. Гидролиз усиливается
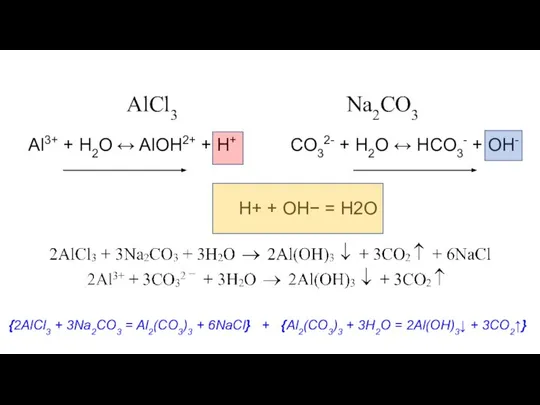
- 32. Al3+ + H2O ↔ AlOH2+ + H+ AlCl3 Na2CO3 CO32- + H2O ↔ HCO3- + OH-
- 33. В реакциях взаимного гидролиза в осадок выпадает наименее растворимый из возможных продуктов гидролиза.
- 35. Скачать презентацию
![Гетерогенные равновесия растворов с осадком [Ca2+], [CO32−] - равновесные концентрации ионов](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1376172/slide-1.jpg)






























 Поверхностное натяжение
Поверхностное натяжение Установка гидрокрекинга
Установка гидрокрекинга Основные классы неорганических веществ
Основные классы неорганических веществ Карбоновые кислоты
Карбоновые кислоты Липидтердің алмасуы
Липидтердің алмасуы Биологически значимые элементы
Биологически значимые элементы Водородная, ионная, донорно-акцепторная химические связи
Водородная, ионная, донорно-акцепторная химические связи Перечень практических навыков по общей химии для экзамена
Перечень практических навыков по общей химии для экзамена Простые вещества – металлы
Простые вещества – металлы Кроссворд по теме: Алканы
Кроссворд по теме: Алканы Пластмассы в автомобилестроении
Пластмассы в автомобилестроении Презентація на тему: Алюміній і сполуки алюмінію у побуті людини
Презентація на тему: Алюміній і сполуки алюмінію у побуті людини  Распределение Бозе-Эйнштейна. Конденсация Бозе-газа. Температура конденсации. Число частиц в конденсате
Распределение Бозе-Эйнштейна. Конденсация Бозе-газа. Температура конденсации. Число частиц в конденсате Массовая и объемная доля компонентов смеси
Массовая и объемная доля компонентов смеси Методы осаждения. Аналитическая химия
Методы осаждения. Аналитическая химия Применение химических реакций в быту
Применение химических реакций в быту Феромагнетики До феромагнетики (ferrum - залізо) належать речовини, магнітна сприйнятливість яких позитивна і досягає значень. Н
Феромагнетики До феромагнетики (ferrum - залізо) належать речовини, магнітна сприйнятливість яких позитивна і досягає значень. Н Электролиз. Урок химии 11 класс
Электролиз. Урок химии 11 класс Алканы. Получение и применение алканов
Алканы. Получение и применение алканов Гетерофункциональные органические соединения. Таутомерия. Стереоизомерия
Гетерофункциональные органические соединения. Таутомерия. Стереоизомерия Основы МКТ
Основы МКТ Энергетические резервы организма для работы в разных условиях
Энергетические резервы организма для работы в разных условиях Солюбилизация в прямых мицеллах ПАВ
Солюбилизация в прямых мицеллах ПАВ ГОД ЭКОЛОГИИ-2013
ГОД ЭКОЛОГИИ-2013  Відкриття та походження хімічних елементів
Відкриття та походження хімічних елементів Минералы и горные породы
Минералы и горные породы Каучуки. Природний каучук, гума, синтетичний каучук
Каучуки. Природний каучук, гума, синтетичний каучук Химические свойства водорода H2
Химические свойства водорода H2