Содержание
- 2. Гибридное состояние атома углерода в молекуле в большой степени определяет химическое поведение соединения. Алканы, образованные sp3-гибридными
- 3. Ароматические соединения (арены) – циклические органические соединения, которые имеют в своём составе ароматическую систему. Основными отличительными
- 4. Открытие бензола Впервые бензолсодержащие смеси, образующиеся в результате перегонки каменноугольной смолы, описал немецкий химик Иоганн Глаубер
- 5. Открытие бензола Изучением бензола серьёзно занялся немецкий химик Фридрих Август Кекуле, которому в 1865 году и
- 6. Строение бензола Формула Кекуле Кекуле предложил считать, что кратные связи в молекуле бензола быстро перемещаются (осциллируют).
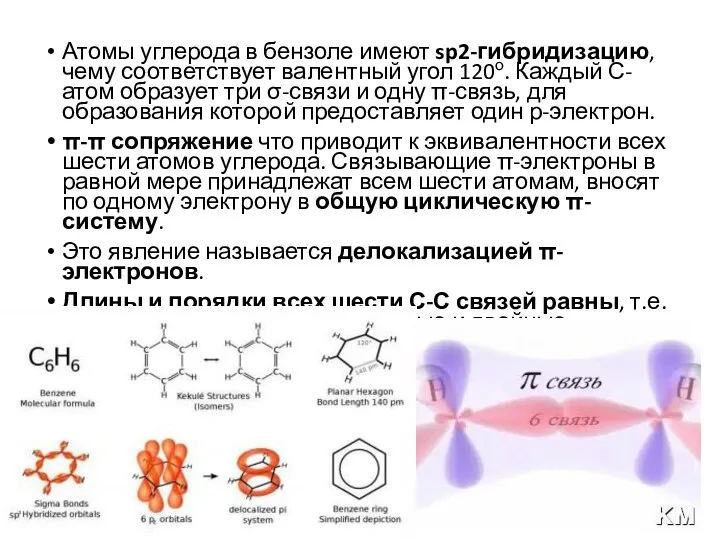
- 7. Атомы углерода в бензоле имеют sp2-гибридизацию, чему соответствует валентный угол 120о. Каждый С-атом образует три σ-связи
- 8. Ароматические соединения Плоское кольцо Единое электронное облако Правило Хюккеля – «Единое электронное облако в ароматическом соединении
- 9. Изомерия и номенклатура ароматических углеводородов бензол толуол Этил-бензол Изопропил-бензол кумол 1,2-диметилбензол 1,3-диметилбензол 1,4-диметилбензол орто мета паро
- 10. Арены подразделяются на моноциклические и полициклические, последние в свою очередь делятся на изолированные и конденсированные (аннелированные)
- 11. Получение ароматических улеводородов 1) Из природных объектов. Перегонкой каменного угля – фракции каменноугольной смолы
- 12. 2) Из ацетилена. Синтез Зелинского-Казанского 3) Дегидрирование циклических алканов 4) Ароматизация предельных углеводородов
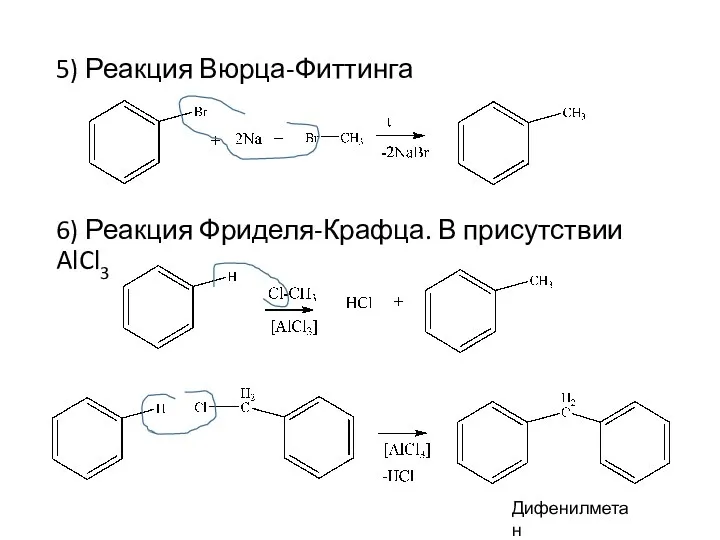
- 13. 5) Реакция Вюрца-Фиттинга 6) Реакция Фриделя-Крафца. В присутствии AlCl3 Дифенилметан
- 14. 7) С использованием алкенов 8) Нагревание ароматических кислот в присутствии оксидов металлов 9)Перегонка солей карбоновых кислот
- 15. Физические свойства Жидкости или твердые вещества со специфическим запахом Плотность аренов выше, чем циклоалканов Нерастворимы в
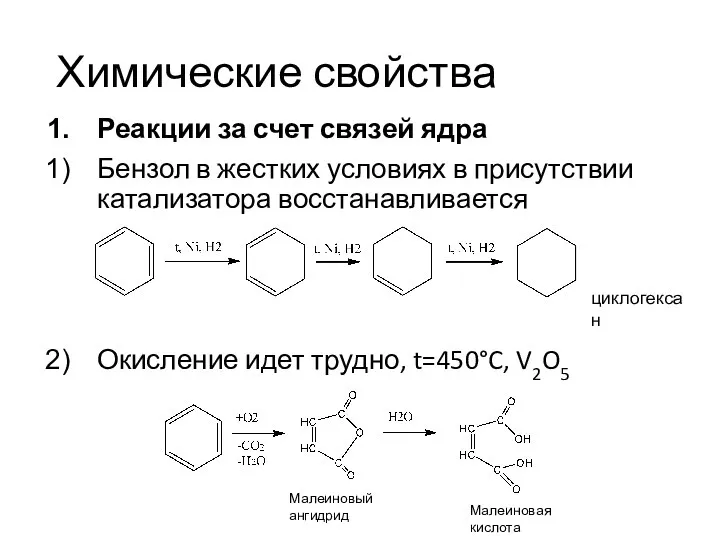
- 16. Химические свойства Реакции за счет связей ядра Бензол в жестких условиях в присутствии катализатора восстанавливается Окисление
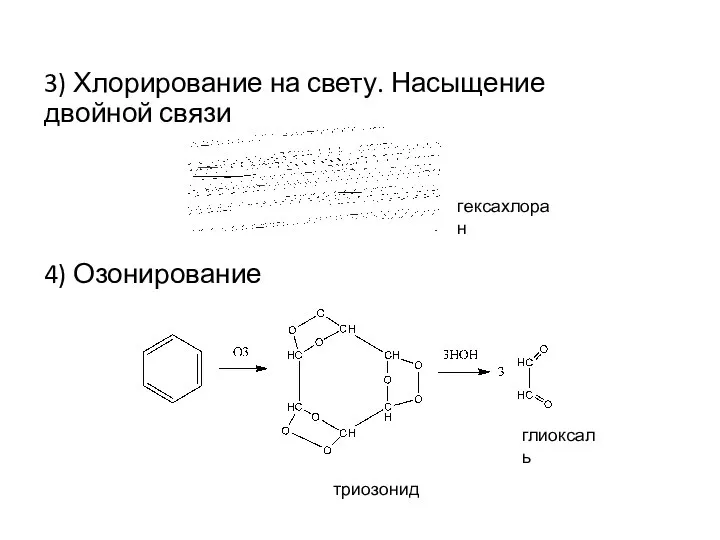
- 17. 3) Хлорирование на свету. Насыщение двойной связи 4) Озонирование гексахлоран триозонид глиоксаль
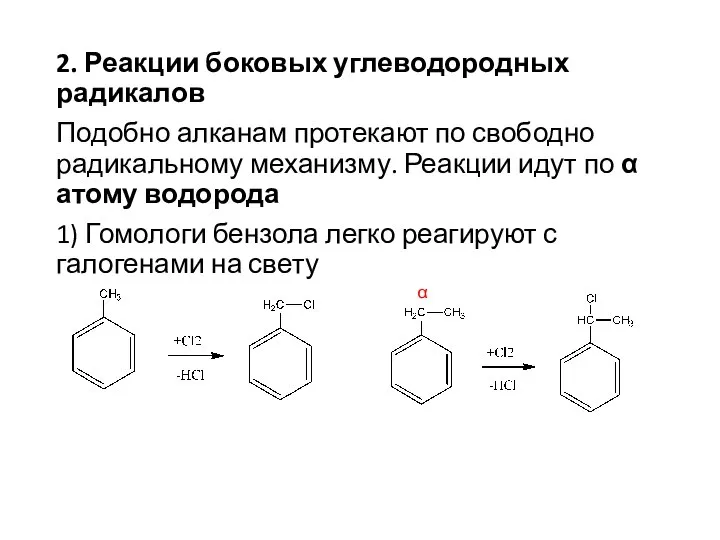
- 18. 2. Реакции боковых углеводородных радикалов Подобно алканам протекают по свободно радикальному механизму. Реакции идут по α
- 19. 2) Окисление. Действие перманганата калия в воде или бихромата калия в кислой среде окисляет алкильный заместитель.
- 20. 3. Реакции замещения водорода у бензольного кольца (электрофильное замещение, SE) Электрофилом называют частицу, имеющую вакантную орбиталь,
- 21. Гомологи бензола вступают в реакции электрофильного замещения легче, чем бензол, из-за электронодонорного влияния алкильных заместителей. В
- 22. 2) Нитрование. Бензол и его гомологи превращаются в нитросоединения действием нитрующей смеси, которая состоит из концентрированных
- 23. 3) Сульфирование Реакция сульфирования аренов протекает в олеуме при действии триоксида серы, или в серной кислоте
- 24. 4) Алкилирование по Фриделю-Крафтсу Одним из способов получения гомологов бензола является реакция алкилирования. В реакцию вводят
- 25. 5) Ацилирование по Фриделю-Крафтсу Сходной с реакцией алкилирования является реакция ацилирования ароматических соединений. В качестве реагентов
- 26. Применение ароматических углеводородов
- 28. Скачать презентацию




















 Ферменты и гормоны Урок химии в 10 (11) классе Автор: учитель химии Ким Н.В. МОУ СОШ №6 г. Нягани ХМАО-Югры Тюменской области
Ферменты и гормоны Урок химии в 10 (11) классе Автор: учитель химии Ким Н.В. МОУ СОШ №6 г. Нягани ХМАО-Югры Тюменской области Квалификация химических реактивов, принятая в РФ
Квалификация химических реактивов, принятая в РФ Стратегії дослідження хімічних сполук з використанням сучасних фізичних методів (частина перша)
Стратегії дослідження хімічних сполук з використанням сучасних фізичних методів (частина перша) Получение, собирание и распознавание водорода
Получение, собирание и распознавание водорода Розчини
Розчини Зелёные камни
Зелёные камни Гормоны. Виды и классификация гормонов
Гормоны. Виды и классификация гормонов Анодные реакции коррозионного процесса
Анодные реакции коррозионного процесса Электрохимические процессы
Электрохимические процессы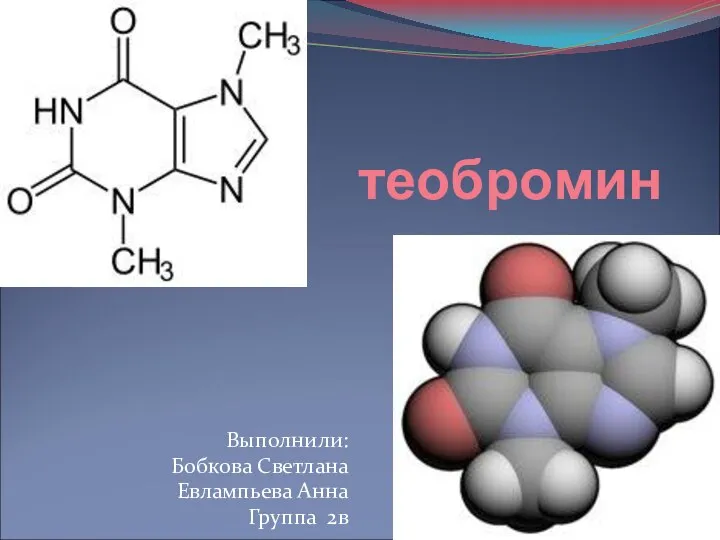 Теобромин
Теобромин Карбо́новые кисло́ты
Карбо́новые кисло́ты Строение атома
Строение атома Смесители. Пропеллерная мешалка
Смесители. Пропеллерная мешалка Презентация по Химии "Применение электролиза" - скачать смотреть
Презентация по Химии "Применение электролиза" - скачать смотреть  Перевариваемые полисахариды злаковых, бобовых, овощей, ягод и фруктов. Крахмал (амилоза, амилопектин), фруктаны (инулин)
Перевариваемые полисахариды злаковых, бобовых, овощей, ягод и фруктов. Крахмал (амилоза, амилопектин), фруктаны (инулин) Р-элементы IV группы: C, Si, Ge, Sn, Pb
Р-элементы IV группы: C, Si, Ge, Sn, Pb Задача №9. Глицерин. Команда Карбораны
Задача №9. Глицерин. Команда Карбораны ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Элективный специальный курс углублённого изучения темы для учащихся 11 классов естеств
ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Элективный специальный курс углублённого изучения темы для учащихся 11 классов естеств Презентация по Химии "Насичені одноатомні спирти" - скачать смотреть бесплатно
Презентация по Химии "Насичені одноатомні спирти" - скачать смотреть бесплатно К 180-летию со дня рождения Д.И. Менделеева
К 180-летию со дня рождения Д.И. Менделеева Пегматитовые месторождения
Пегматитовые месторождения Chemical bonding and Molecular Structure
Chemical bonding and Molecular Structure Обобщающий урок –игра Звездный час по теме Подгруппа кислорода
Обобщающий урок –игра Звездный час по теме Подгруппа кислорода Распределение примесей в процессе выращивания мультикристаллического кремния
Распределение примесей в процессе выращивания мультикристаллического кремния Комплексные соединения
Комплексные соединения Типы химических реакций на примере свойств воды
Типы химических реакций на примере свойств воды  Алкилирование изобутана олефинами
Алкилирование изобутана олефинами Гигиенические нормативы. Химические факторы окружающей среды
Гигиенические нормативы. Химические факторы окружающей среды