Содержание
- 2. Металлы IA группы (щелочные) Генетическая связь для Na и его соединений: Na + …. -? NaCl
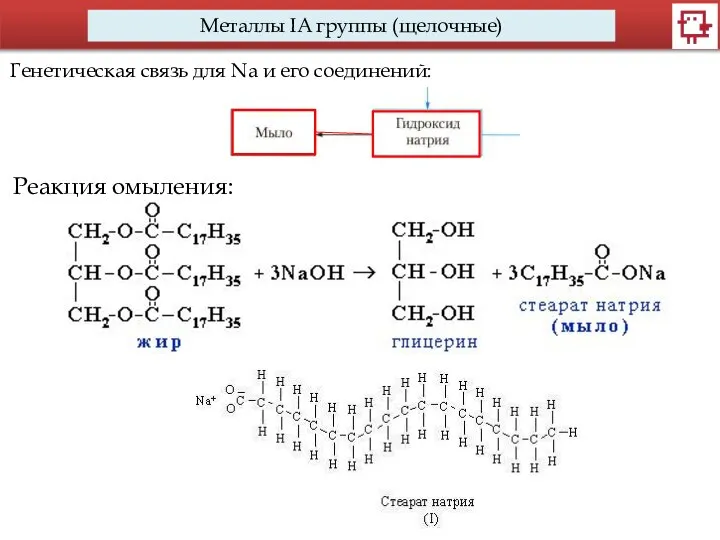
- 3. Металлы IA группы (щелочные) Генетическая связь для Na и его соединений: Реакция омыления:
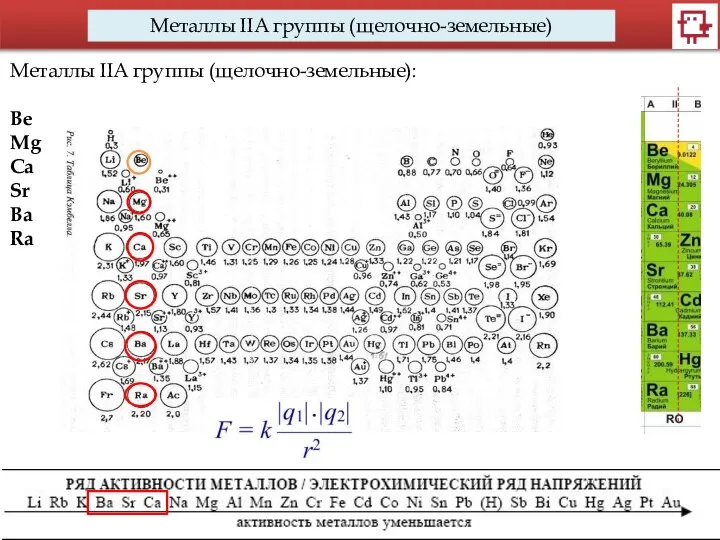
- 4. Металлы IIA группы (щелочно-земельные) Металлы IIA группы (щелочно-земельные): Be Mg Ca Sr Ba Ra
- 5. Металлы IIA группы (щелочно-земельные) Металлы IIA группы (щелочно-земельные):
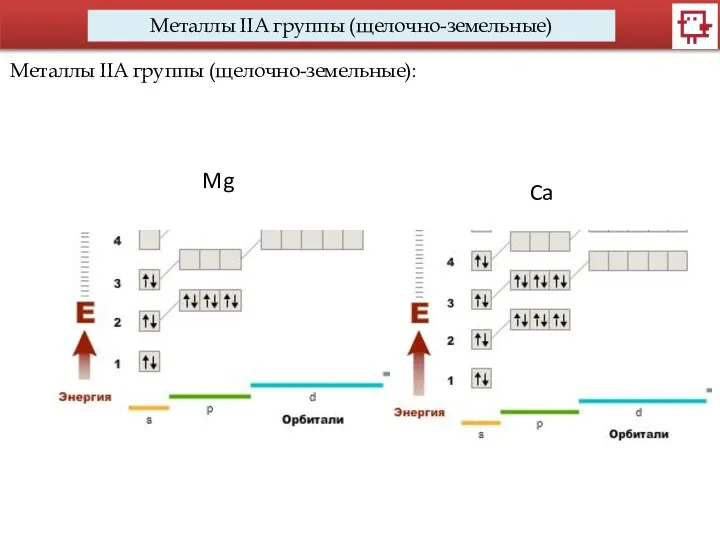
- 6. Металлы IIA группы (щелочно-земельные) Металлы IIA группы (щелочно-земельные): Mg Ca
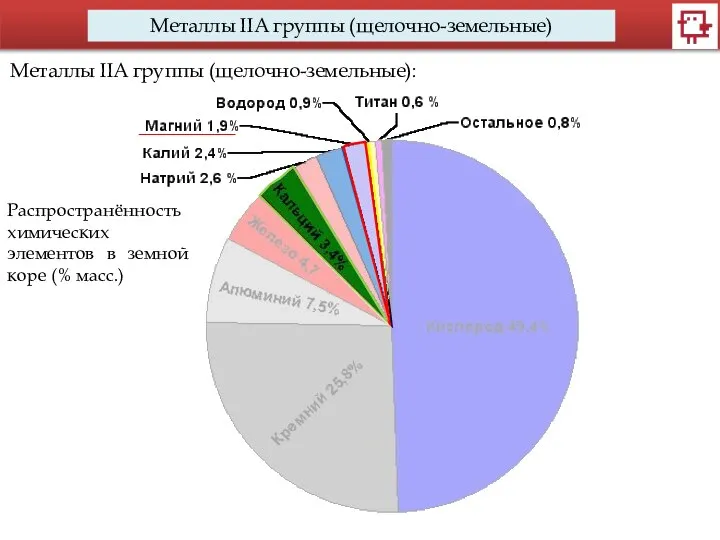
- 7. Металлы IIA группы (щелочно-земельные) Металлы IIA группы (щелочно-земельные): Распространённость химических элементов в земной коре (% масс.)
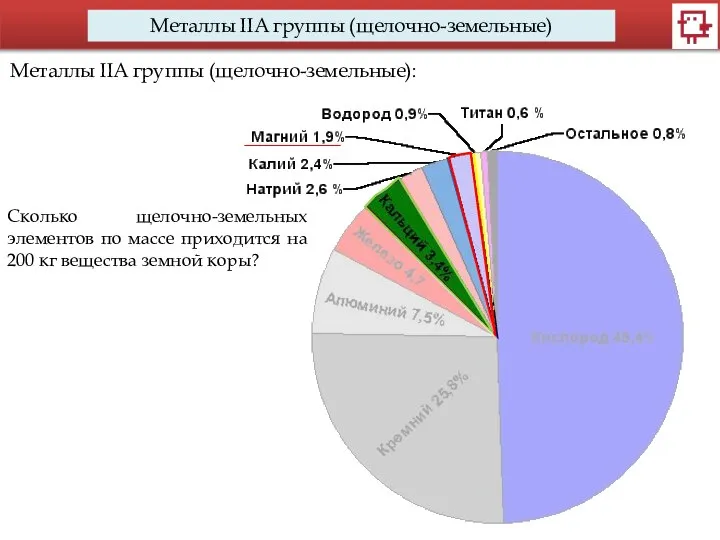
- 8. Металлы IIA группы (щелочно-земельные) Металлы IIA группы (щелочно-земельные): Сколько щелочно-земельных элементов по массе приходится на 200
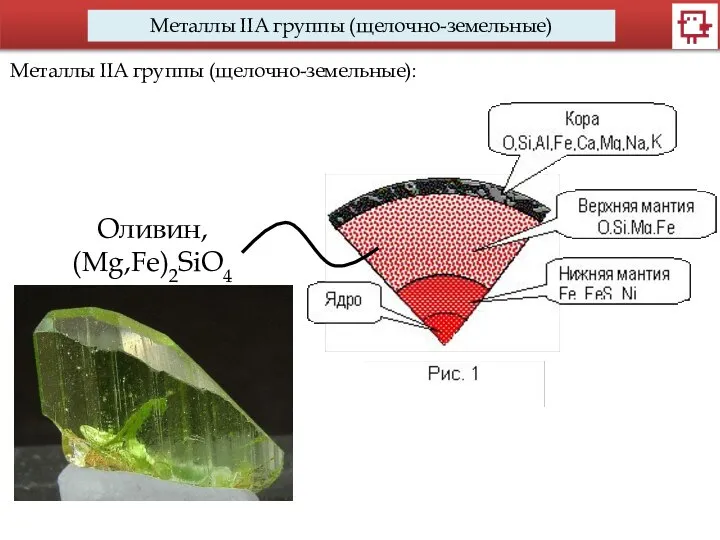
- 9. Металлы IIA группы (щелочно-земельные) Металлы IIA группы (щелочно-земельные): Оливин, (Mg,Fe)2SiO4
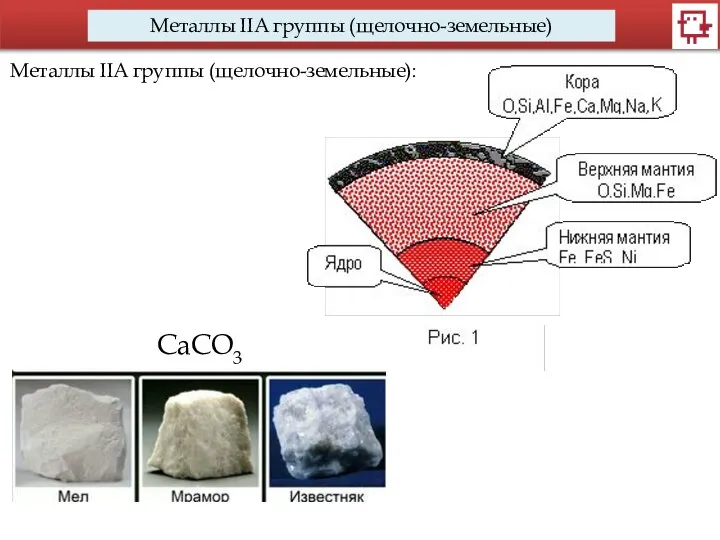
- 10. Металлы IIA группы (щелочно-земельные) Металлы IIA группы (щелочно-земельные): CaCO3
- 11. Металлы IIA группы (щелочно-земельные) Кальций (Са) Кальций химически активный элемент, поэтому встречается только в соединениях. Соединения
- 12. Металлы IIA группы (щелочно-земельные) Кальций (Са) Гипс типичный осадочный минерал. Используется как удобрение; в целлюлозно-бумажной промышленности;
- 13. Металлы IIA группы (щелочно-земельные) Кальций (Са) Апатит – минерал концентратор фтора и кальция, имеющий большую твёрдость.
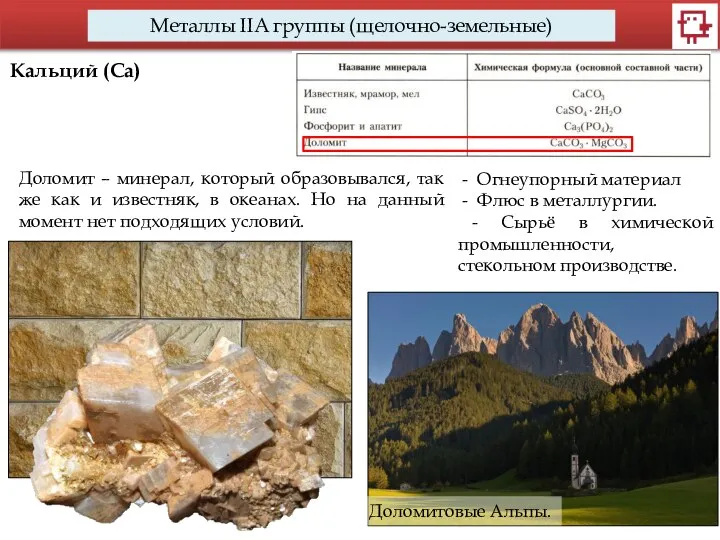
- 14. Металлы IIA группы (щелочно-земельные) Кальций (Са) Доломит – минерал, который образовывался, так же как и известняк,
- 15. Металлы IIA группы (щелочно-земельные) Кальций (Са) Получают кальций, в основном, электролизом CaCl2, реже из CaF2. Или
- 16. Металлы IIA группы (щелочно-земельные) Кальций (Са) Физические свойства. Имеет серебристо-белый цвет, легок (р = 1.55 г\см3).
- 17. Металлы IIA группы (щелочно-земельные) Кальций (Са) Химические свойства.
- 18. Металлы IIA группы (щелочно-земельные) Кальций (Са) Напишите уравнение электролиза расплава хлорида кальция. Какой продукт выделяется на
- 20. Скачать презентацию








 Презентация Химическая связь
Презентация Химическая связь 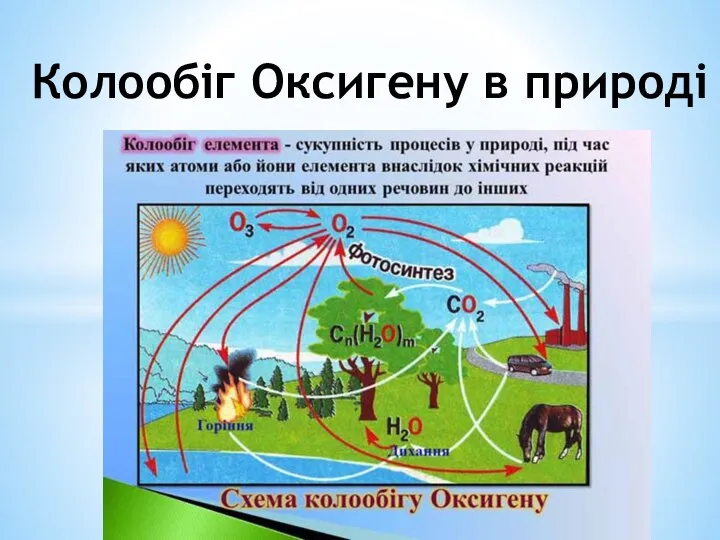 Колообіг Оксигену в природі
Колообіг Оксигену в природі  Химия и физика полимеров. Курс лекций
Химия и физика полимеров. Курс лекций Металлические элементы группы IA. ЛИТИЙ. Работу выполнила: Ученица 11 класса Иванова Ксения
Металлические элементы группы IA. ЛИТИЙ. Работу выполнила: Ученица 11 класса Иванова Ксения Коллекция учебных динамических слайдов по химии. (8 класс)
Коллекция учебных динамических слайдов по химии. (8 класс) Алканы: гомологический ряд, изомерия и номенклатура алканов. МБОУ СОШ №99 г.о. Самара Предмет: Химия Класс: 10 Учебник: О.С. Габр
Алканы: гомологический ряд, изомерия и номенклатура алканов. МБОУ СОШ №99 г.о. Самара Предмет: Химия Класс: 10 Учебник: О.С. Габр Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Этиленгликоль. Физические свойства
Этиленгликоль. Физические свойства Алкадиены (диены)
Алкадиены (диены) Строение металлов
Строение металлов Функциональные производные с простой связью C-“Э”. Часть 4 …окси-производные
Функциональные производные с простой связью C-“Э”. Часть 4 …окси-производные Презентация по Химии "КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ" - скачать смотреть бесплатно
Презентация по Химии "КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ" - скачать смотреть бесплатно Властивості газів
Властивості газів Автоматизация производства жидкой углекислоты
Автоматизация производства жидкой углекислоты Electrochemical processes
Electrochemical processes Горные породы Крыма
Горные породы Крыма Азот Составил: учитель химии МОУ «Средняя общеобразовательная школа №92 с углубленным изучением отдельных предметов» Бар
Азот Составил: учитель химии МОУ «Средняя общеобразовательная школа №92 с углубленным изучением отдельных предметов» Бар Металлическая связь
Металлическая связь Алюминий
Алюминий Использование ЭОР при подготовке к ЕГЭ и ГИА
Использование ЭОР при подготовке к ЕГЭ и ГИА Гидролиз. Лекция 03-2
Гидролиз. Лекция 03-2 Несовместимые сочетания лекарственных веществ. Способы преодоления несовместимости
Несовместимые сочетания лекарственных веществ. Способы преодоления несовместимости Полимеры
Полимеры Полимеры. Каучуки. Резина
Полимеры. Каучуки. Резина Счастливы вместе с химией
Счастливы вместе с химией Вода. Физические и химические свойства
Вода. Физические и химические свойства ПЕРВОНАЧАЛЬНЫЕ ХИМИЧЕСКИЕ ПОНЯТИЯ ОБОБЩАЮЩИЙ УРОК
ПЕРВОНАЧАЛЬНЫЕ ХИМИЧЕСКИЕ ПОНЯТИЯ ОБОБЩАЮЩИЙ УРОК  Презентация по Химии "Значение химии" - скачать смотреть бесплатно
Презентация по Химии "Значение химии" - скачать смотреть бесплатно