Презентация по химии Общие закономерности реакционной способности органических соединений как химическая основа их биологическ
Содержание
- 2. Радикальное замещение у насыщенного атома углерода.
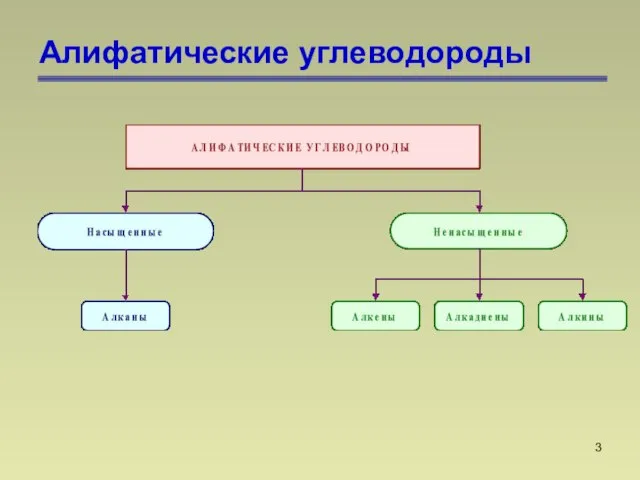
- 3. Алифатические углеводороды
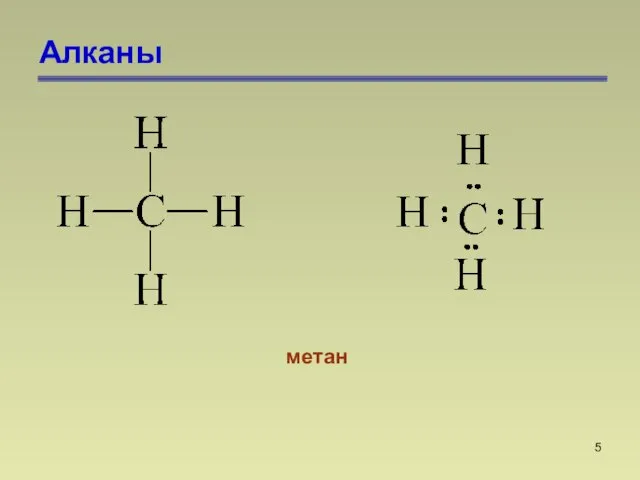
- 4. Алканы Алканами называются насыщенные углеводороды, молекулы которых состоят из атомов углерода и водорода, связанных между собой
- 5. Алканы метан
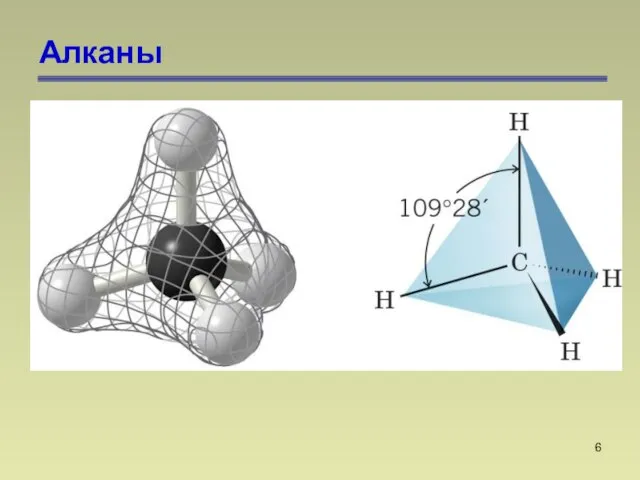
- 6. Алканы
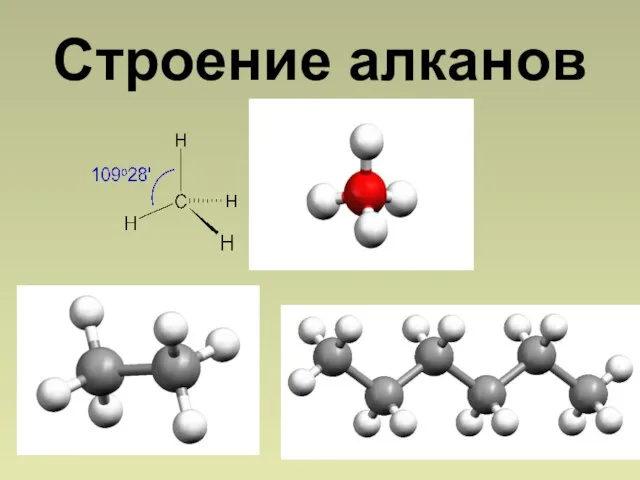
- 7. Строение алканов
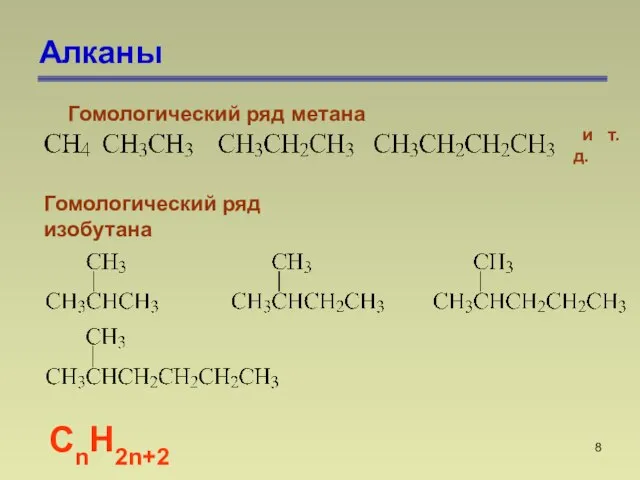
- 8. Алканы СnН2n+2
- 9. Алканы. Номенклатура. Названия нормальных алканов по заместительной номенклатуре
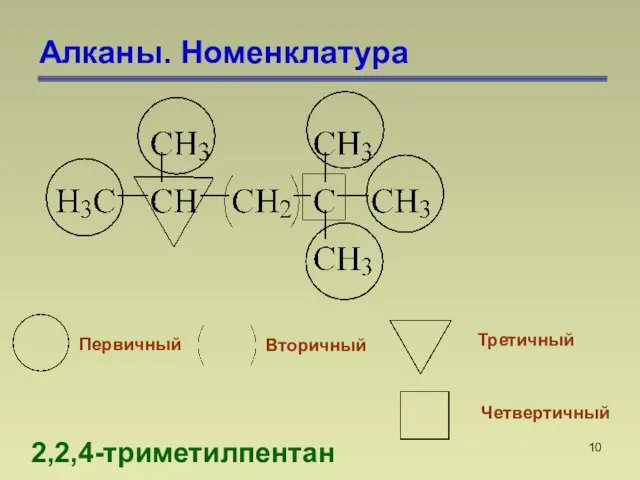
- 10. Алканы. Номенклатура 2,2,4-триметилпентан Первичный Вторичный Третичный Четвертичный
- 11. Алканы. Номенклатура
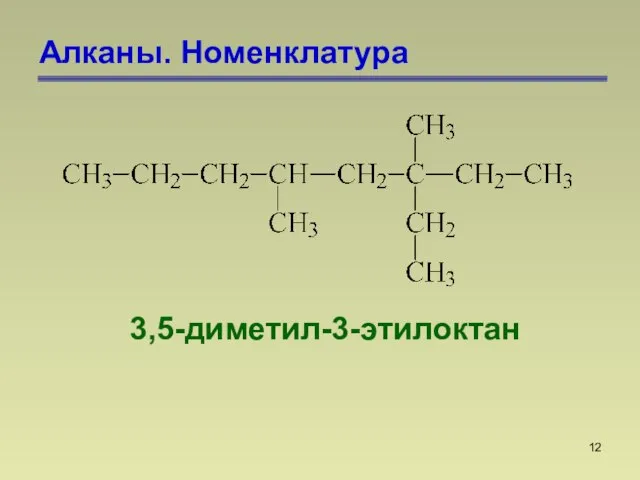
- 12. Алканы. Номенклатура 3,5-диметил-3-этилоктан
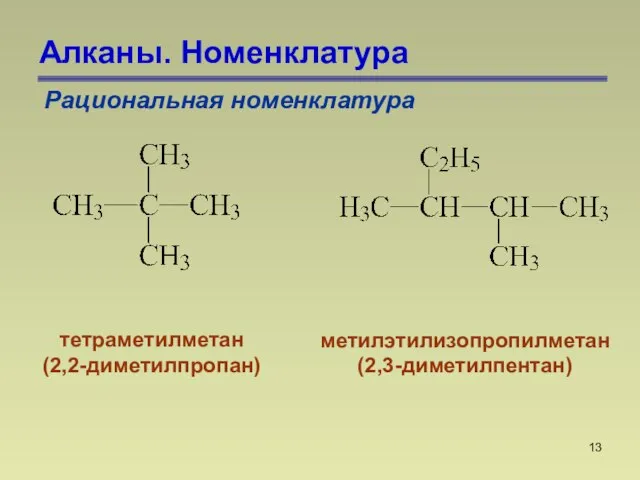
- 13. Алканы. Номенклатура Рациональная номенклатура тетраметилметан (2,2-диметилпропан) метилэтилизопропилметан (2,3-диметилпентан)
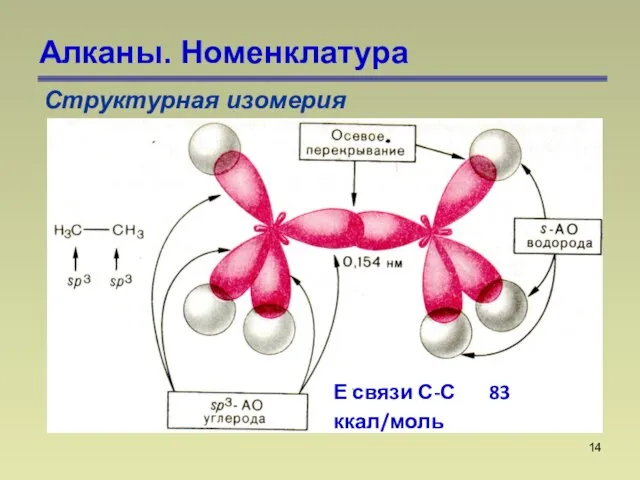
- 14. Алканы. Номенклатура Структурная изомерия Е связи С-С 83 ккал/моль
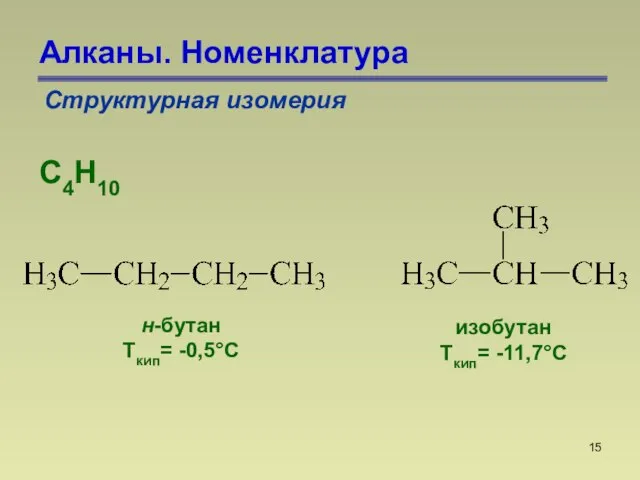
- 15. Алканы. Номенклатура Структурная изомерия С4Н10 н-бутан Ткип= -0,5С изобутан Ткип= -11,7С
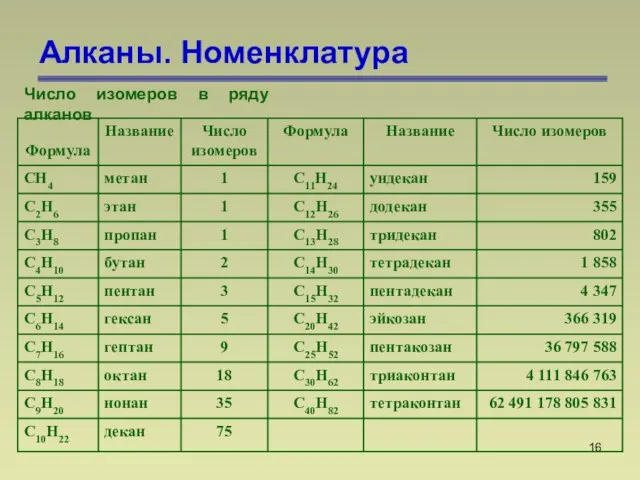
- 16. Алканы. Номенклатура Число изомеров в ряду алканов
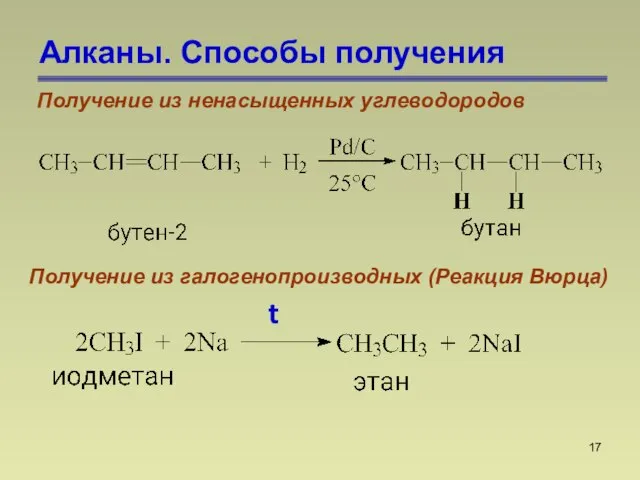
- 17. Алканы. Способы получения Получение из ненасыщенных углеводородов Получение из галогенопроизводных (Реакция Вюрца) t
- 18. ВЮРЦ (Wurtz), Шарль Адольф 26 ноября 1817 г. – 12 мая 1884 г. Французский химик-органик и
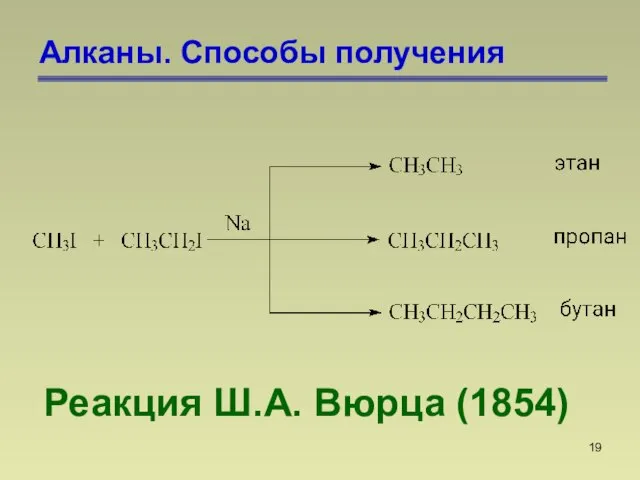
- 19. Алканы. Способы получения Реакция Ш.А. Вюрца (1854)
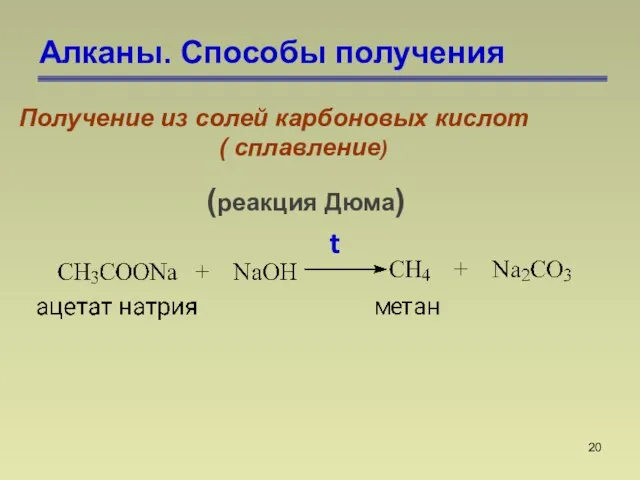
- 20. Алканы. Способы получения Получение из солей карбоновых кислот ( сплавление) (реакция Дюма) t
- 21. Электролиз солей щелочных металлов и карбоновых кислот (реакция Кольбе) 1849 г
- 22. Адольф Вильгельм Герман Кольбе Adolph Wilhelm Hermann Kolbe немецкий химик-органик. 27 сентября 1818 г. – 25
- 23. Реакция электролиза по Кольбе: .
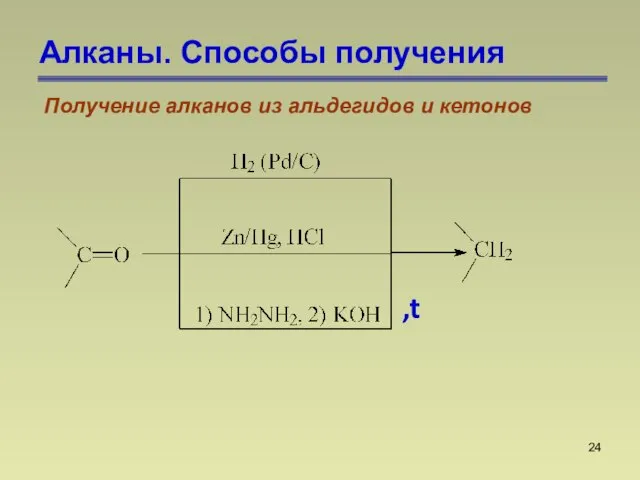
- 24. Алканы. Способы получения Получение алканов из альдегидов и кетонов ,t
- 25. Химические свойства. Реакции замещения. Гомолитическое замещение, SR.
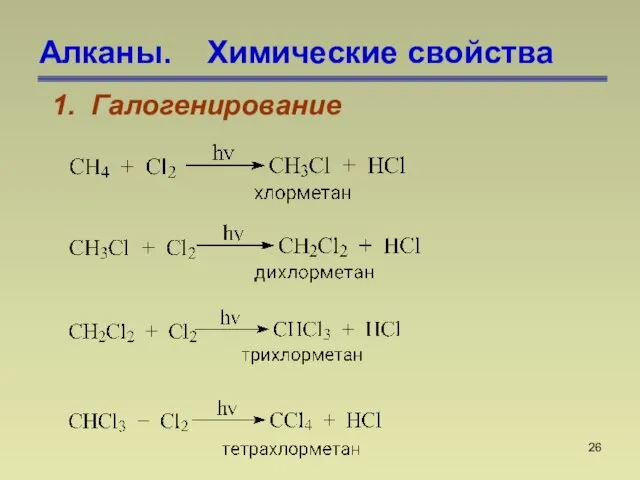
- 26. Алканы. Химические свойства 1. Галогенирование
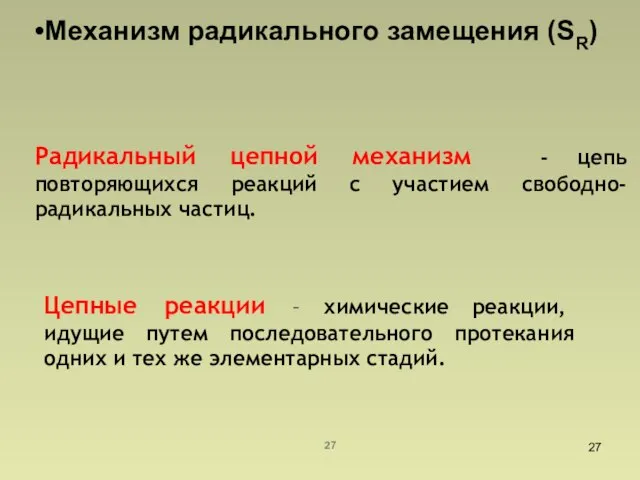
- 27. Механизм радикального замещения (SR) Радикальный цепной механизм - цепь повторяющихся реакций с участием свободно-радикальных частиц. Цепные
- 28. Алканы. Химические свойства Галогенирование (Механизм реакции) I. Инициирование гомолиз
- 29. 1.Галогенирование начинается только под действием инициатора радикальных реакций : 1)нагреванием до температур 200300 С термолиз
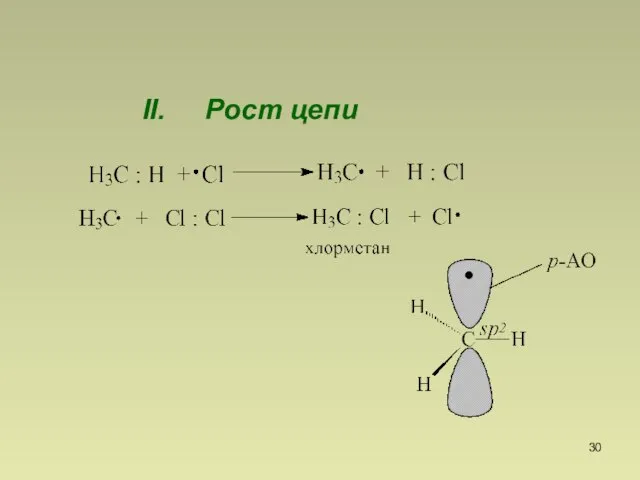
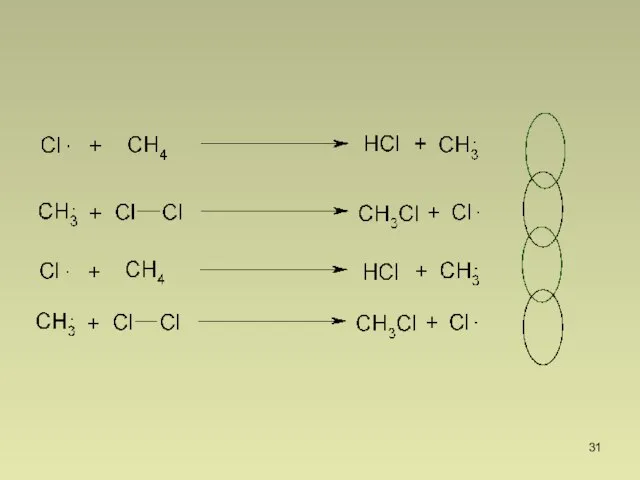
- 30. II. Рост цепи
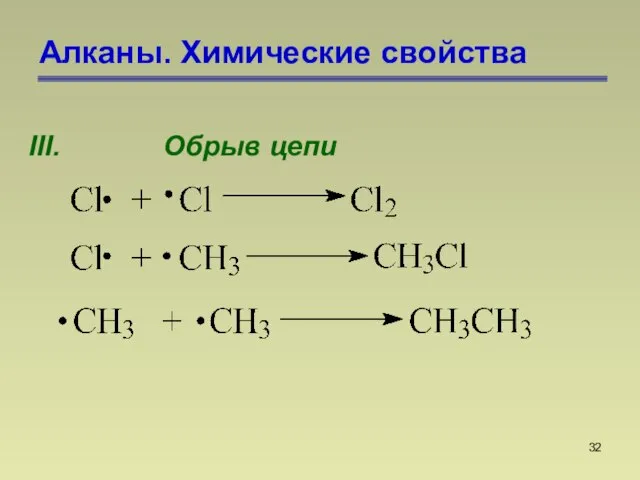
- 32. Алканы. Химические свойства III. Обрыв цепи
- 33. Алканы. Химические свойства Галогенирование (Механизм реакции) При реакциях SR с углеводородами, содержащими атомы С с различной
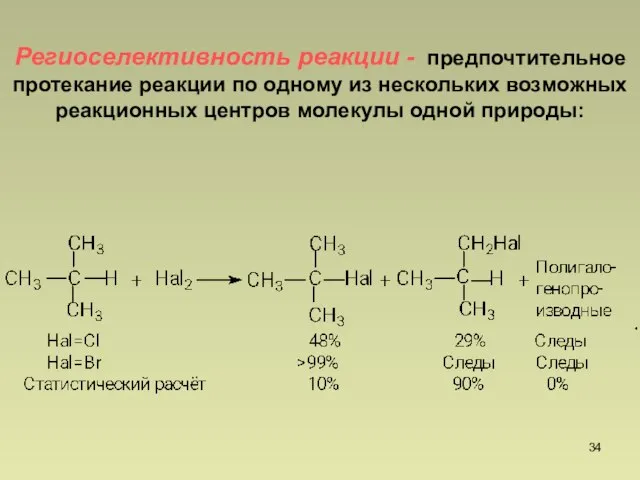
- 34. Региоселективность реакции - предпочтительное протекание реакции по одному из нескольких возможных реакционных центров молекулы одной природы:
- 35. Реакционная способность в ряду галогенов уменьшается слева направо: F2 > Cl2 > Br2 > I2 Региоселективность
- 36. Селективность реакции SR объясняется : 1) различиями в прочности первичных, вторичных и третичных СН связей (ниже
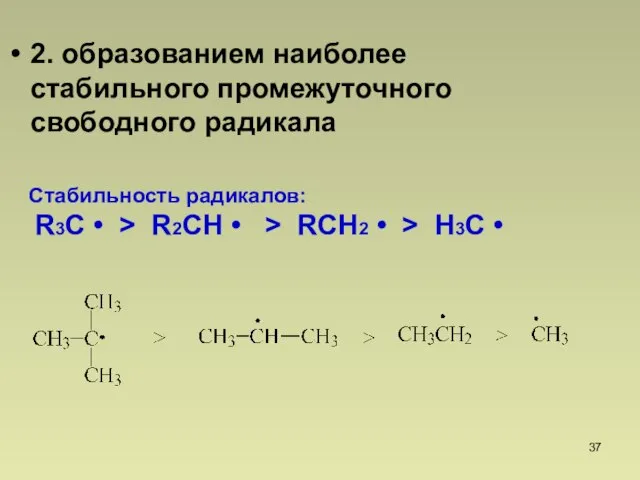
- 37. 2. образованием наиболее стабильного промежуточного свободного радикала Стабильность радикалов: R3C • R2CH • RCH2
- 38. На результат реакции SR оказывают влияние и электронные эффекты тех заместителей, которые имеются в цепи алкана.
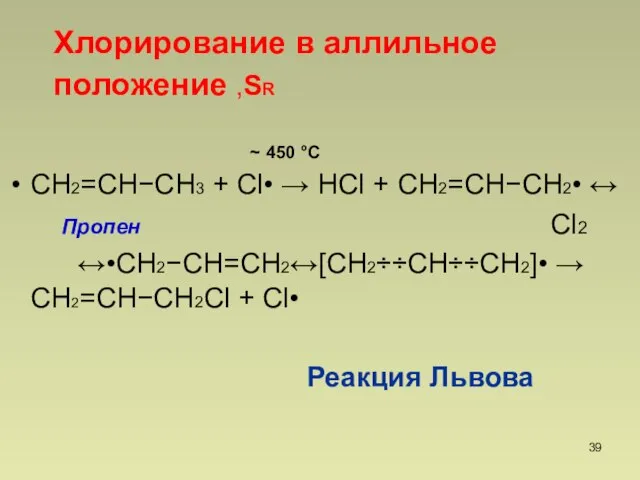
- 39. СН2=СНСН3 + Cl• НCl + СН2=СНСН2• Пропен Cl2 •СН2СН=СН2СН2СНСН2• СН2=СНСН2Cl + Cl• Реакция
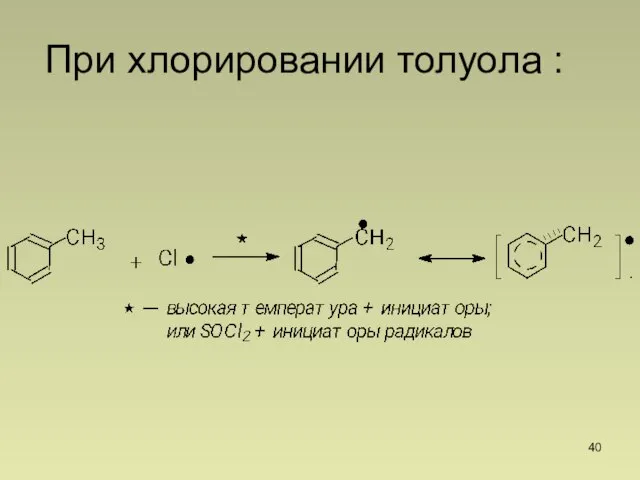
- 40. При хлорировании толуола :
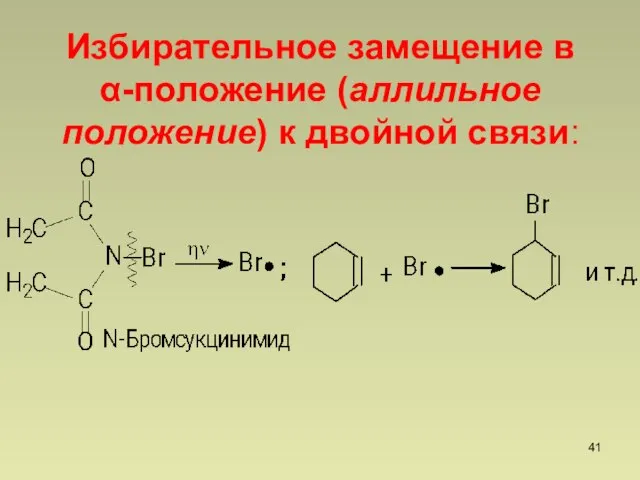
- 41. Избирательное замещение в -положение (аллильное положение) к двойной связи:
- 42. Алканы. Химические свойства 2. Нитрование Реакция М.И. Коновалова обработка 10 – 20 %-ной азотной кислотой в
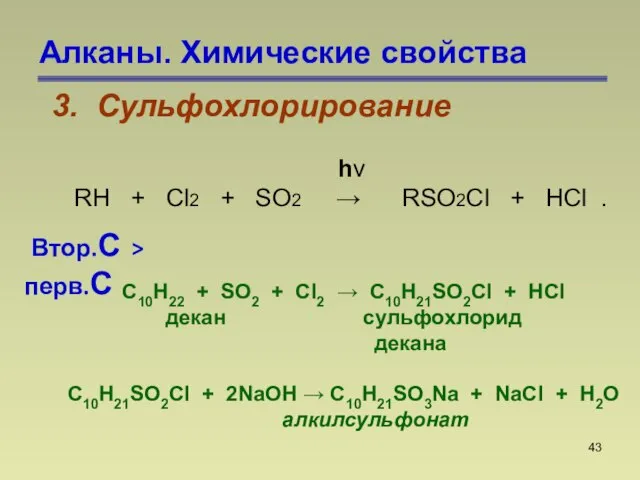
- 43. Алканы. Химические свойства 3. Сульфохлорирование С10H22 + SO2 + Cl2 C10H21SO2Cl + HCl декан сульфохлорид
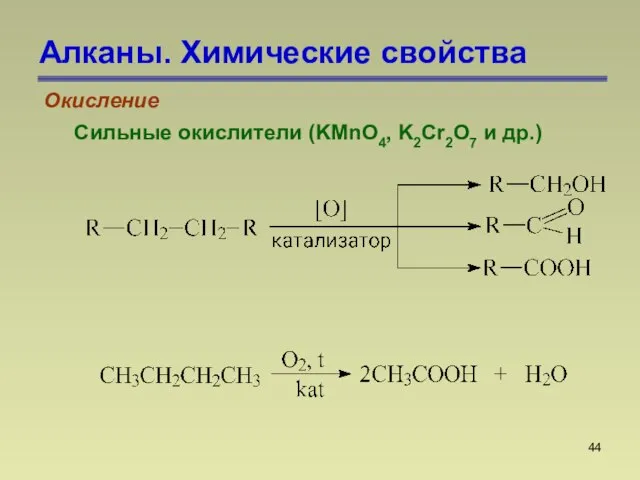
- 44. Алканы. Химические свойства Окисление Сильные окислители (KMnO4, K2Cr2O7 и др.)
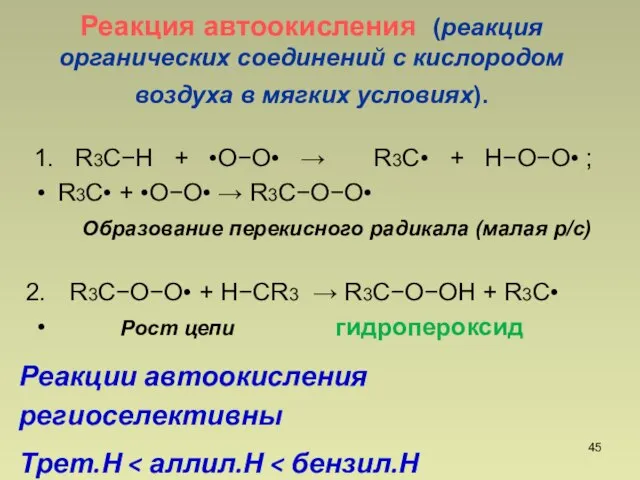
- 45. Реакция автоокисления (реакция органических соединений с кислородом воздуха в мягких условиях). 1. R3CH + •OO•
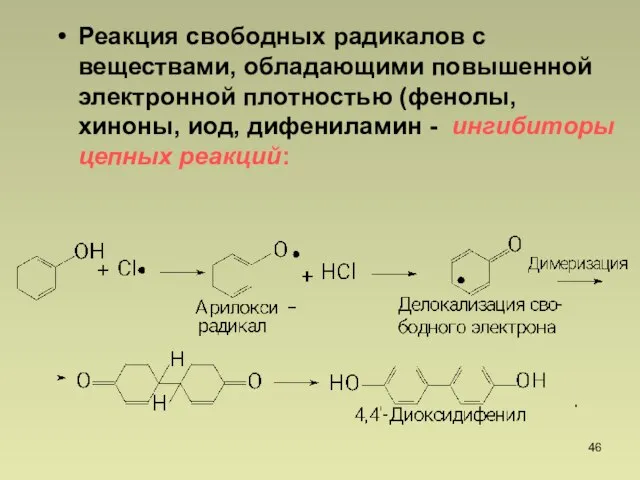
- 46. Реакция свободных радикалов с веществами, обладающими повышенной электронной плотностью (фенолы, хиноны, иод, дифениламин - ингибиторы цепных
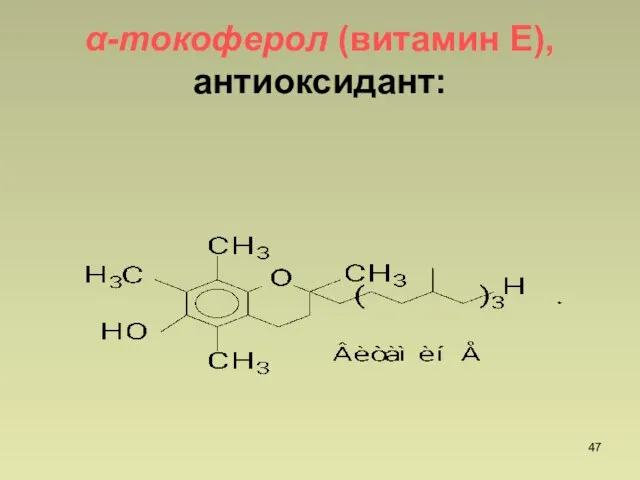
- 47. -токоферол (витамин Е), антиоксидант:
- 49. Скачать презентацию
















 Теория гибридизации. (Лекция 3)
Теория гибридизации. (Лекция 3) Эквиваленты веществ. Жидкое состояние, растворы
Эквиваленты веществ. Жидкое состояние, растворы Презентация по Химии "Интегрированный урок" - скачать смотреть
Презентация по Химии "Интегрированный урок" - скачать смотреть  ИЗВЕСТНЫЕ УЧЕНЫЕ – ХИМИКИ Немного из истории химии
ИЗВЕСТНЫЕ УЧЕНЫЕ – ХИМИКИ Немного из истории химии Определение исходного металла. Решение задачи алгебраическим методом. Исайкин Александр Михайлович учитель химии МОУ «СОШ №2»
Определение исходного металла. Решение задачи алгебраическим методом. Исайкин Александр Михайлович учитель химии МОУ «СОШ №2»  Radiation dosimetry
Radiation dosimetry Кислород. Происхождение слова Кислород
Кислород. Происхождение слова Кислород Формы выделения минералов
Формы выделения минералов Харчові добавки
Харчові добавки  Соединения щелочных металлов
Соединения щелочных металлов Галогены. Способы получения, применение
Галогены. Способы получения, применение Липидтер. Стероидтар. Терпеноидтар. Қорытынды. Пайдаланылған әдебиеттер
Липидтер. Стероидтар. Терпеноидтар. Қорытынды. Пайдаланылған әдебиеттер Сложные эфиры. Жиры. Мыла. (10 класс)
Сложные эфиры. Жиры. Мыла. (10 класс) Введение в органическую химию
Введение в органическую химию The ideal gas equation
The ideal gas equation Классификация основных пород
Классификация основных пород Свойства океанической воды
Свойства океанической воды Реакции ионного обмена
Реакции ионного обмена Такой разный песок Выполнила: Гайдукова Екатерина, 10 класс
Такой разный песок Выполнила: Гайдукова Екатерина, 10 класс  Тема: Ионные уравнения реакции Вспомним реакцию нейтрализации.
Тема: Ионные уравнения реакции Вспомним реакцию нейтрализации.  Презентация по Химии "Презентация Аммиак" - скачать смотреть
Презентация по Химии "Презентация Аммиак" - скачать смотреть  Полисульфидные каучуки
Полисульфидные каучуки Основы теории сплавов. Типы сплавов. Диаграммы состояния сплавов, принцип их построения. (Лекция 2)
Основы теории сплавов. Типы сплавов. Диаграммы состояния сплавов, принцип их построения. (Лекция 2) Химическая кинетика
Химическая кинетика Серебро
Серебро Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Характеристика органических соединений
Характеристика органических соединений Сплавы, растворы, смеси
Сплавы, растворы, смеси