Содержание
- 2. Степень окисления — это тот заряд атома, который возникает при условии, что электронные пары его связей
- 3. МЕТОДЫ ВОССТАНОВЛЕНИЯ И ОКИСЛЕНИЯ Многочисленные методы восстановления и окисления можно разделить на четыре группы: химические, каталитические,
- 4. ХИМИЧЕСКИЕ МЕТОДЫ ВОССТАНОВЛЕНИЯ 1.Востановление металлами и их солями Щелочными металлами (натрием). Оловом и хлоридом олова(II) в
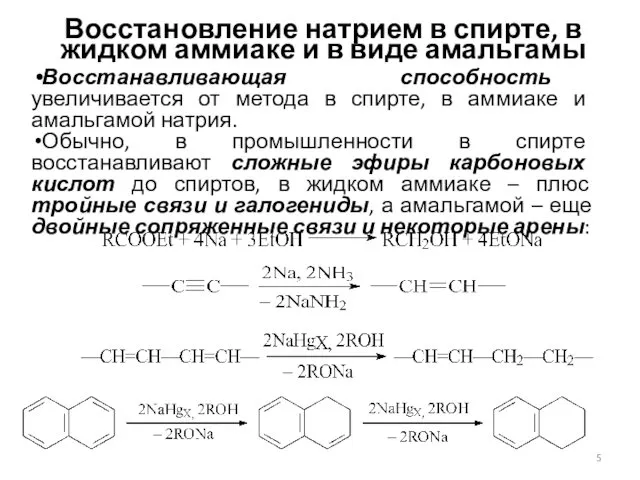
- 5. Восстановление натрием в спирте, в жидком аммиаке и в виде амальгамы Восстанавливающая способность увеличивается от метода
- 6. Механизм восстановления натрием во всех случаях одинаков: атомы натрия отдают электроны, источником протонов является спирт, аммиак
- 7. Технология восстановления щелочными металлами Методики восстановления простые, но опасные (например, к кипящему раствору сложного эфира в
- 8. Технология восстановления амальгамой натрия Амальгаму натрия получают растворением натрия в ртути, что вызывает дополнительные трудности (отвод
- 9. Восстановление оловом, хлоридом олова (II) и железом в кислой среде, цинком в кислой и щелочной средах
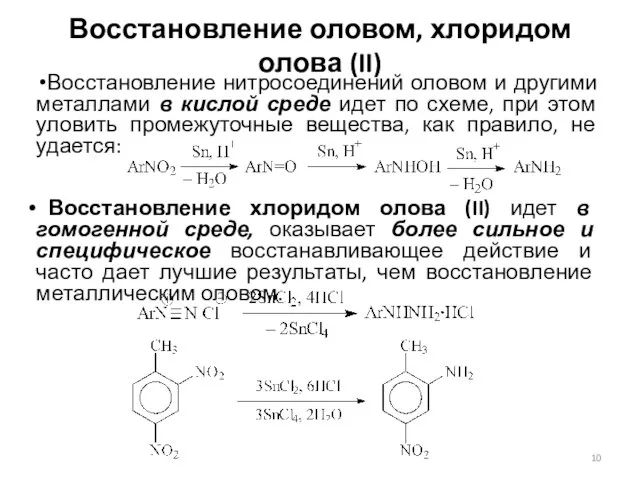
- 10. Восстановление оловом, хлоридом олова (II) Восстановление нитросоединений оловом и другими металлами в кислой среде идет по
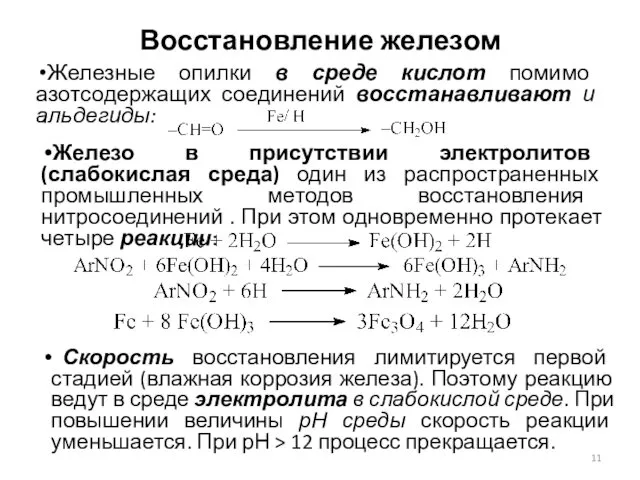
- 11. Восстановление железом Железные опилки в среде кислот помимо азотсодержащих соединений восстанавливают и альдегиды: Железо в присутствии
- 12. Технология восстановления железом в электролитах Электролиты (хлорид аммония, железа (II), и др.) можно получать в самом
- 13. Достоинства и недостатки восстановления железом в электролитах Метод - простотой, технологичный, дешевый, высокий выход. Недостаток метода
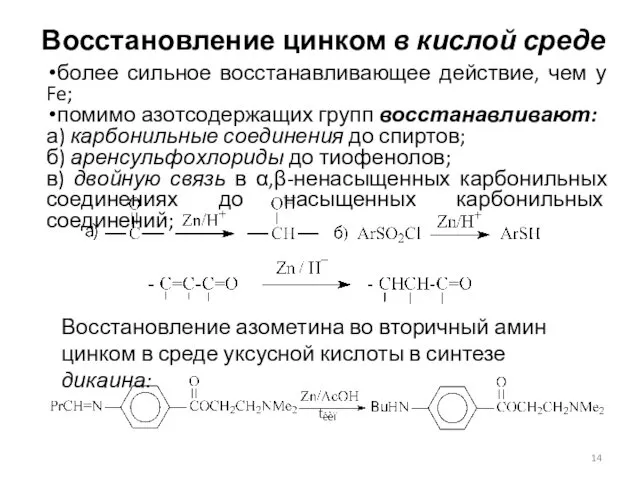
- 14. Восстановление цинком в кислой среде более сильное восстанавливающее действие, чем у Fe; помимо азотсодержащих групп восстанавливают:
- 15. Восстановление цинком в щелочной среде Нитроарены и другие производные, содержащие атом азота в щелочной среде восстанавливаются
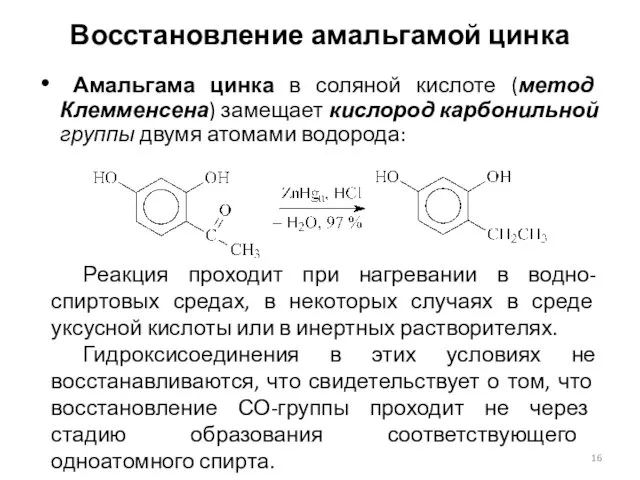
- 16. Восстановление амальгамой цинка Амальгама цинка в соляной кислоте (метод Клемменсена) замещает кислород карбонильной группы двумя атомами
- 17. Восстановление гидридами металлов сильные восстановители (LiAlH4 и NaBH4), используются для восстановления полярных двойных связей углерод–гетероатом, в
- 18. Алюмогидрид лития восстанавливает : не восстанавливает двойные связи углерод–углерод. Восстановление алюмогидридом лития - протекает в безводной
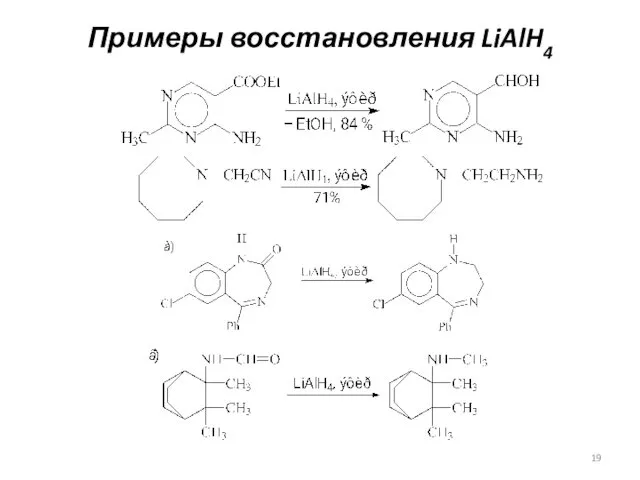
- 19. Примеры восстановления LiAlH4
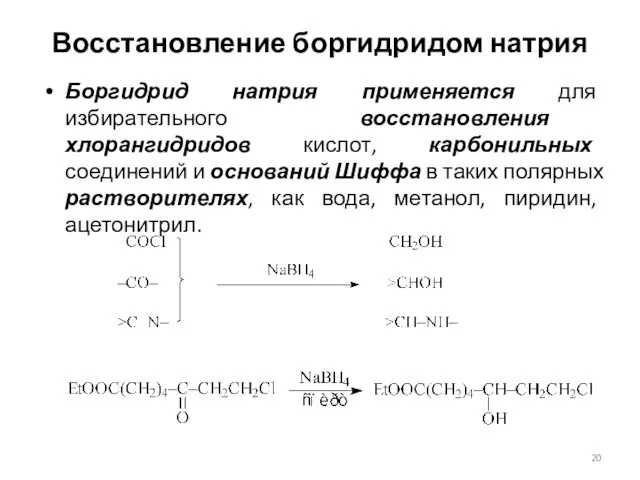
- 20. Восстановление боргидридом натрия Боргидрид натрия применяется для избирательного восстановления хлорангидридов кислот, карбонильных соединений и оснований Шиффа
- 21. Восстановление соединениями серы применяются редко, т.к. имеются более удобные восстановители, и утилизация сточных вод, содержащих вредные
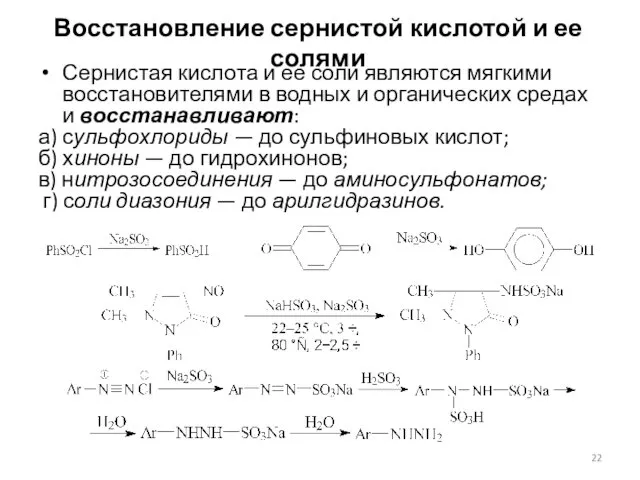
- 22. Восстановление сернистой кислотой и ее солями Сернистая кислота и ее соли являются мягкими восстановителями в водных
- 23. Восстановление алкоголятами алюминия Методом Меервейна-Понндорфа-Верлея) восстанавливают карбонильные соединения в спирты, не затрагивая другие функциональные группы. Алюминий
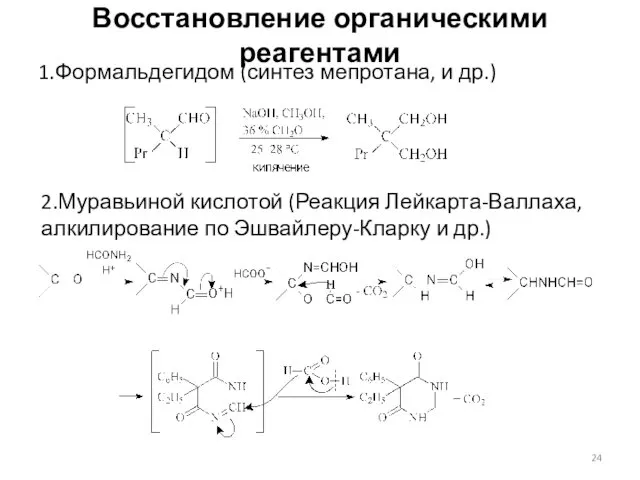
- 24. Восстановление органическими реагентами 1.Формальдегидом (синтез мепротана, и др.) 2.Муравьиной кислотой (Реакция Лейкарта-Валлаха, алкилирование по Эшвайлеру-Кларку и
- 25. Каталитическое восстановление водородом Достоинства: универсальность, высокая скорость процесса, высокий выход продукта, чистота получаемых продуктов и простота
- 26. Катализаторы В химико-фармацевтической промышленности широко применяют скелетный катализатор никель Ренея при нагревании в автоклавах, реже платиновые
- 28. Скачать презентацию
















 Безопасное использование атразина, как гербицида в сельском хозяйстве
Безопасное использование атразина, как гербицида в сельском хозяйстве Білки
Білки  Вода. Химические и физические свойства воды
Вода. Химические и физические свойства воды Комплексные соединения
Комплексные соединения Перекисное окисление липидов. Характеристика, продукты, биологическая и патофизиологическая роль
Перекисное окисление липидов. Характеристика, продукты, биологическая и патофизиологическая роль Презентация на тему: «Химия и пища»
Презентация на тему: «Химия и пища»  19 марта 2010 года
19 марта 2010 года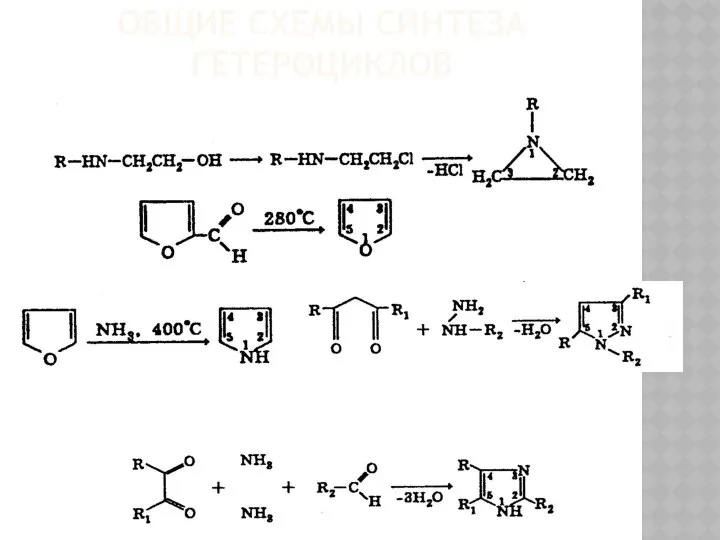 Общие схемы синтеза гетероциклов
Общие схемы синтеза гетероциклов Биохимия гормонов
Биохимия гормонов Взаимодействие в двухкомпонентных системах. Примитивные виды взаимодействия: без промежуточных фаз
Взаимодействие в двухкомпонентных системах. Примитивные виды взаимодействия: без промежуточных фаз Свойства растворов ВМС
Свойства растворов ВМС Оксиды углерода (II) и (IV). Качественная реакция на углекислый газ.
Оксиды углерода (II) и (IV). Качественная реакция на углекислый газ. Витамины. Классификация витаминов
Витамины. Классификация витаминов Презентация по Химии "8 класс Викторина «Что это?»" - скачать смотреть
Презентация по Химии "8 класс Викторина «Что это?»" - скачать смотреть  Алкины (ацетиленовые углеводороды). Номенклатура, изомерия, физические свойства
Алкины (ацетиленовые углеводороды). Номенклатура, изомерия, физические свойства Хімічна і біологічна зброя Виконала: учениця 10-ФМ класу Сосєдка Катерина
Хімічна і біологічна зброя Виконала: учениця 10-ФМ класу Сосєдка Катерина  Липиды. Насыщенные и ненасыщенные жирные кислоты
Липиды. Насыщенные и ненасыщенные жирные кислоты Презентация для класса Способы получения натрия
Презентация для класса Способы получения натрия  Дисперсные системы. Основные понятия
Дисперсные системы. Основные понятия Учебный проект Решение расчетных задач на сплавы, смеси и растворы различными методами. Автор проекта :ученица 9 клас
Учебный проект Решение расчетных задач на сплавы, смеси и растворы различными методами. Автор проекта :ученица 9 клас Теория валентных связей
Теория валентных связей Занимательные задачи по химии
Занимательные задачи по химии Углеводный обмен. Глюкоза крови
Углеводный обмен. Глюкоза крови Нефть, состав, свойства, переработка
Нефть, состав, свойства, переработка Строение атома
Строение атома Душистые вещества животного и растительного происхождения
Душистые вещества животного и растительного происхождения Нефть, её производство, авиационное и дизельное топливо
Нефть, её производство, авиационное и дизельное топливо АЛЮМИНИЙ Овчинникова Ольга Анатольевна Учитель химии МБОУ Российская гимназия № 59 г.Улан-Удэ
АЛЮМИНИЙ Овчинникова Ольга Анатольевна Учитель химии МБОУ Российская гимназия № 59 г.Улан-Удэ