Содержание
- 2. ПЛАН: I. ЖЕЛЕЗО КАК ХИМИЧЕСКИЙ ЭЛЕМЕНТ. II. НАХОЖДЕНИЕ В ПРИРОДЕ И ПРИМЕНЕНИЕ ЖЕЛЕЗА III. ФИЗИЧЕСКИЕ СВОЙСТВА.
- 3. I. КАК ХИМИЧЕСКИЙ ЭЛЕМЕНТ Химический элемент VIII гр. Периодической системы Д.И. Менделеева. Атомный номер 26, атомная
- 4. II. НАХОЖДЕНИЕ В ПРИРОДЕ В земной коре железо распространено достаточно широко. На его долю приходится: Около
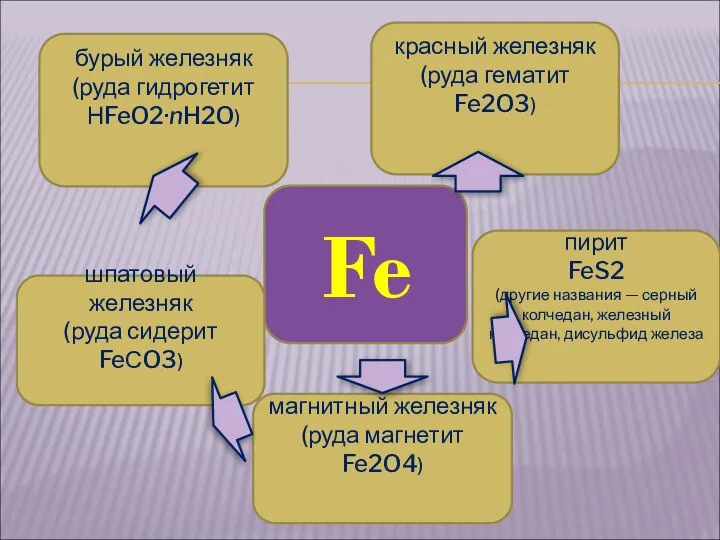
- 5. Fe красный железняк (руда гематит Fe2O3) магнитный железняк (руда магнетит Fe2O4) бурый железняк (руда гидрогетит НFeO2·nH2O)
- 6. КРАСНЫЙ ЖЕЛЕЗНЯК (РУДА ГЕМАТИТ Fe2O3) БУРЫЙ ЖЕЛЕЗНЯК (РУДА ГИДРОГЕТИТ НFEO2 · NH2O)
- 7. ШПАТОВЫЙ ЖЕЛЕЗНЯК (РУДА СИДЕРИТ FEСO3) магнитный железняк (руда магнетит Fe2O4)
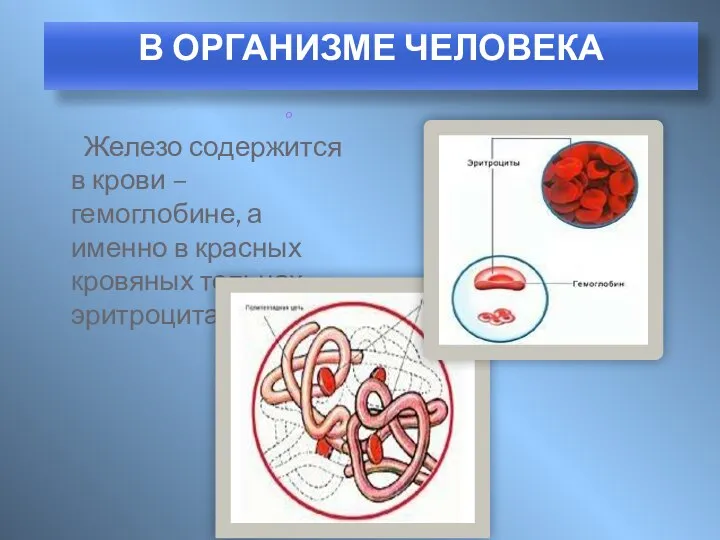
- 8. Железо содержится в крови – гемоглобине, а именно в красных кровяных тельцах – эритроцитах. о В
- 9. Железо влияет на процесс фотосинтеза. В РАСТЕНИЯХ
- 10. Из железа изготавливают различные виды транспорта В БЫТУ ЧЕЛОВЕКА
- 11. В ВОЕННОЙ ПРОМЫШЛЕННОСТИ
- 12. В истории железо известно очень давно. из него изготовляли многое. Например доспехи, латы, оружие и т.
- 13. Железо - сравнительно мягкий ковкий серебристо-серый металл. Температура плавления – 1535 0С Температура кипения около 2800
- 14. Железо, отдавая два внешних электрона, проявляет степень окисления +2; отдавая три электрона (два внешних и один
- 15. Железо — активный металл. На воздухе образуется защитная оксидная пленка, препятствующая ржавению металла. 3Fe + 2O2
- 16. 3. Взаимодействие с простыми веществами: 3.1 Горит в кислороде 3 Fe + 2 O2 =Fe3 O4
- 17. 4.Железо вытесняет из растворов солей металлы, находящиеся в электрохимическом ряду напряжений правее железа: Fe + CuSO4
- 18. 6. С КИСЛОТАМИ: С соляной и разбавленной (приблизительно 20%-й) серной кислотами железо реагирует с образованием солей
- 19. 7. ОКИСЛЕНИЕ ЖЕЛЕЗА При хранении водных растворов солей железа(II) наблюдается окисление железа(II) до железа(III): 4FeCl2 +
- 20. ОКСИД ЖЕЛЕЗА 1. Проявляет основные свойства, взаимодействуя с кислотами: FeO+H2SO4 = FeSO4 + H2O 2. Оксид
- 21. КАЧЕСТВЕННЫЕ РЕАКЦИИ НА ИОНЫ FE2+ И FE3+. FeSO4 + K3 [Fe(CN)6 ] = KFe +2 [Fe
- 22. Когда открыто железо никто не знает и не узнает, так как это было слишком давно. Но
- 24. Скачать презентацию



















 Готовимся к экзамену по химии. 9 класс
Готовимся к экзамену по химии. 9 класс Аэробное окисление углеводов. (Часть 2)
Аэробное окисление углеводов. (Часть 2) Оксиды азота
Оксиды азота Классификация кислот
Классификация кислот Қатты күйдегі препараттар
Қатты күйдегі препараттар Полиамиды. Классификация по методу получения
Полиамиды. Классификация по методу получения Химический элемент платина
Химический элемент платина Щелочные металлы
Щелочные металлы Растворы (дисперсные системы)
Растворы (дисперсные системы) Тақырыпқа байланысты білімді жүйелеу
Тақырыпқа байланысты білімді жүйелеу II главная подгруппа ПС: Be, Mg, Ca, Sr, Ba, Ra
II главная подгруппа ПС: Be, Mg, Ca, Sr, Ba, Ra Выращивание кристалла медного купороса CuSO4*5Н2О в разных условиях
Выращивание кристалла медного купороса CuSO4*5Н2О в разных условиях Генетичний зв'язок
Генетичний зв'язок Презентация по Химии "РАСТВОРЫ" - скачать смотреть бесплатно
Презентация по Химии "РАСТВОРЫ" - скачать смотреть бесплатно Органічні розчинники. Їх застосування
Органічні розчинники. Їх застосування Получение этилена и опыты с ним. (Практическая работа 2)
Получение этилена и опыты с ним. (Практическая работа 2) Презентация по Химии "Ковалентная химическая связь" - скачать смотреть бесплатно
Презентация по Химии "Ковалентная химическая связь" - скачать смотреть бесплатно Основы химической термодинамики
Основы химической термодинамики Определение свободной поверхностной энергии тонких пленок оксидов
Определение свободной поверхностной энергии тонких пленок оксидов Внеурочная работа по химии. Краеведение
Внеурочная работа по химии. Краеведение Азотная кислота
Азотная кислота Жоғары температурағы асқын өткізгіштер
Жоғары температурағы асқын өткізгіштер Введение в биоорганическую химию. Пространственное и электронное строение органических соединений
Введение в биоорганическую химию. Пространственное и электронное строение органических соединений Исследовательская работа на тему: Удивительные свойства воды
Исследовательская работа на тему: Удивительные свойства воды “Кількість речовини. Молярна маса. Молярний об’єм” Урок хімії у 8 класі КЗ Верхівцевського НВК Учитель Кукса Наталія Миколаївна.
“Кількість речовини. Молярна маса. Молярний об’єм” Урок хімії у 8 класі КЗ Верхівцевського НВК Учитель Кукса Наталія Миколаївна.  Степень окисления
Степень окисления Презентация по Химии "Щавелевая кислота" - скачать смотреть
Презентация по Химии "Щавелевая кислота" - скачать смотреть  Количества вещества
Количества вещества