Содержание
- 2. Периодический закон – один из важнейших законов химии. Он был открыт Д. И. Менделеевым 1 марта
- 3. Периодическое изменение свойств химических элементов и их соединений
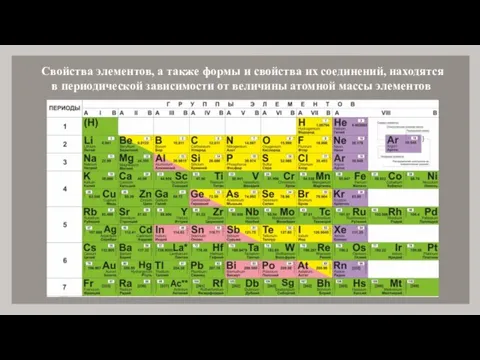
- 4. Свойства элементов, а также формы и свойства их соединений, находятся в периодической зависимости от величины атомной
- 5. Периодическая система — это графическое выражение периодического закона Символ элемента Относительная атомная масса (Ar) Порядковый (атомный)
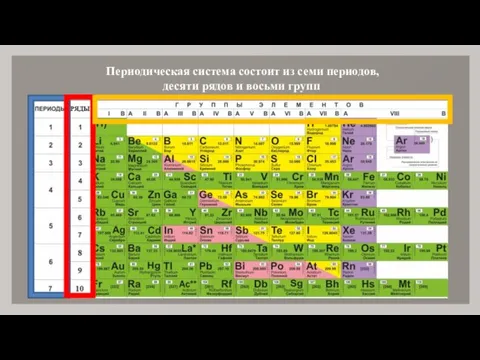
- 6. Периодическая система состоит из семи периодов, десяти рядов и восьми групп
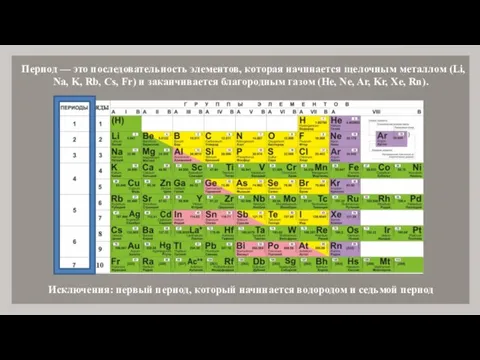
- 7. Период — это последовательность элементов, которая начинается щелочным металлом (Li, Na, K, Rb, Cs, Fr) и
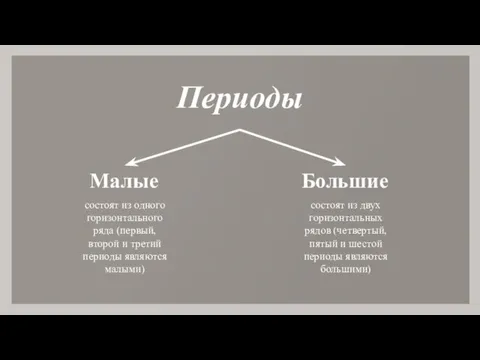
- 8. Периоды Малые Большие состоят из одного горизонтального ряда (первый, второй и третий периоды являются малыми) состоят
- 9. усиливаются неметаллические свойства усиливаются металлические свойства
- 10. Группа — это совокупность элементов, которые имеют одинаковую высшую валентность в оксидах и в других соединениях.
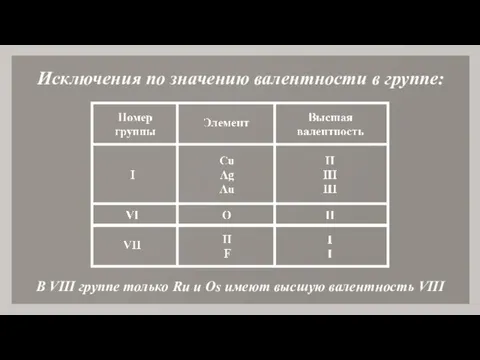
- 11. Исключения по значению валентности в группе: В VIII группе только Ru и Os имеют высшую валентность
- 13. Скачать презентацию





 Окислительно-восстановительные реакции в органической химии
Окислительно-восстановительные реакции в органической химии Стерилизация технологических потоков и оборудования
Стерилизация технологических потоков и оборудования Состав раствора количественно характеризуется величинами концентраций
Состав раствора количественно характеризуется величинами концентраций Применение химических реакций в быту
Применение химических реакций в быту Составление электронных формул и электронно-графических схем строения атома
Составление электронных формул и электронно-графических схем строения атома Физические свойства металлов
Физические свойства металлов Ароматические углеводороды. Арены
Ароматические углеводороды. Арены Выделение нефтегазоматеринских пород по данным пиролиза. Построение геохимического разреза
Выделение нефтегазоматеринских пород по данным пиролиза. Построение геохимического разреза Свободные радикалы и болезни человека
Свободные радикалы и болезни человека Электролитическая диссоциация. Реакции ионного обмена
Электролитическая диссоциация. Реакции ионного обмена Фосфор – тіршілік пен ақыл – ой элементі
Фосфор – тіршілік пен ақыл – ой элементі An introduction to the chemistry of alkenes
An introduction to the chemistry of alkenes Три состояния вещества
Три состояния вещества Влияние производных бензохинона на радиационно-индуцированную фрагментацию биомолекул и моделирующих их соединений
Влияние производных бензохинона на радиационно-индуцированную фрагментацию биомолекул и моделирующих их соединений Группа веществ, изолируемых экстракцией органическими растворителями (пестициды или ядохимикаты)
Группа веществ, изолируемых экстракцией органическими растворителями (пестициды или ядохимикаты) Мыс және оның қорытпалары
Мыс және оның қорытпалары Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості.
Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості.  Предмет органической химии. Классификация органических веществ
Предмет органической химии. Классификация органических веществ Zhiry. Липидтердің классификациясы
Zhiry. Липидтердің классификациясы Углеводороды. Структура и функции биолекул
Углеводороды. Структура и функции биолекул Биохимия печени
Биохимия печени Спирты (карбинолы)
Спирты (карбинолы) Счастливы вместе с химией
Счастливы вместе с химией Презентация по Химии "«Медь»" - скачать смотреть _
Презентация по Химии "«Медь»" - скачать смотреть _ Мыла: прошлое, настоящее, будущее
Мыла: прошлое, настоящее, будущее Практическая работа «Получение и свойства этилена» Автор: Алла Александровна Бочкарева, учитель химии г.Кириши Ленинградской обл
Практическая работа «Получение и свойства этилена» Автор: Алла Александровна Бочкарева, учитель химии г.Кириши Ленинградской обл Комплексиметрическое титрование. (Лекция 12)
Комплексиметрическое титрование. (Лекция 12) Волокнистые наполнители. (Тема 5)
Волокнистые наполнители. (Тема 5)