Содержание
- 2. Состав раствора количественно характеризуется величинами концентраций Массовая, мольная, объемная доли [ доли,%] Массовая концентрация [г/л] Молярная
- 3. Эквивалент Закон эквивалентов
- 5. Основные определения Эквивалентом называется реальная или условная частица вещества, которая может замещать, присоединять, содержать, обменивать, высвобождать
- 6. Эквивалентное число (Z) – это число, показывающее, какому числу ионов водорода (Н+) в кислотно-основных или ионообменных
- 8. Кислоты Основания Оксида (бинарного соединения) Соли Химического элемента В ОВР Фактор эквивалентности
- 12. Основные определения Количеством вещества эквивалентов называется такое его количество: которое может замещать, присоединять, содержать, обменивать, высвобождать
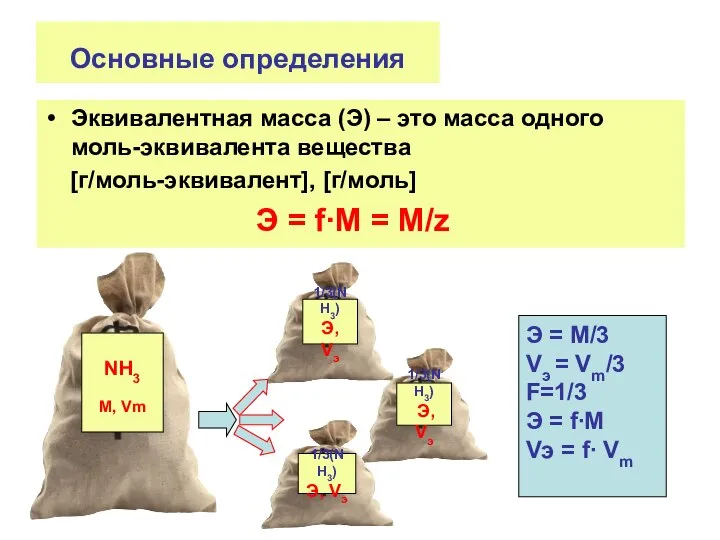
- 13. Основные определения Эквивалентная масса (Э) – это масса одного моль-эквивалента вещества [г/моль-эквивалент], [г/моль] Э = f∙M
- 14. Основные определения 1 моль вещества содержит z моль эквивалентов n = z∙ m = ∙M =
- 15. Нормальная (эквивалентная) концентрация
- 16. Закон эквивалентов Вещества взаимодействуют и образуются в химических реакциях в количествах равных эквивалентов
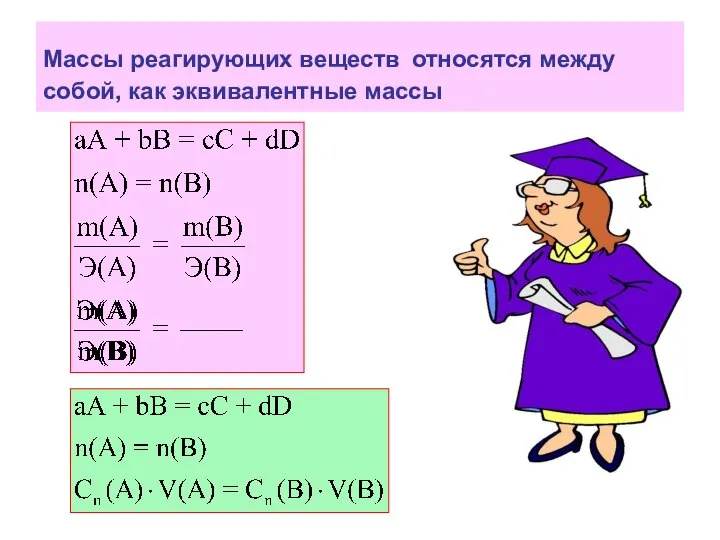
- 17. Массы реагирующих веществ относятся между собой, как эквивалентные массы
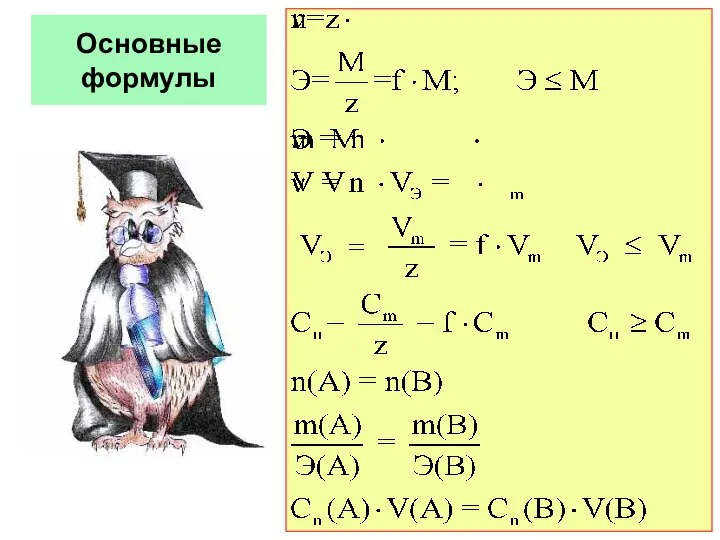
- 18. Основные формулы
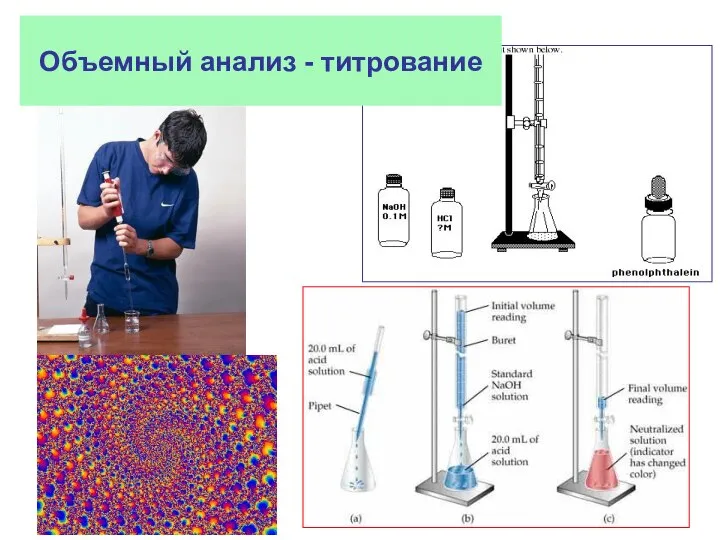
- 19. Объемный анализ - титрование
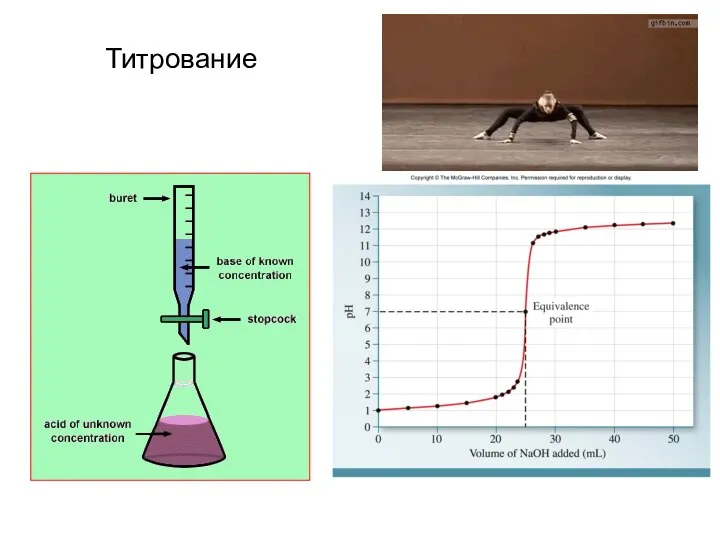
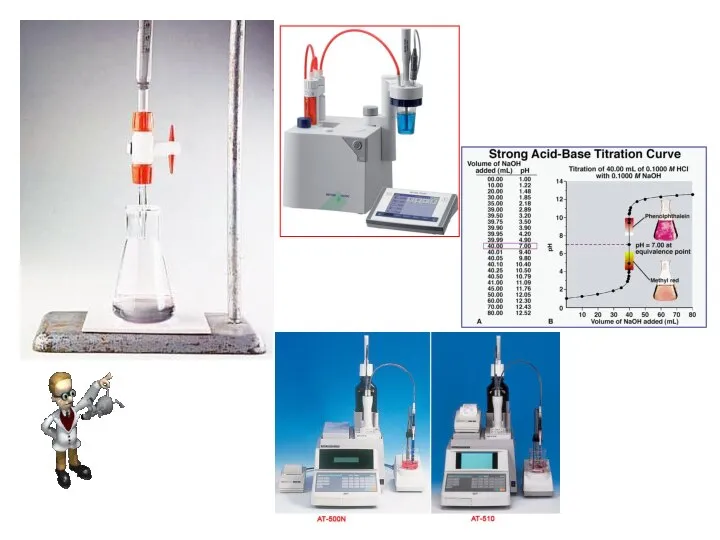
- 20. Титрование
- 22. Закон разведения
- 23. Задачи При окислении 2,81 г кадмия получено 3,21 г оксида кадмия. Вычислить эквивалентную массу кадмия. Определить
- 24. Задачи Определить фактор эквивалентности H2SO4 в реакциях с раствором КОН при образовании а) КНSO4, б) К2SO4.
- 26. Скачать презентацию
















 Возникновение органической химии, как науки
Возникновение органической химии, как науки Коллоидты жүйелердің коагуляциялық және кристаллизациялық құрылымдары
Коллоидты жүйелердің коагуляциялық және кристаллизациялық құрылымдары Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості.
Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості.  VI группа периодической системы. VIA-группа
VI группа периодической системы. VIA-группа Установка кристаллов
Установка кристаллов ЕГЭ Химия. Задание №5
ЕГЭ Химия. Задание №5 Изделия на основе углеволокон
Изделия на основе углеволокон Презентация по Химии "Получение водорода в лаборатории" - скачать смотреть
Презентация по Химии "Получение водорода в лаборатории" - скачать смотреть  Растворы. Общая характеристика растворов
Растворы. Общая характеристика растворов Токсикология и анализ спиртов
Токсикология и анализ спиртов Физические свойства металлов
Физические свойства металлов Биохимия витаминов. Классификация витаминов. Жирорастворимые витамины. (Лекция 20)
Биохимия витаминов. Классификация витаминов. Жирорастворимые витамины. (Лекция 20) Законы химии. Массовая доля вещества в растворе. Решение задач. (Лекция 3)
Законы химии. Массовая доля вещества в растворе. Решение задач. (Лекция 3) Эмульсии, микроэмульсии и пены. Производство и применение
Эмульсии, микроэмульсии и пены. Производство и применение Роль химии в нашей жизни
Роль химии в нашей жизни Положение атомов - металлов в ПСХЭ Д.И.Менделеева. 9 класс
Положение атомов - металлов в ПСХЭ Д.И.Менделеева. 9 класс Soluţiile sunt amestecuri omogene de două sau mai multe substanţe
Soluţiile sunt amestecuri omogene de două sau mai multe substanţe Строение вещества
Строение вещества Нефть. Состав и свойства
Нефть. Состав и свойства Этилен. Действие этилена на рост проростков гороха
Этилен. Действие этилена на рост проростков гороха Полиморфизм. Аллотропия
Полиморфизм. Аллотропия Буландырғыш аппараттарының құрылымдары
Буландырғыш аппараттарының құрылымдары Комплексные соединения хлоридов европия и гадолиния с салициловой кислотой
Комплексные соединения хлоридов европия и гадолиния с салициловой кислотой Бериллий: основные свойства, технологии получения, применение
Бериллий: основные свойства, технологии получения, применение Поняття про лікарські препарати Підготували Стебко Марія, Бондар Аліна 11-Ф
Поняття про лікарські препарати Підготували Стебко Марія, Бондар Аліна 11-Ф  Катализдің түрлері жене маңызы
Катализдің түрлері жене маңызы Наносеребрянные носки
Наносеребрянные носки Аминокислоты. Классификация. Реакционная способность
Аминокислоты. Классификация. Реакционная способность