Содержание
- 4. Самые распространенные комбинации параллельные последовательные обратимые -Реакцию, в которой реагент подвергается превращению по двум или нескольким
- 5. Прямая задача химической кинетики Определяют кинетическую схему реакции – или ее механизм (определенную совокупность стадий) На
- 10. При протекании двух параллельных реакций первого порядка реакционную схему можем представить в виде (15) (16) Независимы
- 11. Для определения каждой из констант по данным эксперимента нужно из (20) исключить выражение в квадратных скобках
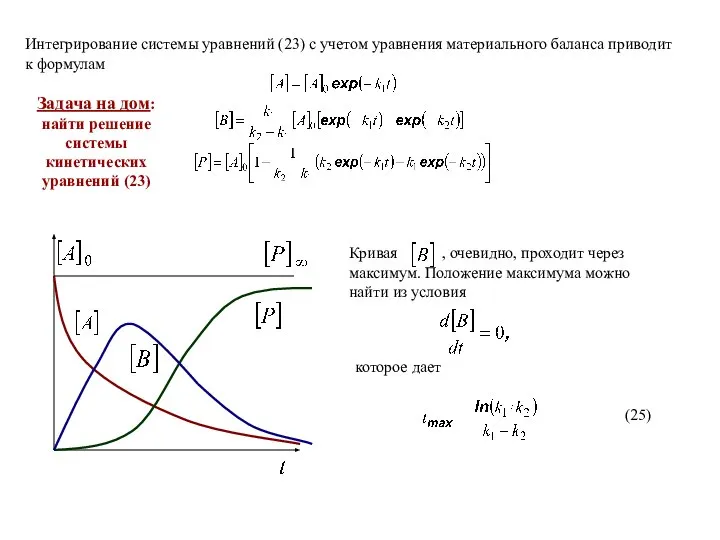
- 13. Задача на дом: найти решение системы кинетических уравнений (23)
- 14. Энергия активации Предэкспоненциальный множитель
- 16. Что же делать в случае сложных реакций в многофазных системах? (1) (2) (3) (4) …… Если
- 17. Где взять параметры? Для химических реакций: химическая термодинамика; квантовая химия, молекулярная динамика 1.Справочники 2.Эксперимент 3.Независимые модели
- 18. Литература 1. Эмануэль Н.М., Кнорре Д.Г. Курс химической кинетики 2. Франк-Каменецкий Д.А. Диффузия и теплопередача в
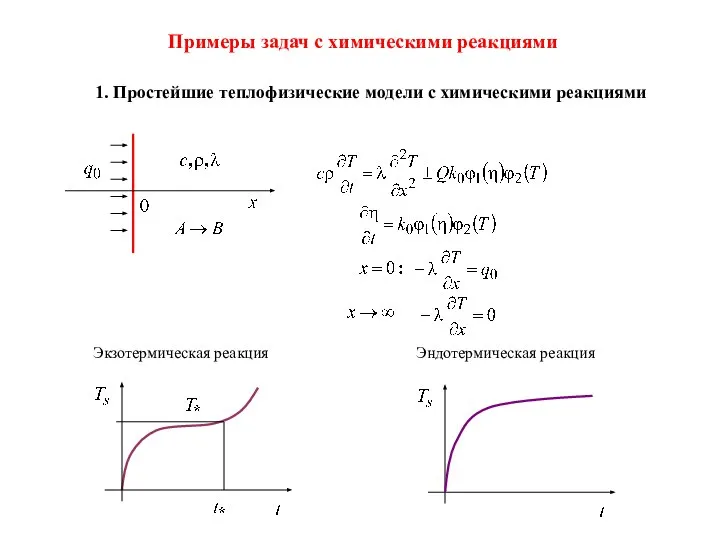
- 19. Примеры задач с химическими реакциями 1. Простейшие теплофизические модели с химическими реакциями Экзотермическая реакция Эндотермическая реакция
- 20. Примеры задач с химическими реакциями 2.Синтез композита в вакуумной камере (1)
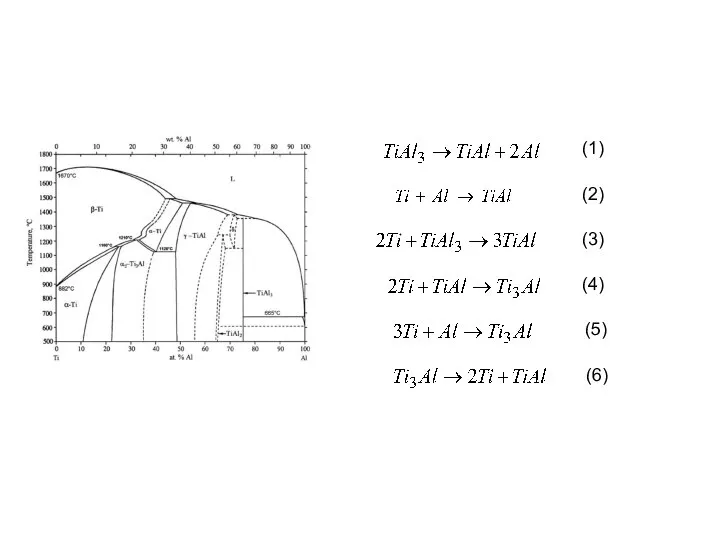
- 21. (1) (2) (3) (4) (5) (6)
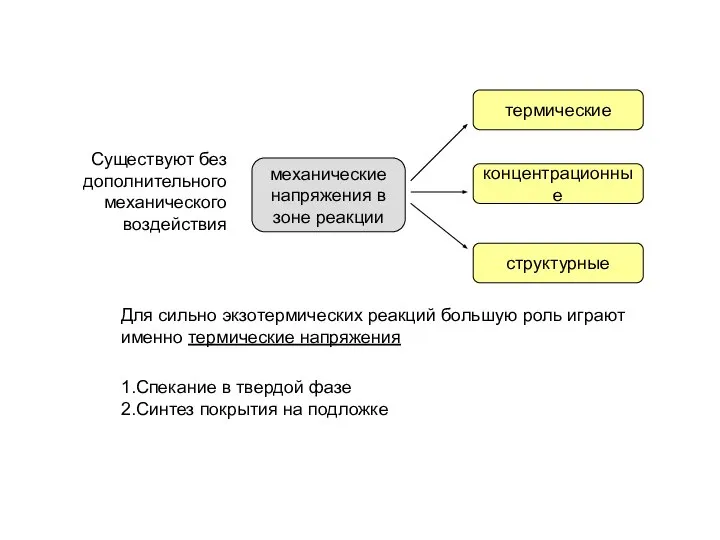
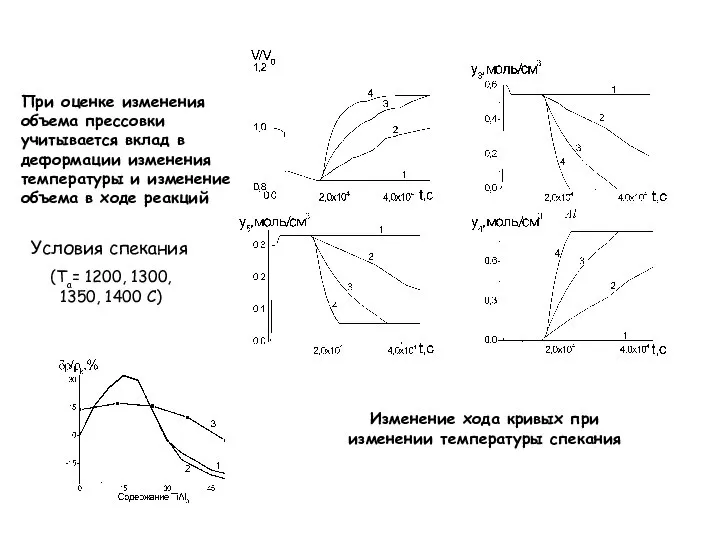
- 24. При оценке изменения объема прессовки учитывается вклад в деформации изменения температуры и изменение объема в ходе
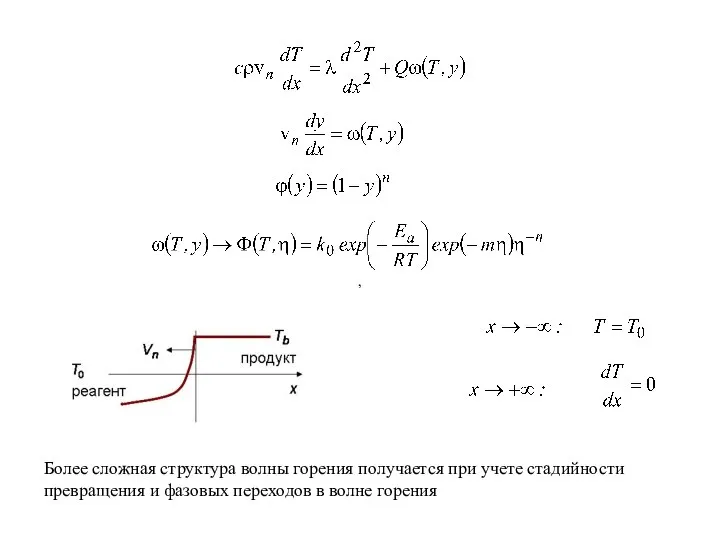
- 25. Примеры задач с химическими реакциями 3. Теория твердофазного горения В теории горения требуется определить характер распространения
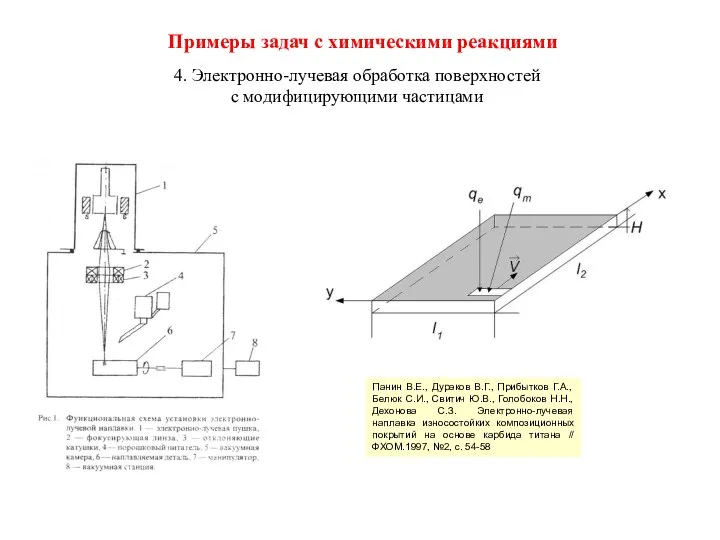
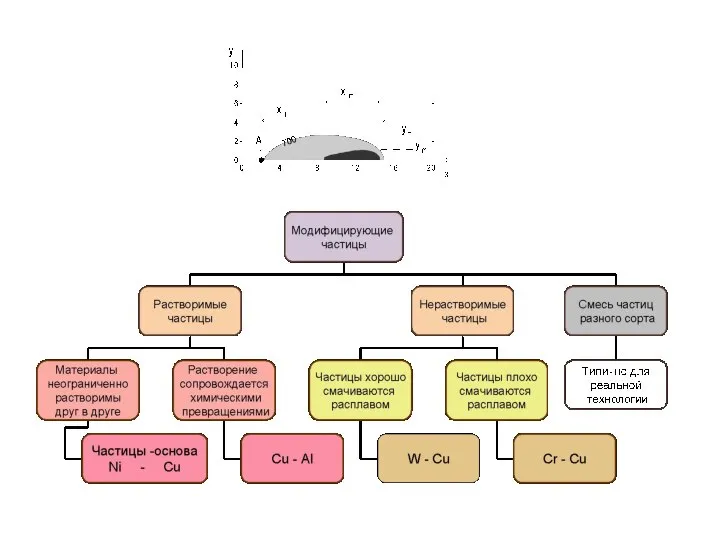
- 27. Примеры задач с химическими реакциями 4. Электронно-лучевая обработка поверхностей с модифицирующими частицами Панин В.Е., Дураков В.Г.,
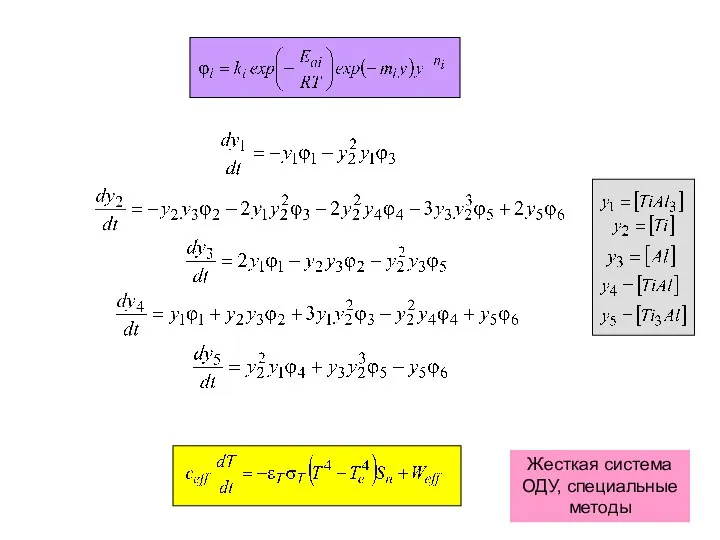
- 29. (5) (6) (7) (1) (2) (3) (4) (8)
- 30. Плавление – через теплоемкость; используется теория двухфазной зоны 0-0.3 вес % меди на диаграмме состояния Al+Cu
- 31. (13) (14) Растворение: (12)
- 33. Скачать презентацию


















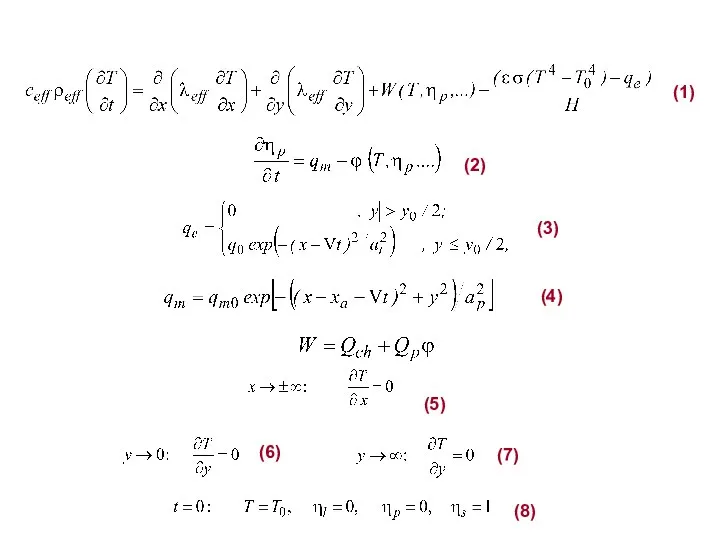


 Обмен белков. Общие пути обмена аминокислот
Обмен белков. Общие пути обмена аминокислот Умные материалы
Умные материалы Свойства металла. Подготовительная группа 2
Свойства металла. Подготовительная группа 2 Химическая кинетика и катализ. Смещение химического равновесия
Химическая кинетика и катализ. Смещение химического равновесия Методы выращивания GaAs. Сравнение
Методы выращивания GaAs. Сравнение Хроматография как метод разделения и обнаружения в качественном анализе Выполнила: студентка 2 курса Акаева Дарья
Хроматография как метод разделения и обнаружения в качественном анализе Выполнила: студентка 2 курса Акаева Дарья  Внеклассное мероприятие: Свойства активированного угля
Внеклассное мероприятие: Свойства активированного угля Нефть: состав, основные физико-химические свойства. Классификация нефтей
Нефть: состав, основные физико-химические свойства. Классификация нефтей Массасы 4,2 г көміртек (IV) оксиді сумен әрекеттескенде қанша грамм көмір қышқылы (Н2СО3) түзілетінін есепте
Массасы 4,2 г көміртек (IV) оксиді сумен әрекеттескенде қанша грамм көмір қышқылы (Н2СО3) түзілетінін есепте Сера и ее аллотропные модификации. (9 класс)
Сера и ее аллотропные модификации. (9 класс) Типы химических реакций
Типы химических реакций  Ионно-координационная полимеризация
Ионно-координационная полимеризация Технология получения полиуретанов
Технология получения полиуретанов Коррозия металлов
Коррозия металлов Известные химики
Известные химики Проблемы загрязнения воды Ташбаев Далерхан 7 «А»
Проблемы загрязнения воды Ташбаев Далерхан 7 «А» Качественные и количественные методы обработки хроматограмм
Качественные и количественные методы обработки хроматограмм Оксиды углерода
Оксиды углерода «Углерод». Презентация к открытому уроку химии 9 класс. Выполнила: Отряскина Т. А.
«Углерод». Презентация к открытому уроку химии 9 класс. Выполнила: Отряскина Т. А.  Презентация по Химии "Галогени" - скачать смотреть бесплатно
Презентация по Химии "Галогени" - скачать смотреть бесплатно Химическая кинетика
Химическая кинетика Fiber. Iron. Calcium
Fiber. Iron. Calcium Свойства растворов и гетерогенных систем
Свойства растворов и гетерогенных систем Небезпечні хімічні речовини Підготувала: учениця 8 – А класу Кіровоградського НВК №34 Подколзіна Анна
Небезпечні хімічні речовини Підготувала: учениця 8 – А класу Кіровоградського НВК №34 Подколзіна Анна  Агрегатные состояния вещества
Агрегатные состояния вещества Основания. Состав оснований
Основания. Состав оснований Презентация по Химии "Кинетика химических реакций.Химическое равновесие" - скачать смотреть
Презентация по Химии "Кинетика химических реакций.Химическое равновесие" - скачать смотреть  Гидролиз органических веществ
Гидролиз органических веществ