Содержание
- 2. ХИМИЧЕСКАЯ КИНЕТИКА И КАТАЛИЗ Химическая кинетика - учение о скорости химических реакций и зависимости ее от
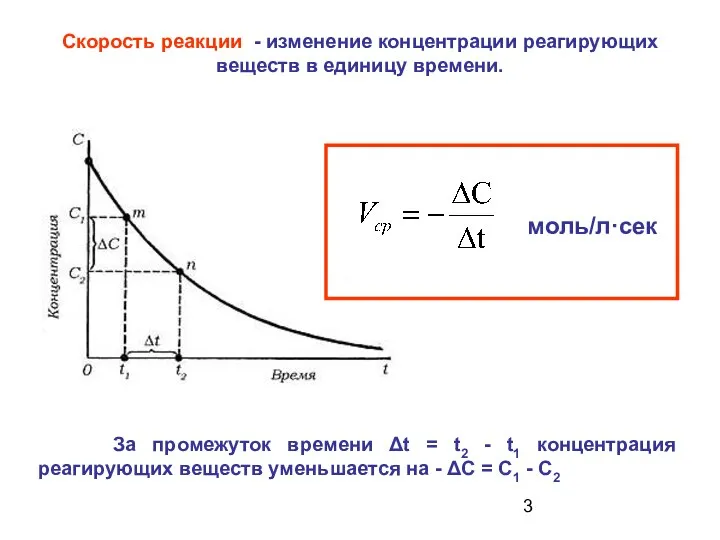
- 3. Скорость реакции - изменение концентрации реагирующих веществ в единицу времени. За промежуток времени Δt = t2
- 4. ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬ ГОМОГЕННЫХ РЕАКЦИЙ концентрация реагентов природа реагирующих веществ температура катализатор
- 5. Влияние концентрации реагентов Скорость химической реакции зависит от концентрации реагирующих веществ - чем выше концентрация, тем
- 6. Закон действующих масс – ЗДМ (принцип Гульдберга - Вааге) Скорость гомогенной реакции при постоянной температуре пропорциональна
- 7. k - константа скорости химической реакции ( удельная скорость реакции ) численно равна скорости химической реакции
- 8. Концентрации твердых веществ в гетерогенных системах не входят в выражение константы химического равновесия !!! Прямая реакция
- 9. Вместе с тем, чем больше поверхность соприкосновения, тем быстрее протекает реакция. Поверхность твердых веществ может быть
- 10. Задание 2 Как изменится скорость реакции выделения водорода Mg + 2HCl = MgCl2 + H2, если
- 11. Задание 3 Реакция, скорость которой зависит от площади поверхности соприкосновения реагирующих веществ, - это: 1) нейтрализация
- 12. ВЛИЯНИЕ ПРИРОДЫ РЕАГИРУЮЩИХ ВЕЩЕСТВ Скорость химической реакции зависит от природы химических соединений, подобно тому, как скорость
- 13. Реакции между молекулами протекают обычно медленно, между ионами и радикалами – быстро: Природу реагирующих веществ учитывает
- 14. Задание 5 С наибольшей скоростью при обычных условиях взаимодействуют 1) цинк и соляная кислота 2) натрий
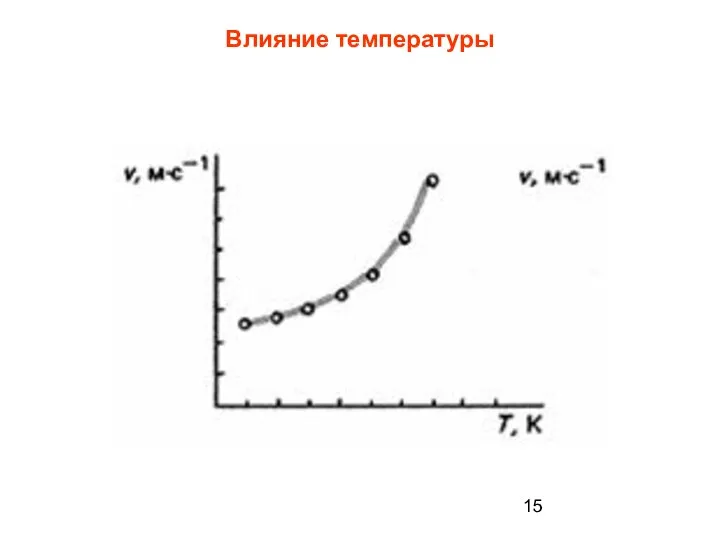
- 15. Влияние температуры
- 16. Закон Вант-Гоффа При повышении температуры на 10° скорость химической реакции возрастает в два-четыре раза. Если повысить
- 17. Задание 6 При повышении температуры 30о скорость реакции, температурный коэффициент которой равен 2, возрастает в ….
- 18. Рост скорости реакции с температурой объясняется тем, что не всякое столкновение приводит к химическому превращению. Для
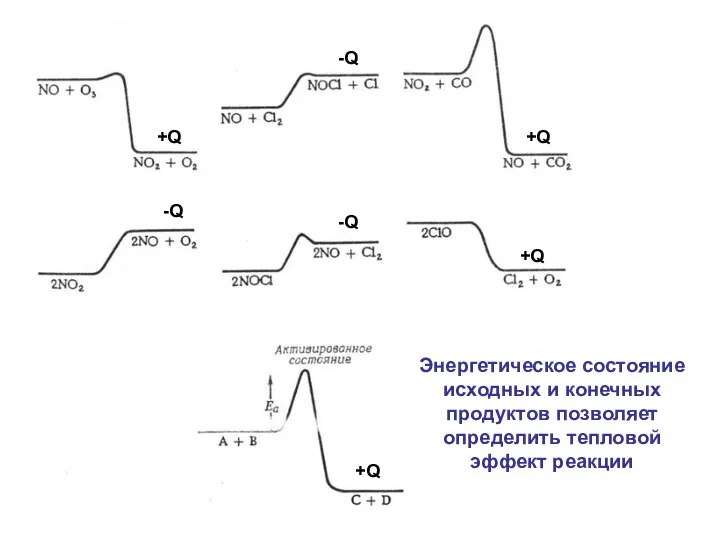
- 19. Энергетическое состояние исходных и конечных продуктов позволяет определить тепловой эффект реакции +Q -Q -Q -Q +Q
- 20. Катализаторы - вещества, увеличивающие скорость химических реакций Ингибиторы - вещества, замедляющие скорость химических реакций Влияние катализатора
- 21. Гетерогенные катализаторы. Из одного вещества можно получить различные продукты в зависимости от катализатора
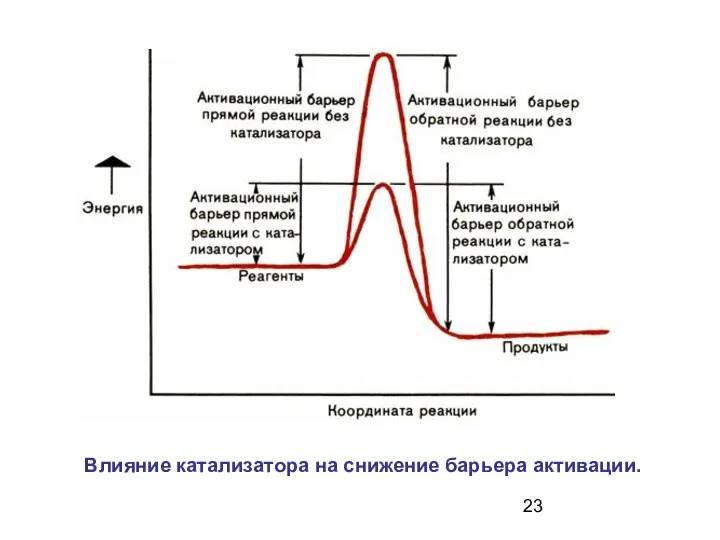
- 22. Катализатор понижает энергетический барьер, его могут преодолеть и молекулы, обладающие малой энергией Роль катализатора заключается в
- 23. Влияние катализатора на снижение барьера активации.
- 24. Катализаторы изменяют скорости и прямой, и обратной реакций, но… не смещают равновесие!!! Достаточно легкого толчка, чтобы
- 25. Химическое равновесие
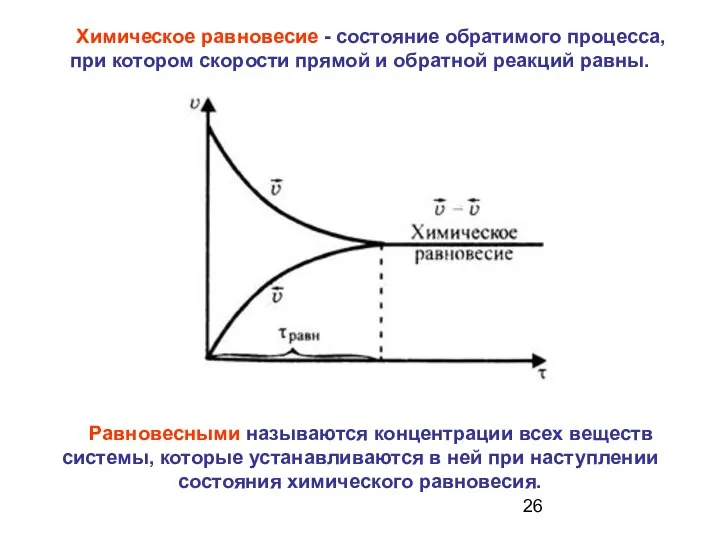
- 26. Химическое равновесие - состояние обратимого процесса, при котором скорости прямой и обратной реакций равны. Равновесными называются
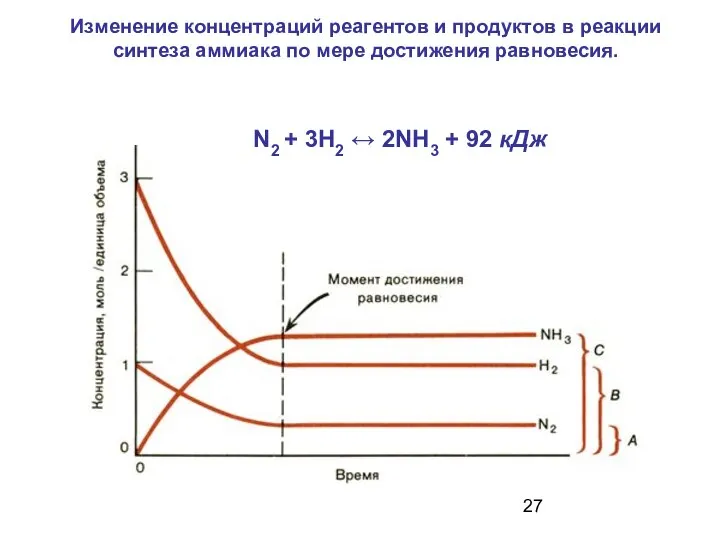
- 27. Изменение концентраций реагентов и продуктов в реакции синтеза аммиака по мере достижения равновесия. N2 + 3H2
- 28. Смещение химического равновесия
- 29. Смещение химического равновесия. Анри Ле-Шателье (8.10.1850 – 17.09.1936) Принцип Ле Шателье Если на систему, находящуюся в
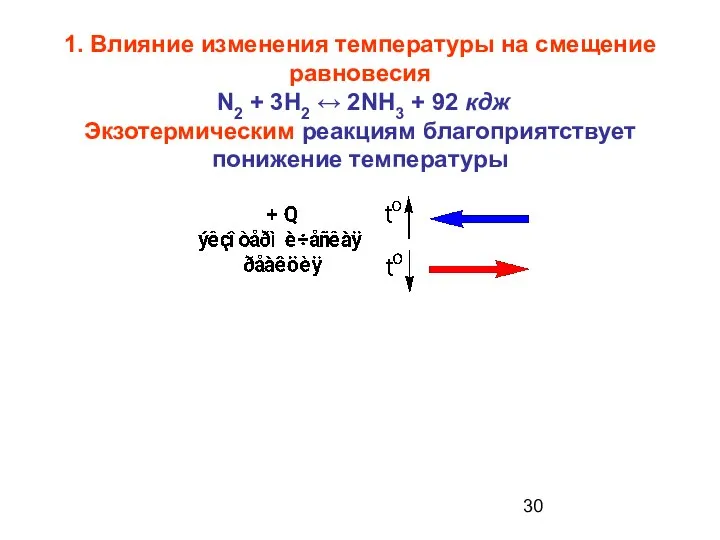
- 30. 1. Влияние изменения температуры на смещение равновесия N2 + 3H2 ↔ 2NH3 + 92 кдж Экзотермическим
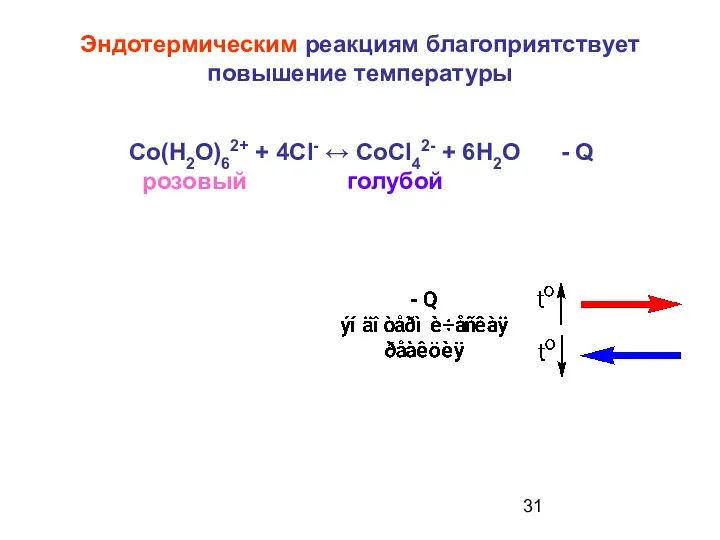
- 31. Со(Н2О)62+ + 4СI- ↔ СоСI42- + 6Н2О - Q розовый голубой Эндотермическим реакциям благоприятствует повышение температуры
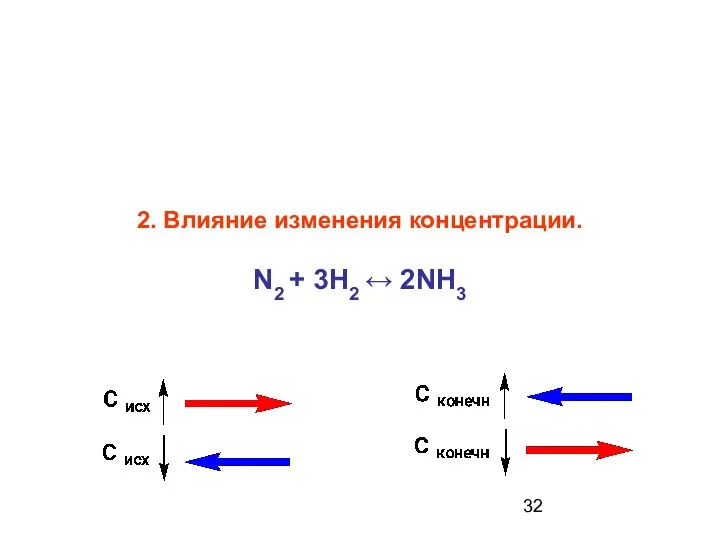
- 32. 2. Влияние изменения концентрации. N2 + 3H2 ↔ 2NH3
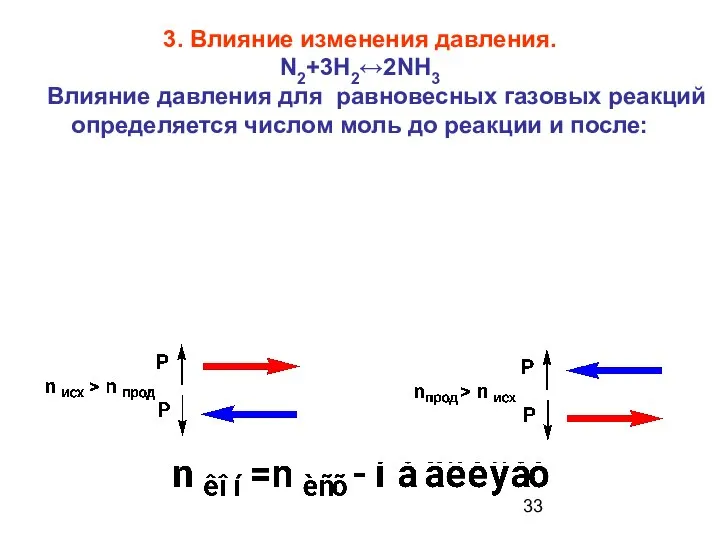
- 33. 3. Влияние изменения давления. N2+3H2↔2NH3 Влияние давления для равновесных газовых реакций определяется числом моль до реакции
- 34. Катализаторы изменяют скорости и прямой, и обратной реакций, но… не смещают равновесие!!! Задание 8 Реакцию, уравнение
- 35. Тест 18 Кинетика. Катализ, Химическое равновесие (один вариант ответа)
- 36. 1. Единица измерения скорости гомогенной химической реакции: 1) моль/л ∙ с 2) кмоль ∙ м3/ч 3)
- 37. 2. Скорость любой химической реакции зависит от: давления температуры площади соприкосновения реагирующих веществ всех вышеперечисленных факторов
- 38. 3. Во сколько раз изменится скорость реакции 2SО2 + О2 → 2SО3 при повышении давления в
- 39. 4. Через определенный промежуток времени после начала реакции 2СО2 + С → 2СО концентрация углекислого газа
- 40. 5. В реакции, схема которой 2А(г) + В(г) →C + D, концентрацию вещества А увеличили в
- 41. 6. Во сколько раз надо увеличить концентрацию кислорода в реакции, уравнение которой: 2SО2 + О2 →2SO3
- 42. 7. Константа скорости химической реакции не зависит: от природы реагирующих веществ от концентрации реагирующих веществ от
- 43. 8. В присутствии катализатора протекает реакция, уравнение которой: S + О2 → SО2 2H2S + SО2
- 44. 9. Температурный коэффициент реакции равен 3. Во сколько раз увеличится скорость реакции при повышении температуры на
- 45. 10. Температурный коэффициент реакции равен 2. На сколько градусов надо уменьшить температуру, чтобы скорость реакции уменьшилась
- 46. 11. При 30 °С химическая реакция протекает за 225 с. За какое время эта реакция завершится
- 47. 12. При 10°С реакция протекает за 8 мин, а при 60 °С— за 15 с. Температурный
- 48. 13. Обратимой является реакция, уравнение которой: NaOH + НСI → NaCI + Н2O Н2 + I2
- 49. 14. В реагирующей системе, уравнение которой 2NO(г) + СI2(г) ↔ 2NOCI (г) - Q, равновесие сместится
- 50. 15. Система, в которой повышение давления не вызовет смещения равновесия: 2NF3(г) + 3H2(г) ↔ 6HF(г) +
- 51. 16. Система, в которой повышение давления и повышение температуры приведут к смещению равновесия в противоположных направлениях:
- 52. 17. В реагирующей системе 2А + В ↔С + 2D исходная концентрация вещества А равна 4
- 53. 18. В реагирующей системе ЗА + В ↔ 2С + D, равновесные концентрации веществ равны: А
- 54. 19. В реагирующей системе A + 2B ↔ C + 3D исходные концентрации вещества А— 3
- 55. 20. В системе Н2 + Вr2 ↔ 2 НВr установилось равновесие, при котором концентрация Н2 равна
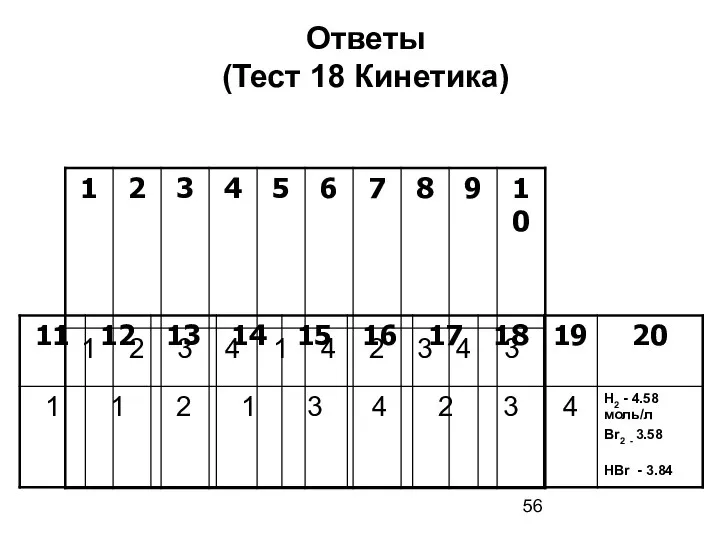
- 56. Ответы (Тест 18 Кинетика)
- 58. Скачать презентацию












































 Нефть и способы её переработки
Нефть и способы её переработки Доказательство амфотерности аминокислот. Продукты, содержащие аминокислоты и их соли
Доказательство амфотерности аминокислот. Продукты, содержащие аминокислоты и их соли Закономерности протекания химических реакций. Основы химической термодинамики. Лекция 6
Закономерности протекания химических реакций. Основы химической термодинамики. Лекция 6 Соединения кремния Силикатная промышленность.
Соединения кремния Силикатная промышленность. Минералы. Галенит
Минералы. Галенит Биохимия, наука о химических основах жизнедеятельности
Биохимия, наука о химических основах жизнедеятельности Сложные эфиры
Сложные эфиры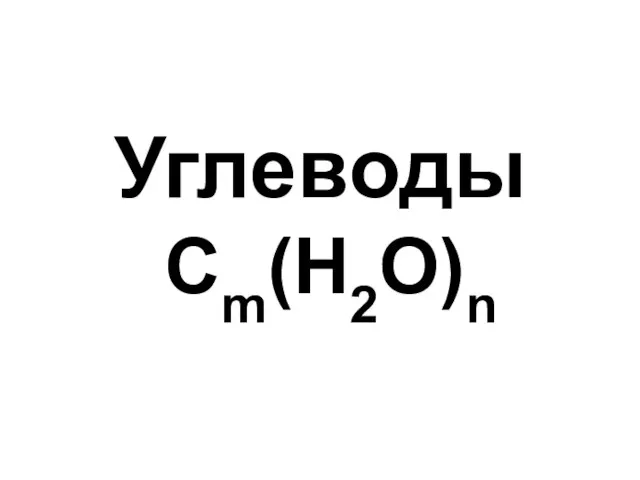 Углеводы. Моносахариды
Углеводы. Моносахариды Добування кисню та вивчення його властивостей
Добування кисню та вивчення його властивостей Химия ғажайыптар әлемі
Химия ғажайыптар әлемі Классификация органических соединений Химия. 10 класс
Классификация органических соединений Химия. 10 класс Типы первичных химических источников тока
Типы первичных химических источников тока Основы химической термодинамики
Основы химической термодинамики Мир стекла
Мир стекла МОУ «Средняя общеобразовательная школа с.3-я Александровка Калининского района Саратовской области» Презентация по химии «Мета
МОУ «Средняя общеобразовательная школа с.3-я Александровка Калининского района Саратовской области» Презентация по химии «Мета Підготував: учень 10-Б класу Федоренко Роман
Підготував: учень 10-Б класу Федоренко Роман  Тема урока : Скорость химической реакции
Тема урока : Скорость химической реакции  Получение меламина из карбамида
Получение меламина из карбамида Азотная кислота и ее свойства
Азотная кислота и ее свойства Органические загрязнители вод
Органические загрязнители вод Периодический закон и строение атома
Периодический закон и строение атома Вода: фізичні та хімічні властивості. Поширеність в природі
Вода: фізичні та хімічні властивості. Поширеність в природі Хлористый водород
Хлористый водород Коррозия металлов
Коррозия металлов Полимерные материалы и изделия
Полимерные материалы и изделия Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Презентация по Химии "Чипсы - вред или польза?" - скачать смотреть
Презентация по Химии "Чипсы - вред или польза?" - скачать смотреть  Тема урока: Составление химических формул бинарных соединений по степени окисления атомов
Тема урока: Составление химических формул бинарных соединений по степени окисления атомов