Содержание
- 2. Proteinele sunt substanţe macromoleculare organice cu structură polipeptidică, în care unităţile de bază le reprezintă cei
- 3. Astfel, mușchii conțin până la 80% proteină, splină, sânge, plămâni - 72% Piele - 63% ficat
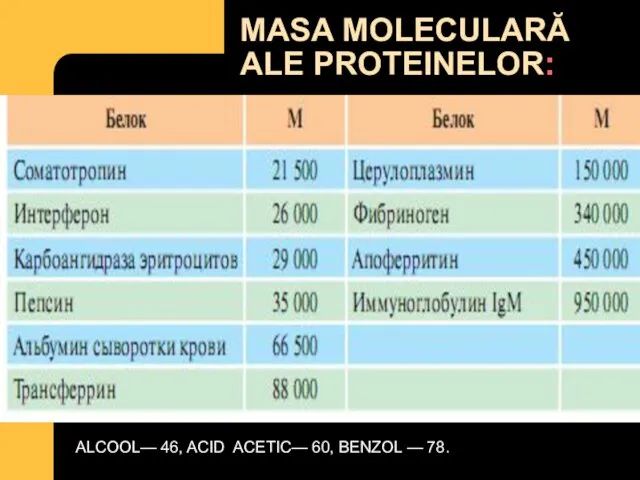
- 4. MASA MOLECULARĂ ALE PROTEINELOR: ALCOOL— 46, ACID ACETIC— 60, BENZOL — 78.
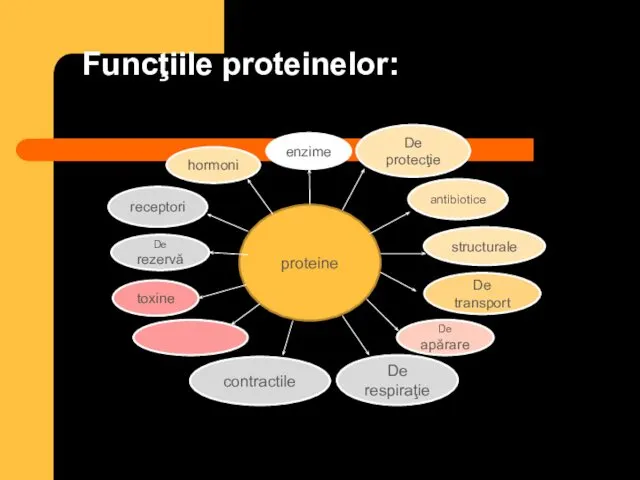
- 5. Funcţiile proteinelor: proteine enzime De protecţie antibiotice structurale contractile De apărare toxine De rezervă receptori hormoni
- 6. structural Keratina - proteina din epidermă, păr, pene, unghii, copite şi coarne se disting printr-un conţinut
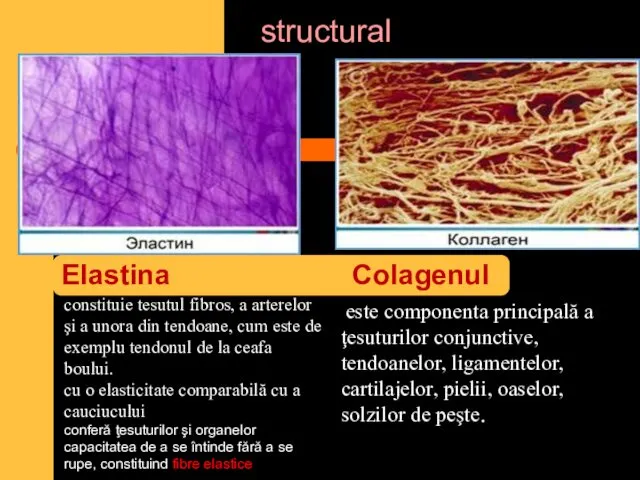
- 7. structural Elastina Colagenul este componenta principală a ţesuturilor conjunctive, tendoanelor, ligamentelor, cartilajelor, pielii, oaselor, solzilor de
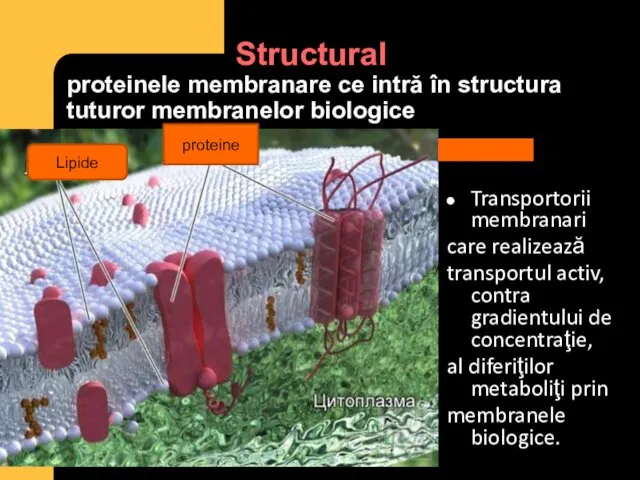
- 8. Structural proteinele membranare ce intră în structura tuturor membranelor biologice Transportorii membranari care realizează transportul activ,
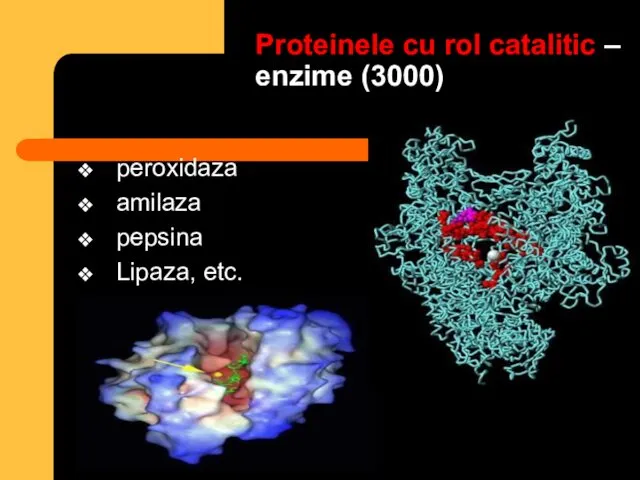
- 9. Proteinele cu rol catalitic – enzime (3000) peroxidaza amilaza pepsina Lipaza, etc.
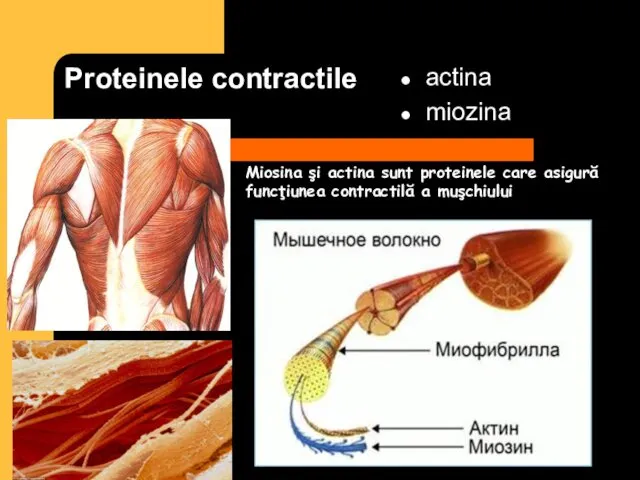
- 10. Proteinele contractile actina miozina Miosina şi actina sunt proteinele care asigură funcţiunea contractilă a muşchiului
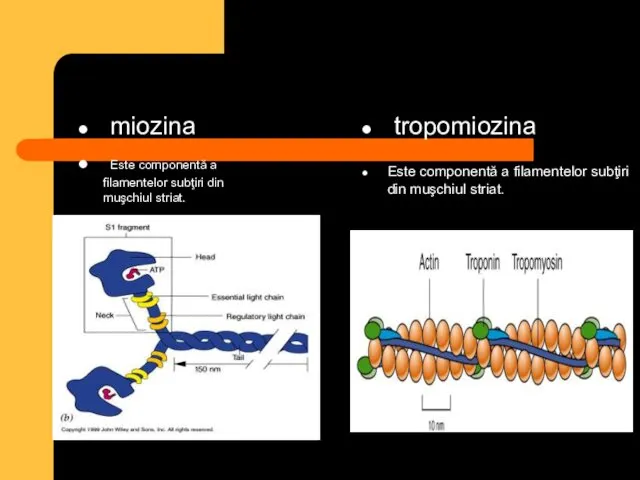
- 11. miozina Este componentă a filamentelor subţiri din muşchiul striat. tropomiozina Este componentă a filamentelor subţiri din
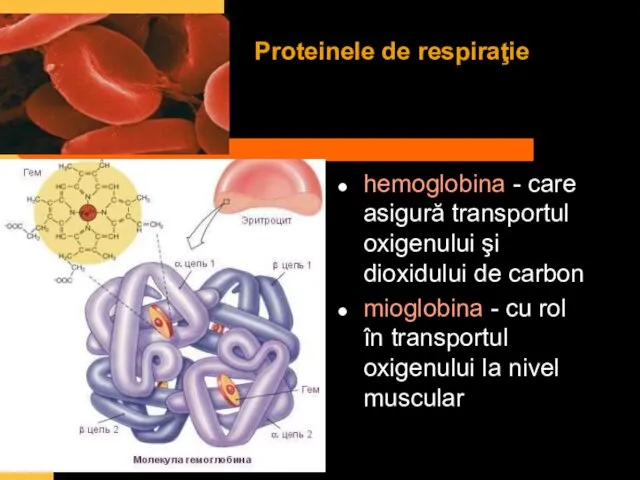
- 12. Proteinele de respiraţie hemoglobina - care asigură transportul oxigenului şi dioxidului de carbon mioglobina - cu
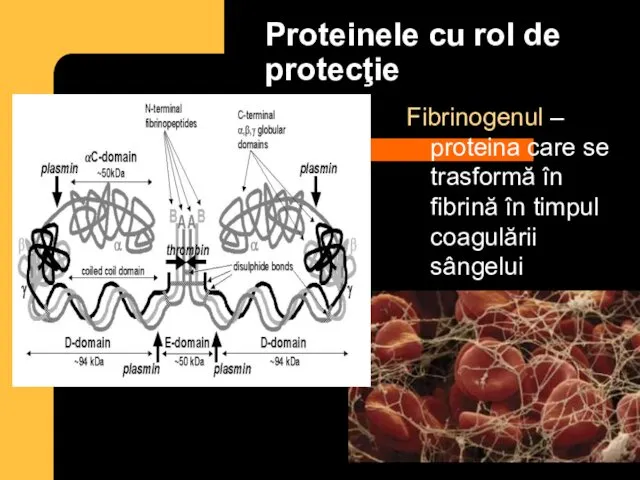
- 13. Proteinele cu rol de protecţie Fibrinogenul – proteina care se trasformă în fibrină în timpul coagulării
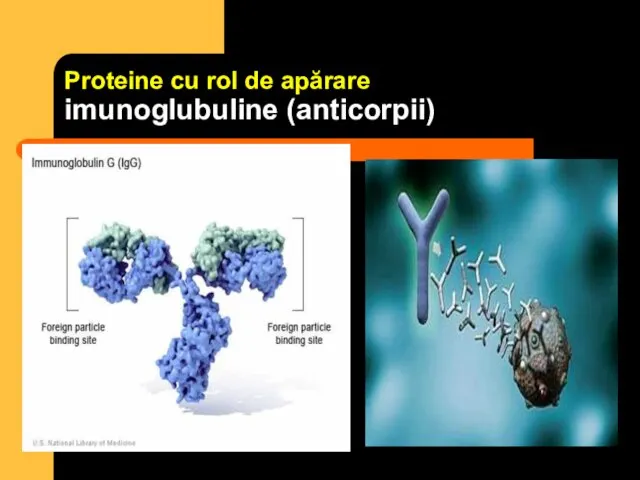
- 14. Proteine cu rol de apărare imunoglubuline (anticorpii)
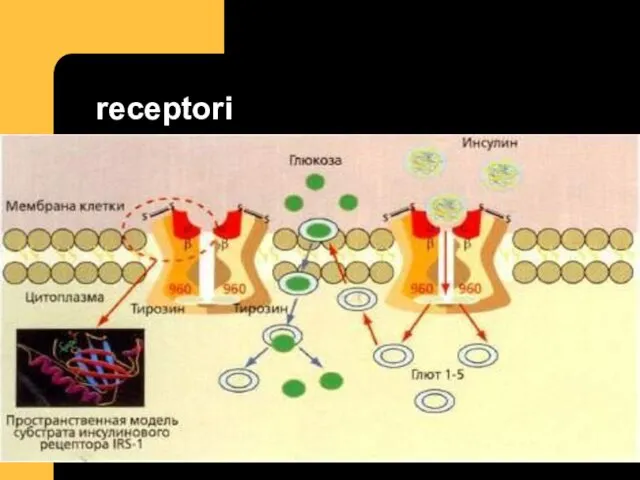
- 15. receptori
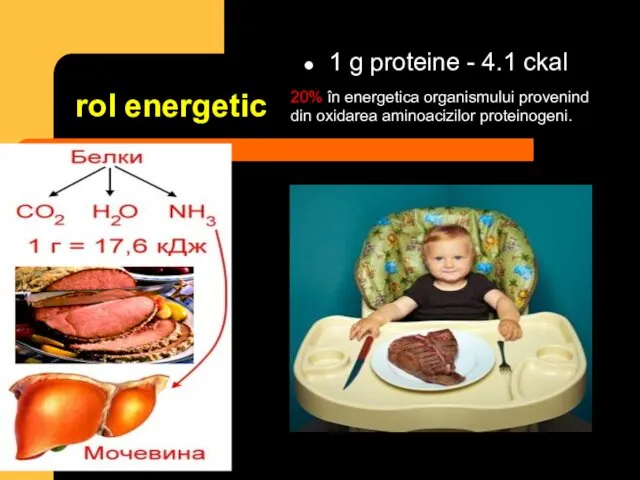
- 16. rol energetic 1 g proteine - 4.1 ckal 20% în energetica organismului provenind din oxidarea aminoacizilor
- 17. informaţional ADN- acid dezoxiribonucleic exprimarea informaţiei genelor necesită activitatea unui mare număr de proteine care cooperează
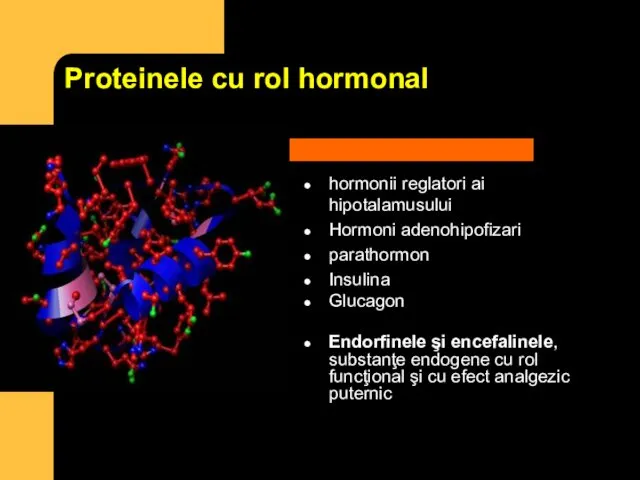
- 18. Proteinele cu rol hormonal hormonii reglatori ai hipotalamusului Hormoni adenohipofizari parathormon Insulina Glucagon Endorfinele şi encefalinele,
- 19. Peptidele antibiotice sunt produse de microorganisme. Au o structură peptidică, deseori ciclică şi pot conţine şi
- 20. toxinele Nefrotoxinele Toxinele hemolitice Neurotoxinele Miotoxinele Cardiotoxinele Ciupercă Pale conține: a -amanitin 5-7 mg, faloidină 20-30
- 21. Proteinele de rezervă Cazeina şi lactalbumina din lapte Ovalbumina din ouă
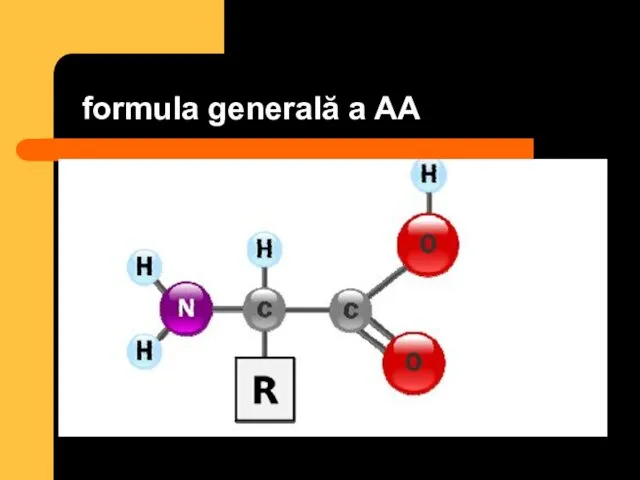
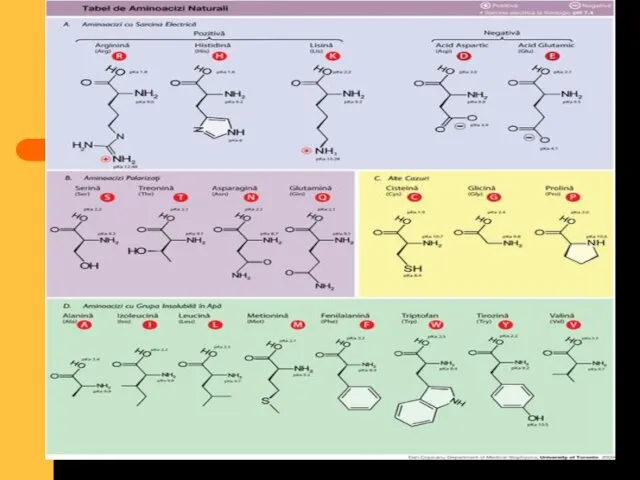
- 22. formula generală a AA
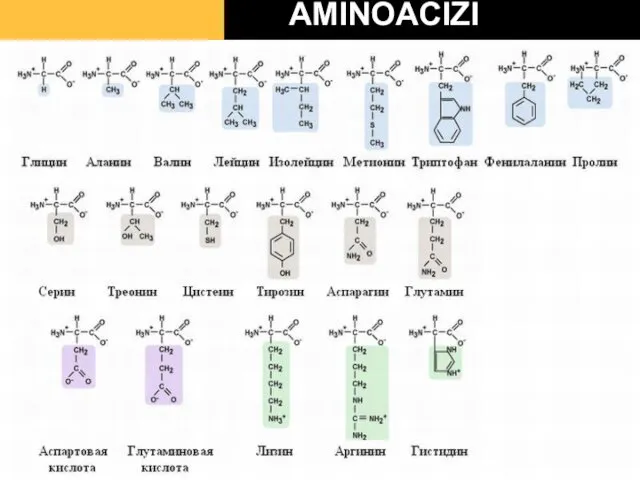
- 23. AMINOACIZI
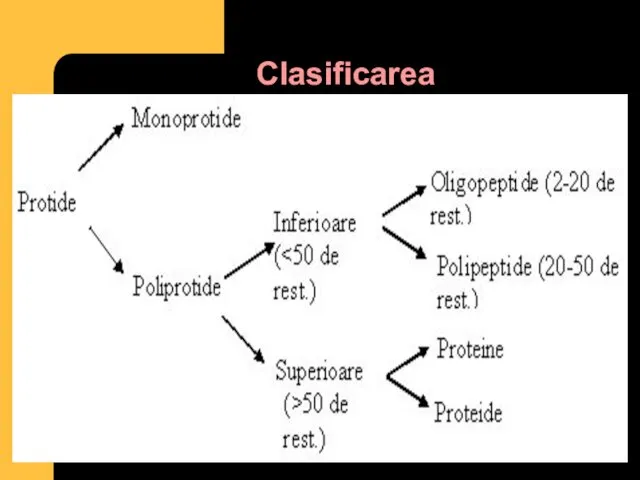
- 25. Clasificarea
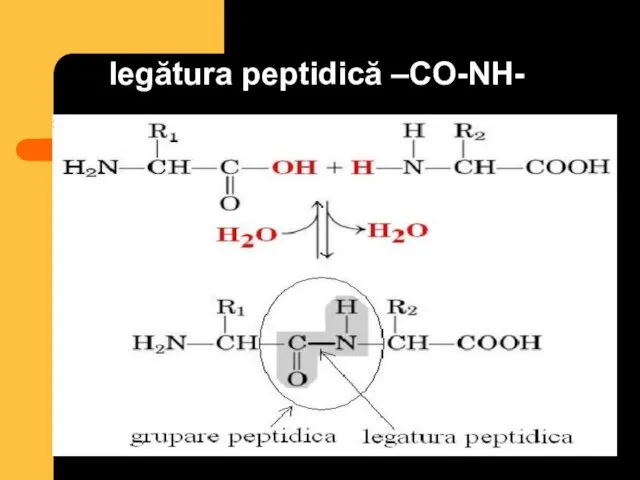
- 26. legătura peptidică –CO-NH-
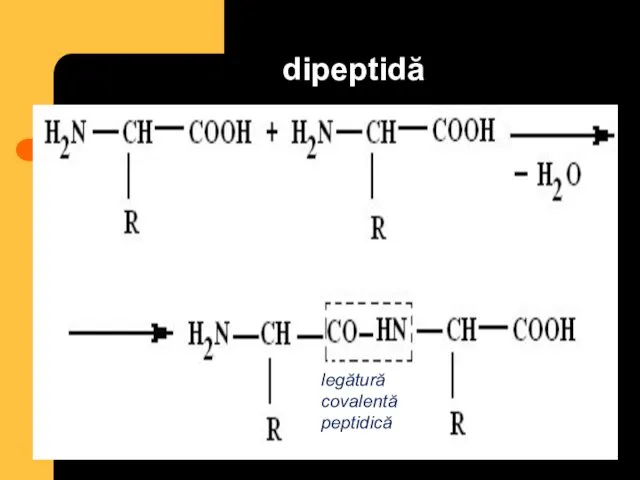
- 27. dipeptidă legătură covalentă peptidică
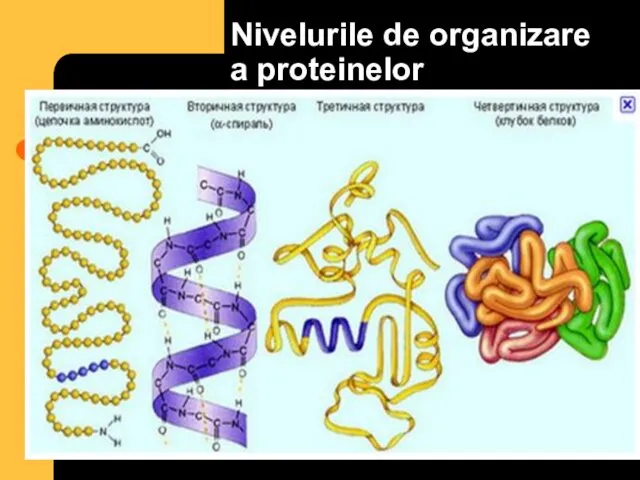
- 28. Nivelurile de organizare a proteinelor
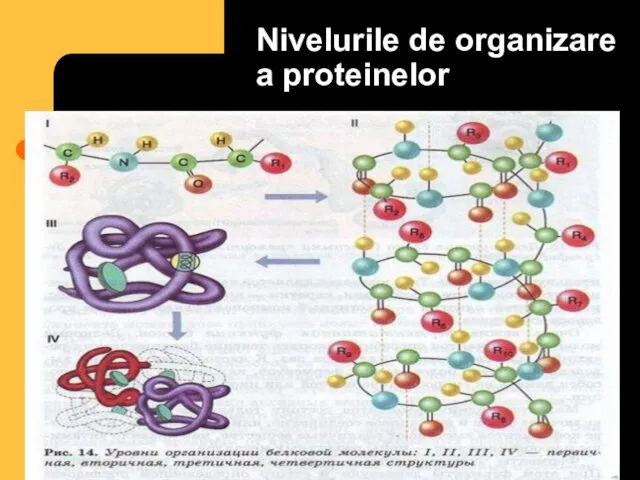
- 29. Nivelurile de organizare a proteinelor
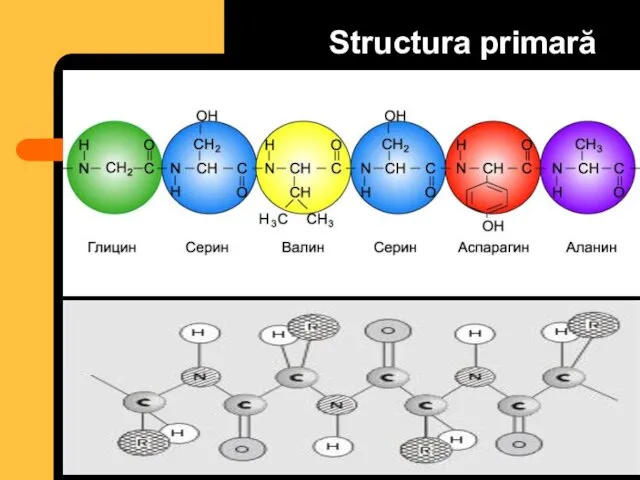
- 30. Structura primară
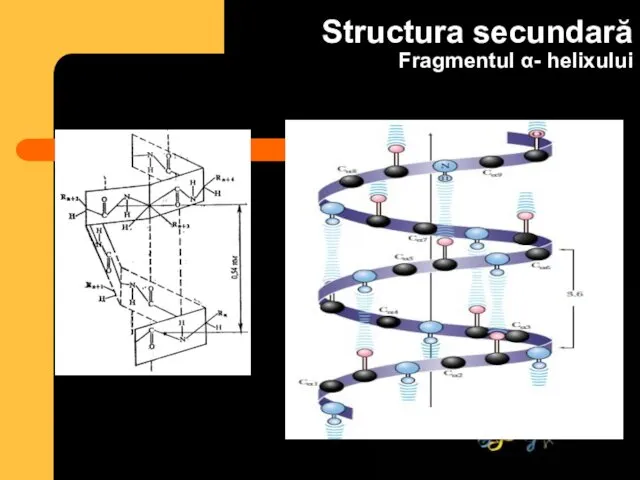
- 31. Structura secundară Fragmentul α- helixului
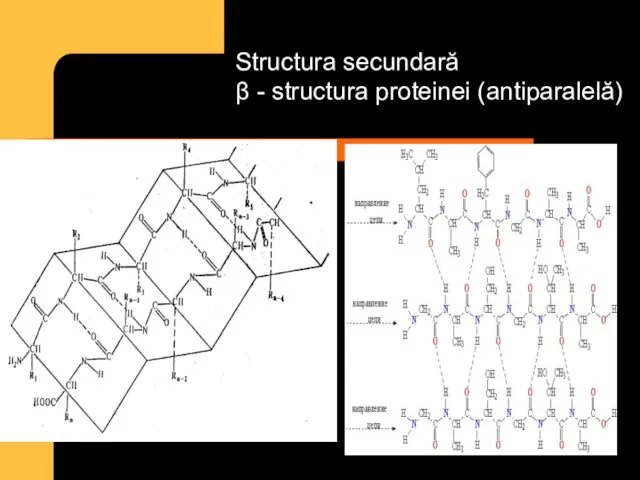
- 32. Structura secundară β - structura proteinei (antiparalelă)
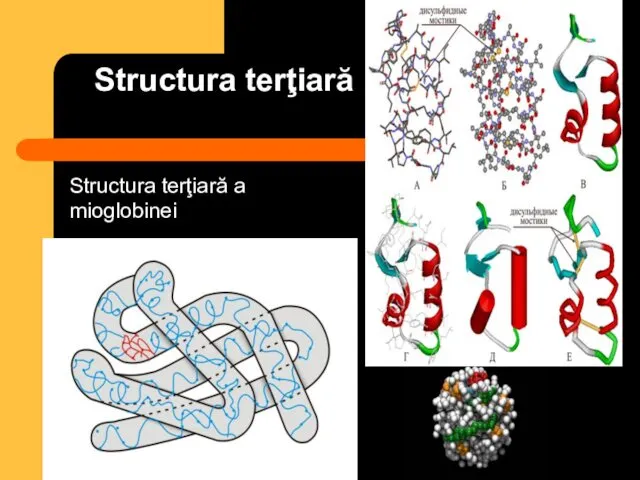
- 33. Structura terţiară Structura terţiară a mioglobinei
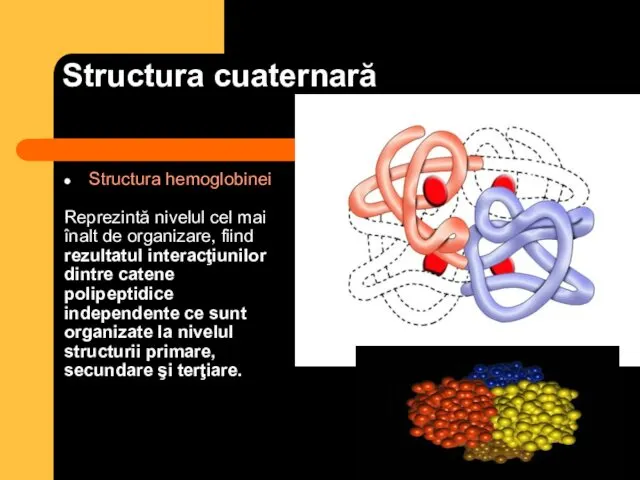
- 34. Structura cuaternară Structura hemoglobinei Reprezintă nivelul cel mai înalt de organizare, fiind rezultatul interacţiunilor dintre catene
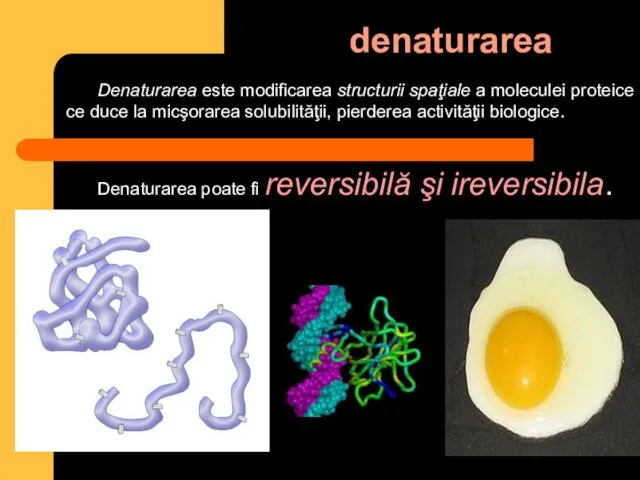
- 35. denaturarea Denaturarea este modificarea structurii spaţiale a moleculei proteice ce duce la micşorarea solubilităţii, pierderea activităţii
- 36. renaturarea Proteina poate să se renatureze. Acest lucru necesită o expunere foarte scurtă la agenți
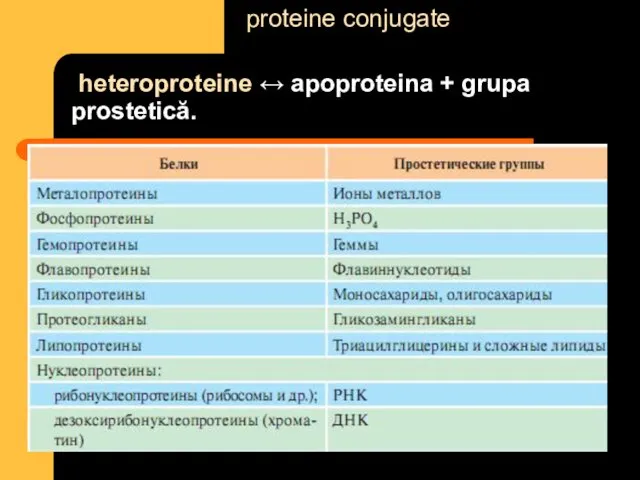
- 37. Clasificarea proteinelor proteine simple (holoproteine;proteine) Albuminele Globulinele Prolaminele (sau gliadinele) Protaminele Histonele Glutelinele Scleroproteinele proteine conjugate
- 38. heteroproteine ↔ apoproteina + grupa prostetică. proteine conjugate
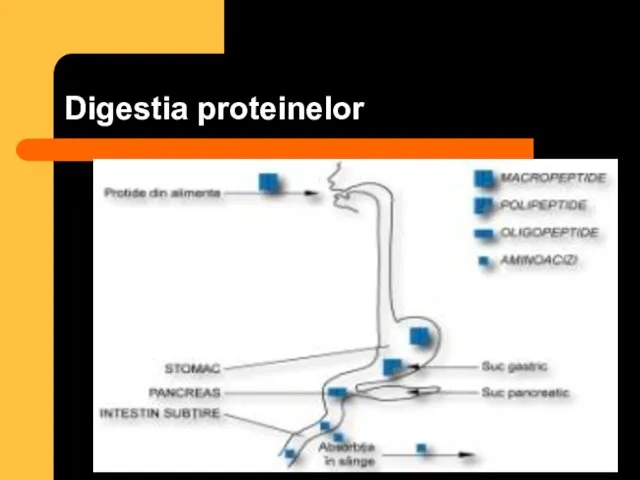
- 39. Digestia proteinelor
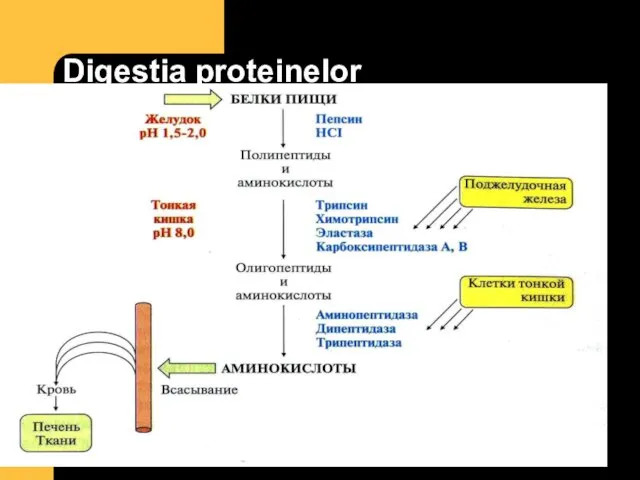
- 40. Digestia proteinelor
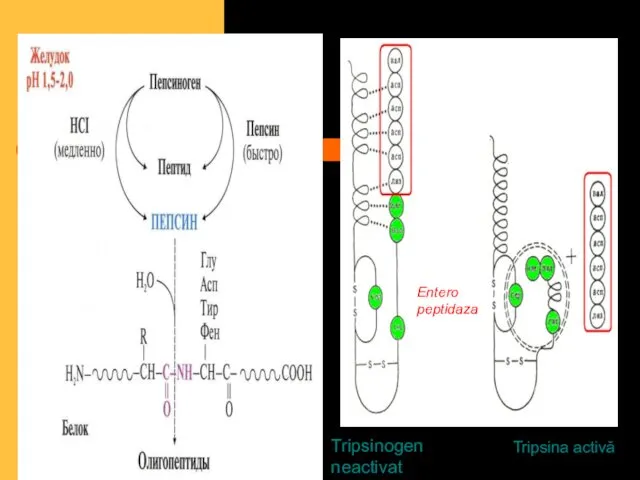
- 42. Enzime proteolitice ale sucului gastric Pepsina gastrixina renina (sugari).
- 43. Entero peptidaza Tripsina activă Tripsinogen neactivat
- 44. Enzimele proteolitice ale sucului pancretic tripsina (endopeptidaza), chimotripsina (endopeptidaza), elastaza (endopeptidaza), carboxipeptidaza (exopeptidaza).
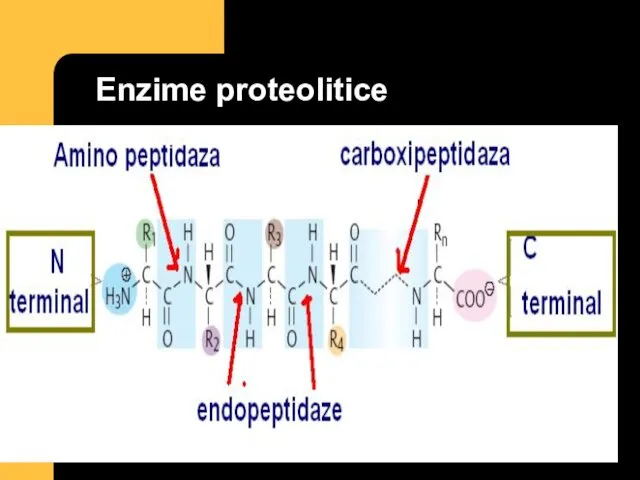
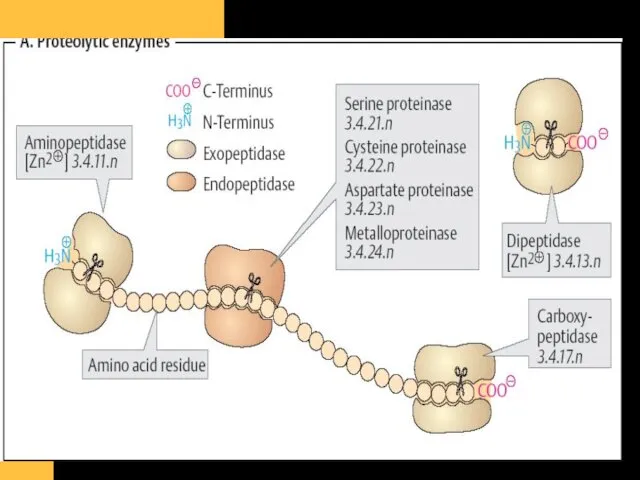
- 45. Enzime proteolitice
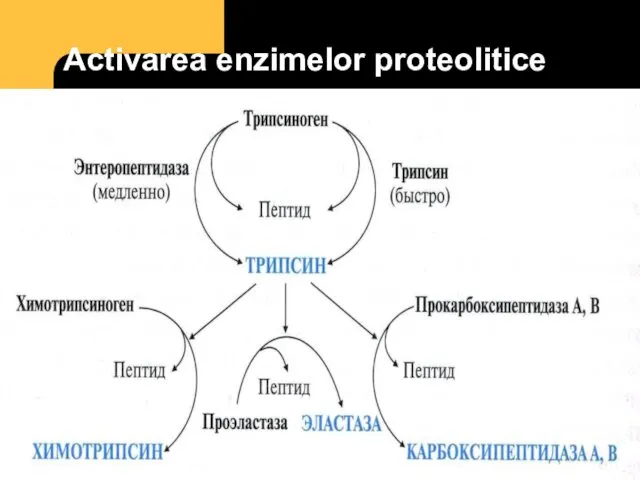
- 47. Activarea enzimelor proteolitice
- 48. Absorbţia are loc la nivelul intestinului subţire este un proces activ cu solicitare de energie, cuplat
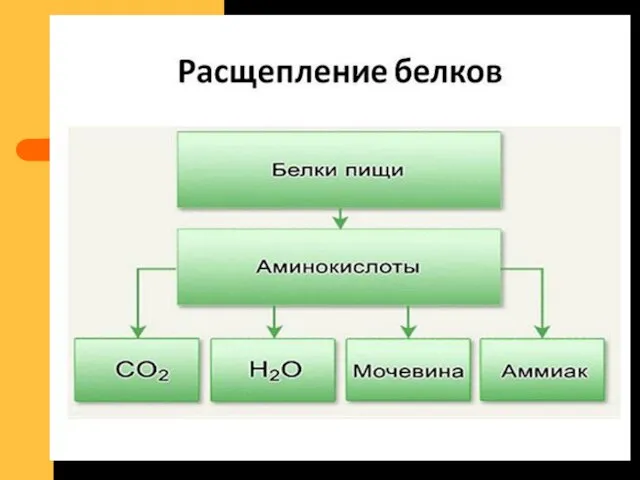
- 49. Putrefacţia AA în intestin O parte din AA alimentelor este scindată de E microflorei intestinale, ce
- 50. Ornitina şi Lys se decarboxilează cu formarea aminelor - putrescina şi cadaverina.
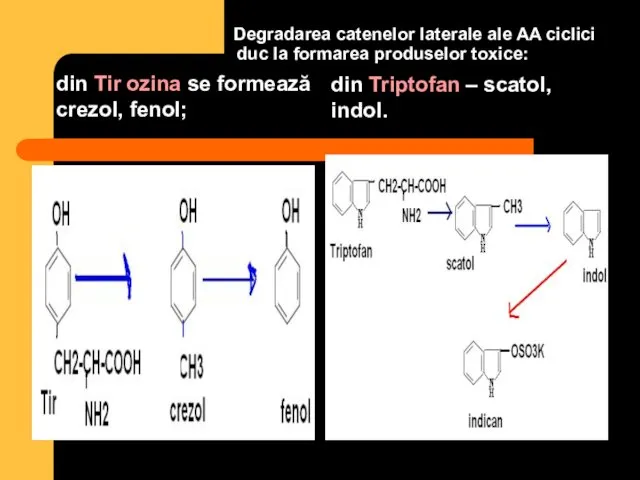
- 51. Degradarea catenelor laterale ale AA ciclici duc la formarea produselor toxice: din Tir ozina se formează
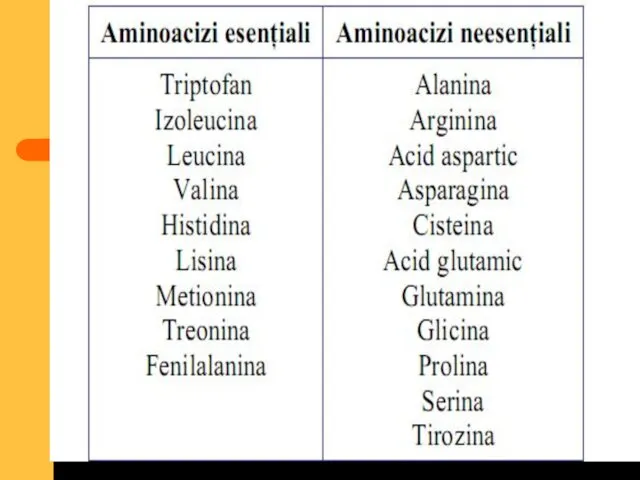
- 52. În organismul uman sunt 20 feluri de aminoacizi care se împart în două grupe: Neesenţiali -care
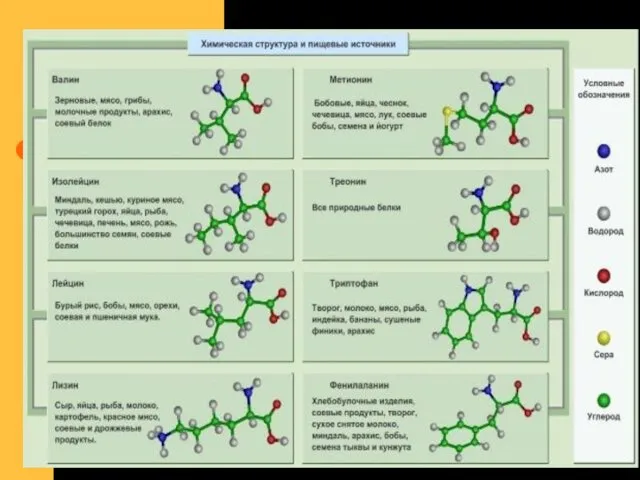
- 54. Valina Leucina Izoleucina Lizina Metionina Treonina Fenialanina triptofanul Aceşti aminoacizi esenţiali sunt: Semiesenţiali: Arginina histidina
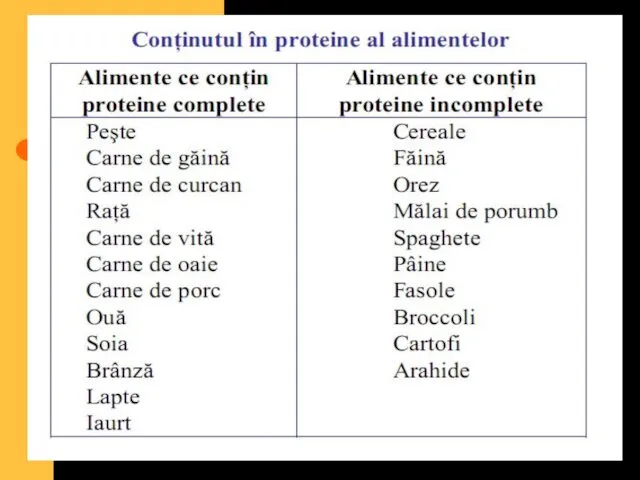
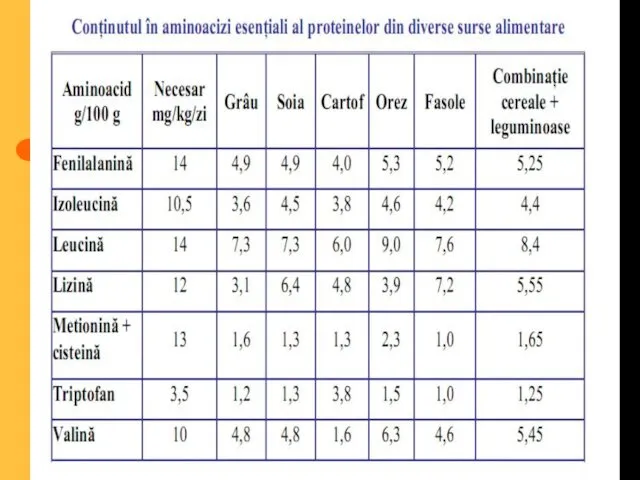
- 56. valoare biologică a proteinelor Proteinele ce conţin tot setul de aminoacizi esenţiali se numesc proteine cu
- 59. Bilanţul azotat este cantitatea de azot introdusă în organism raportată la cantitatea de azot eliminată din
- 60. tipuri de bilanţ azotat: Echilibru azotat Bilanţul azotat negativ Bilanţ azotat pozitiv
- 61. tipuri de bilanţ azotat: Echilibru azotat – cantitatea de azot introdus este egal cu cantitatea de
- 62. Bilanţul azotat negativ cand Ni – cantitatea de azot introdus este mai mică ca cantitatea de
- 63. Reglarea metabolismului proteic Somatotropul măreşte sinteza proteinelor în toate celulele organismului; creşte transportul aminoacizilor prin membrana
- 64. Reglarea metabolismului proteic Tiroxina şi triiodtironina: la copii asigură creşterea şi diferenţierea ţesuturilor mărind sinteza proteică;
- 65. Reglarea metabolismului proteic Glucocorticoizii (cortizolul) măreşte sinteza proteinelor în ficat; scade transportul de aminoacizi în celulă;
- 66. Reglarea metabolismului proteic Testosteron creşte sinteza proteinelor, ca rezultat creşte masa musculară. Insulina inhibă catabolismul proteinelor;
- 67. Căile generale de catabolizare pot fi divizate în următoarele grupe: Dezaminarea. Transaminarea Decarboxilarea Aminoacizii utilizati ca
- 68. Dezaminarea – scindarea grupelor NH2 din poziţia α ale AA sub formă de NH3 Dezintegrarea proteinelor
- 69. Sunt 4 tipuri de dezaminare: reductivă +2H R-CH-COOH -----→ R-CH2-COOH + NH3 ׀ NH2 hidrolitică +H2O
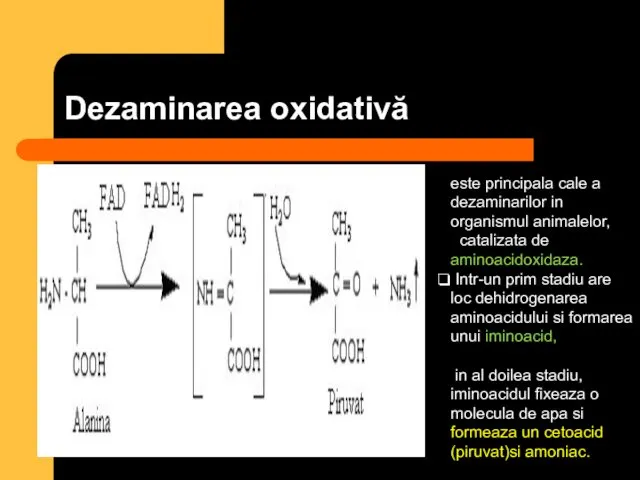
- 70. Dezaminarea oxidativă este principala cale a dezaminarilor in organismul animalelor, catalizata de aminoacidoxidaza. Intr-un prim stadiu
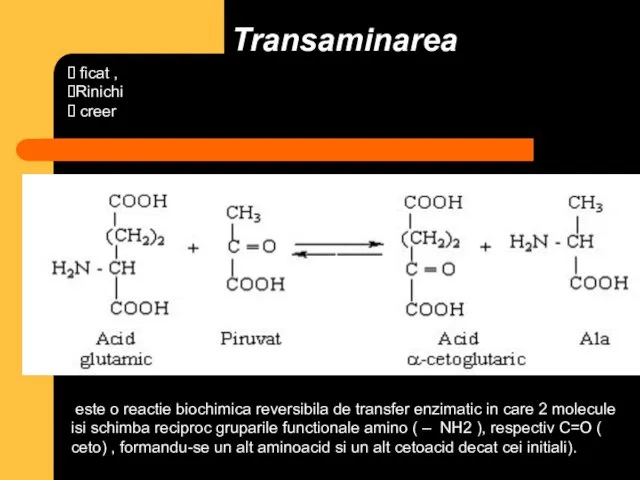
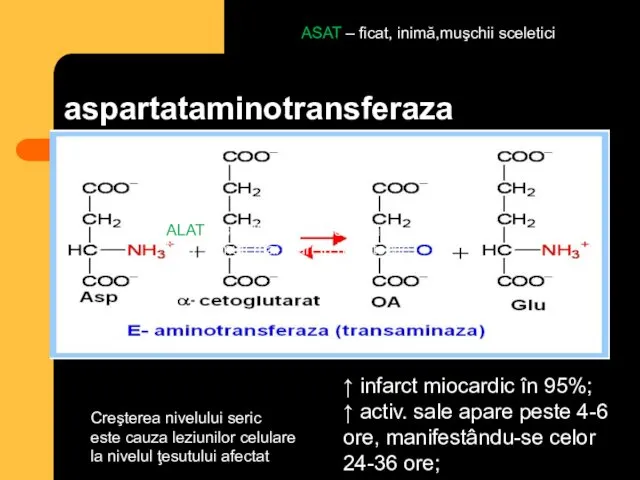
- 71. Transaminarea este transferul aminogrupei de la orice AA la α-cetoacid, cu formarea unui nou AA şi
- 72. Transaminarea este o reactie biochimica reversibila de transfer enzimatic in care 2 molecule isi schimba reciproc
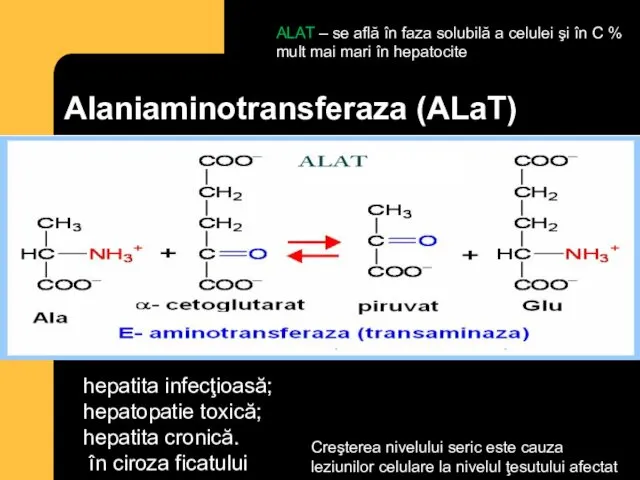
- 73. Alaniaminotransferaza (ALaT) ALAT – se află în faza solubilă a celulei şi în C % mult
- 74. aspartataminotransferaza ASAT – ficat, inimă,muşchii sceletici ALAT – se află în faza solubilă a celulei şi
- 75. Soarta α cetoacizilor rezultaţi din AA Biosinteza AA dispensabili-transreaminare (sinteza AA din α cetoacizii corespunzători) Biosinteza
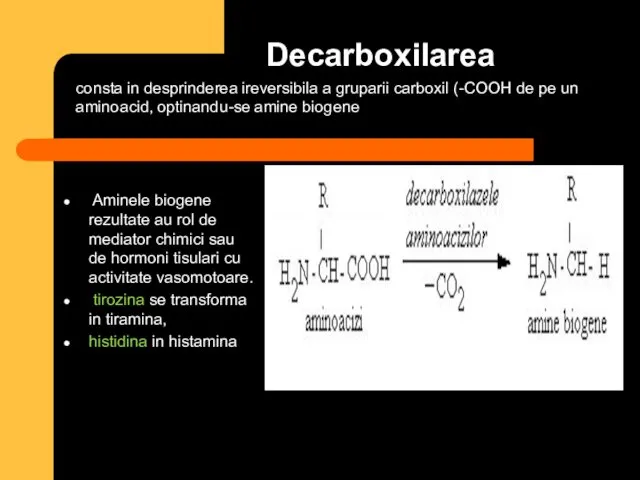
- 76. Decarboxilarea Aminele biogene rezultate au rol de mediator chimici sau de hormoni tisulari cu activitate vasomotoare.
- 77. Serotonina – mediator chimic, vasoconstrictor: la reglarea TA t corpului Respiraţiei filtraţiei renale este mediator al
- 78. NH3 se formează în următoarele procese: dezaminarea AA; detoxifierea aminelor biogene; degradarea BA purinice şi pirimidinice;
- 79. Amoniacul (NH3) rezultat din dezaminarea aminoacizilor sau in urma fermentaţiilor microbiene este toxic pentru celule, in
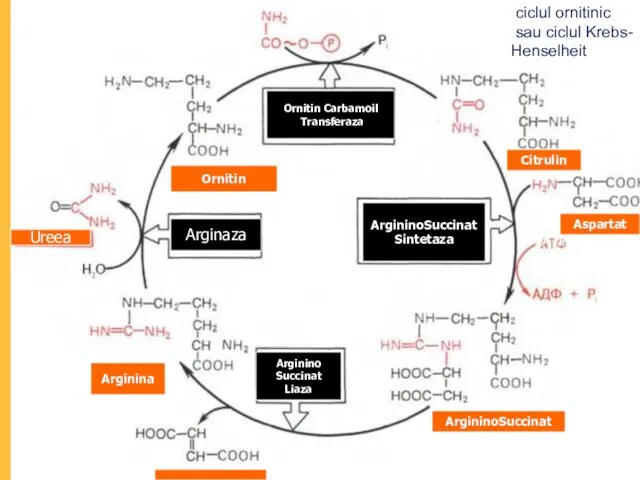
- 80. UROGENEZA- Formarea ureiei are loc in ficat si in rinichi (intr-o proporţie redusă) constă in sinteza
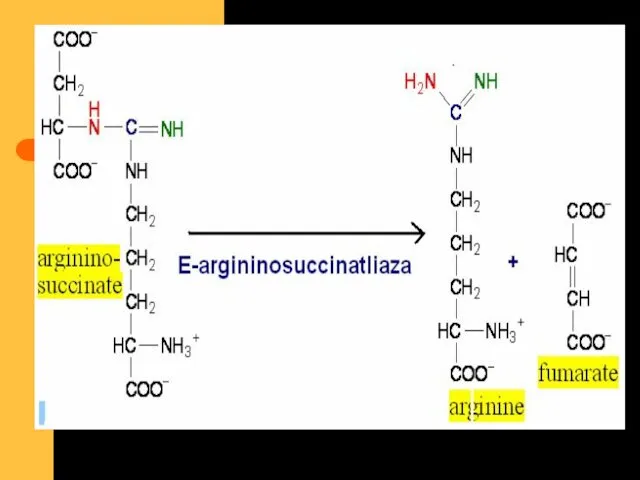
- 81. ArgininoSuccinat Sintetaza Arginaza Arginino Succinat Liaza Ornitin Carbamoil Transferaza Arginina ArgininoSuccinat Citrulin Ornitin Aspartat Ureea ATP
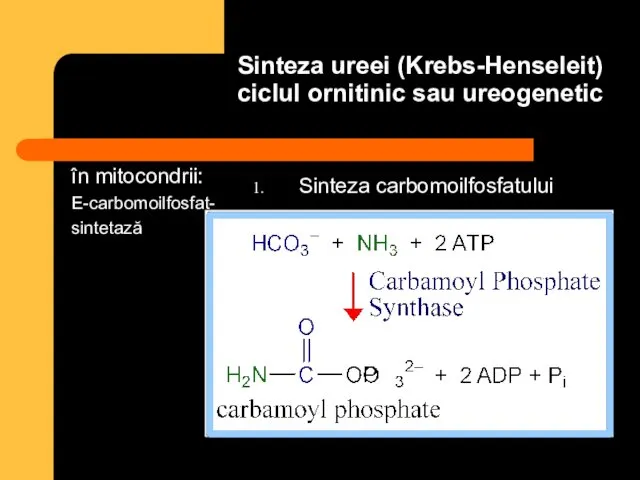
- 82. Sinteza ureei (Krebs-Henseleit) ciclul ornitinic sau ureogenetic în mitocondrii: E-carbomoilfosfat- sintetază Sinteza carbomoilfosfatului
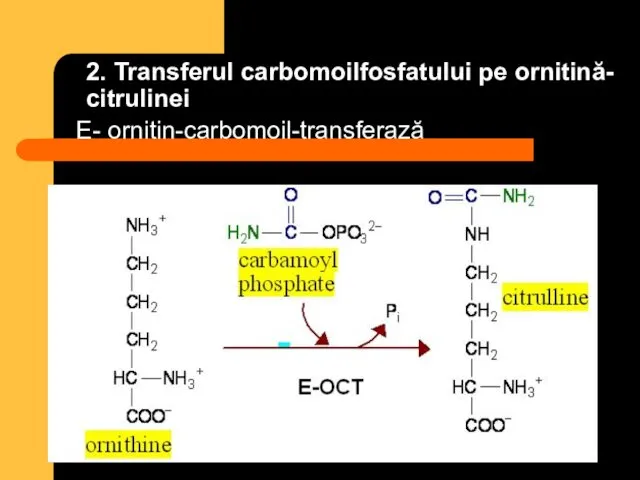
- 83. 2. Transferul carbomoilfosfatului pe ornitină- citrulinei E- ornitin-carbomoil-transferază
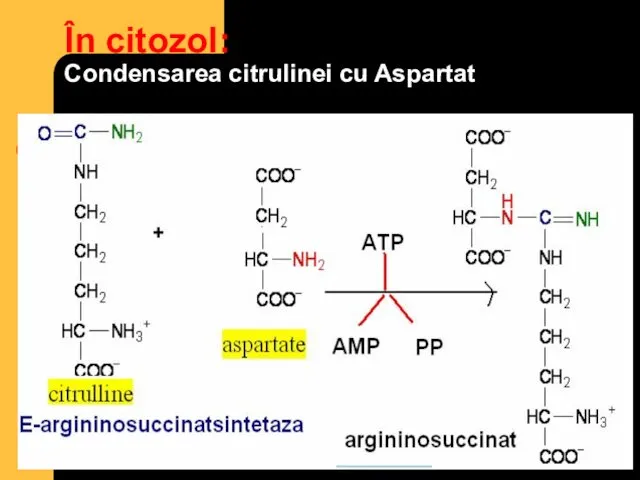
- 84. În citozol: Condensarea citrulinei cu Aspartat
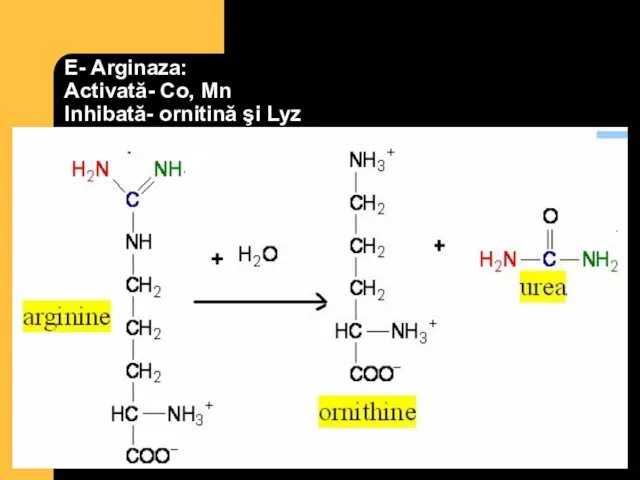
- 86. E- Arginaza: Activată- Co, Mn Inhibată- ornitină şi Lyz
- 88. Скачать презентацию

































 Article review. Getting a two-component cold-cast products in polyurethane silicone mold in a vacuum
Article review. Getting a two-component cold-cast products in polyurethane silicone mold in a vacuum Биохимия крови
Биохимия крови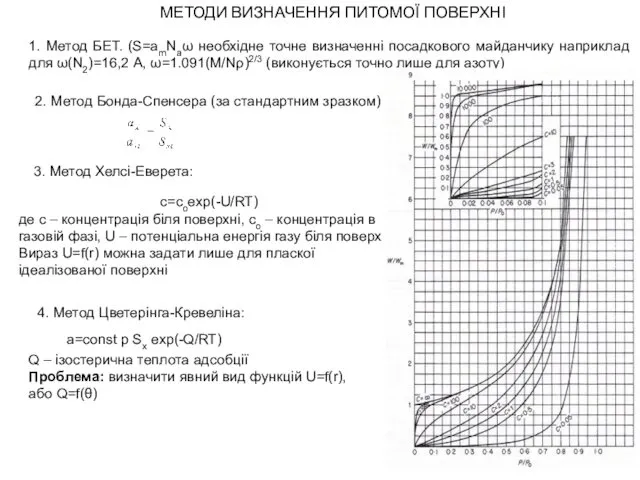 Методи визначення питомої поверхні
Методи визначення питомої поверхні Формирование и развитие системы знаний о химической реакции
Формирование и развитие системы знаний о химической реакции Составил: учитель химии Составил: учитель химии МОУ «Бурханкульская ООШ» Кулешова С.Е.
Составил: учитель химии Составил: учитель химии МОУ «Бурханкульская ООШ» Кулешова С.Е. Антидиабеттік қауынқұрттың реологиялық қасиетін анықтау
Антидиабеттік қауынқұрттың реологиялық қасиетін анықтау Періодична система
Періодична система  Углерод Carboneum происходит от лат. carbo — уголь.
Углерод Carboneum происходит от лат. carbo — уголь. Карбоновые кислоты
Карбоновые кислоты Значение периодического закона и периодической системы Д.И. Менделеева
Значение периодического закона и периодической системы Д.И. Менделеева Оксиды
Оксиды Основания. Гидроксид алюминия
Основания. Гидроксид алюминия Продолжи предложение Диссимиляция-…
Продолжи предложение Диссимиляция-… Титриметрический анализ. Сущность титриметрического анализа
Титриметрический анализ. Сущность титриметрического анализа Формы кристаллов и агрегаты
Формы кристаллов и агрегаты Полифункциональные органические соединения
Полифункциональные органические соединения Основы кристаллического строения. Лекция 1
Основы кристаллического строения. Лекция 1 Технология мясопродуктов, обогащенных полиненасыщенными жирными кислотами
Технология мясопродуктов, обогащенных полиненасыщенными жирными кислотами Органические вяжущие материалы
Органические вяжущие материалы Cellulase. Introduction (source)
Cellulase. Introduction (source) Тема 1. Обработка вооружения, техники и обмундирования. Дегазирующие, дезактивирующие и дезинфицирующие вещества и растворы
Тема 1. Обработка вооружения, техники и обмундирования. Дегазирующие, дезактивирующие и дезинфицирующие вещества и растворы Тема: Липиды Задачи: Изучить строение, свойства и функции липидов в клетке.
Тема: Липиды Задачи: Изучить строение, свойства и функции липидов в клетке.  Общая характеристика элементов VIA-группы (халькогены). Сера. Кислород
Общая характеристика элементов VIA-группы (халькогены). Сера. Кислород СЕРОЛОГИЧЕСКИЕ РЕАКЦИИ
СЕРОЛОГИЧЕСКИЕ РЕАКЦИИ  Презентация по Химии "Синтез сложных эфиров" - скачать смотреть
Презентация по Химии "Синтез сложных эфиров" - скачать смотреть  Аттестационная работа. Методическая разработка исследователького урока «Строение вещества. Молекулы и атомы»
Аттестационная работа. Методическая разработка исследователького урока «Строение вещества. Молекулы и атомы» Введение в геохимию
Введение в геохимию Аналитическая химия. Количественный анализ
Аналитическая химия. Количественный анализ