Содержание
- 2. План 1. Количественный анализ в аналитической химии. Сущность гравиметрического метода. Основные операции в гравиметрическом методе. Осадитель
- 3. 1. Количественный анализ. Задачи и методы количественного анализа Раздел аналитической химии, изучающий методы определения количественного содержания
- 4. Гравиметрический анализ Гравиметрический анализ – метод количественного химического анализа, который базируется на точном измерении массы определяемого
- 5. Методы гравиметрического анализа Метод осаждения – это метод гравиметрического анализа, который базируется на измерении точной массы
- 6. Осаждаемая и гравиметрическая формы Соединение, которое осаждается из раствора при взаимодействии определяемого компонента с реагентом-осадителем, называется
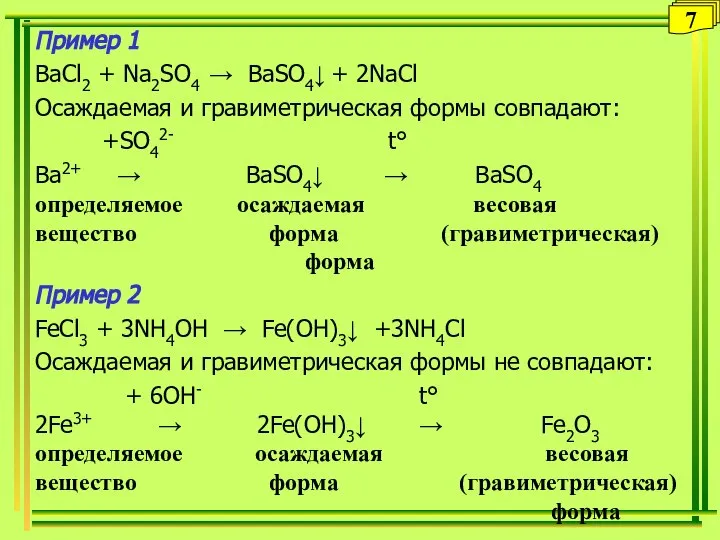
- 7. Пример 1 BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl Осаждаемая и гравиметрическая формы совпадают: +SO42- t°
- 8. Требования к осадителю Качество осадка находится в зависимости от свойств осадителя. Желательно, чтобы осадитель был веществом
- 9. Требования к осаждаемой форме Осаждаемая форма должна обладать достаточно низкой растворимостью. Осадок должен быть по возможности
- 10. Схема анализа и главные операции метода осаждения отбор средней пробы вещества и подготовка ее к анализу
- 11. П.2. Расчеты в гравиметрическом анализе. Фактор пересчета Расчет навески и массовой доли анализируемого вещества где g
- 12. Преимущества и недостатки гравиметрического анализа 12
- 13. 3. Растворимость соединений. Произведение растворимости. Насыщенный и ненасыщенные растворы. Условия выпадения осадка. Произведение растворимости и растворимость
- 14. Растворимость (L), моль/л МхАу(т) х Ма+ + у Аb– [Ma+] = x L; [Ab–] = y
- 15. Условия выпадения и растворения осадка. Насыщенные и ненасыщенные растворы 15 Условия выпадения осадка: ПК > ПР,
- 16. П.4. Решение задач на произведение растворимости Задача Рассчитать растворимость сульфата серебра, если ПР(Ag2SO4) = 1,2 .
- 17. Посуда и оборудование в гравиметрическом анализе. Весы аналитические 17
- 18. Осаждение 18
- 19. Фильтрование 19
- 20. Фильтрование 20
- 21. Гравиметрическая форма (после прокаливания) 21
- 22. 22
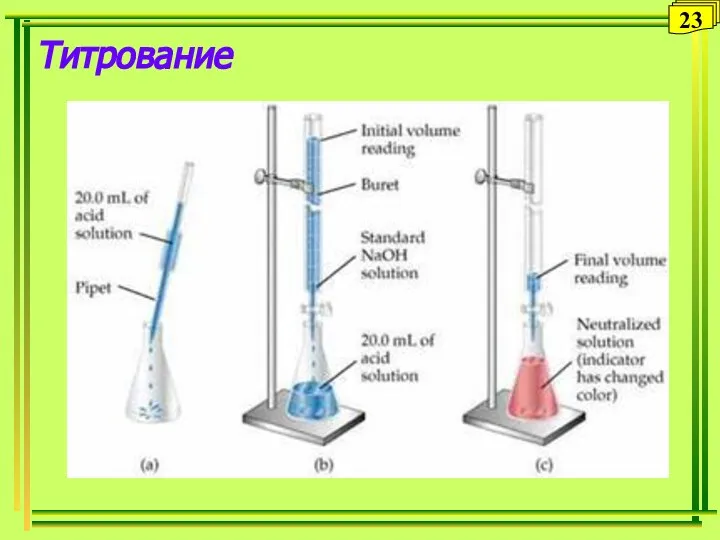
- 23. Титрование 23
- 25. Скачать презентацию











![Растворимость (L), моль/л МхАу(т) х Ма+ + у Аb– [Ma+] =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1330584/slide-13.jpg)







 Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады) Хлор
Хлор Подготовка к ГИА. В1. Периодический закон Д.И. Менделеева
Подготовка к ГИА. В1. Периодический закон Д.И. Менделеева Начала физической химии
Начала физической химии Гетероароматичность. Пятичленные гетероциклы с одним гетероатомом. (Лекция 2)
Гетероароматичность. Пятичленные гетероциклы с одним гетероатомом. (Лекция 2) Классификация дисперсных систем. Коллигативные свойства растворов. Растворимость газов в воде. Термодинамика
Классификация дисперсных систем. Коллигативные свойства растворов. Растворимость газов в воде. Термодинамика Аммиак. Физические и химические свойства аммиака
Аммиак. Физические и химические свойства аммиака Ароматические соединения. Лекция 10
Ароматические соединения. Лекция 10 Устойчивость и резистентность вредных организмов к пестицидам и пути ее преодоления. (Лекция 4)
Устойчивость и резистентность вредных организмов к пестицидам и пути ее преодоления. (Лекция 4) Презентация по Химии "Кинетика химических реакций.Химическое равновесие" - скачать смотреть
Презентация по Химии "Кинетика химических реакций.Химическое равновесие" - скачать смотреть  Характеристика химического элемента
Характеристика химического элемента Оксиды азота.
Оксиды азота. Презентация по Химии "Оксиген. Кисень" - скачать смотреть бесплатно
Презентация по Химии "Оксиген. Кисень" - скачать смотреть бесплатно Сульфаниламидные препараты. (Тема 5)
Сульфаниламидные препараты. (Тема 5) Механические свойства твердых полимеров, малые деформации. (Лекция 9)
Механические свойства твердых полимеров, малые деформации. (Лекция 9) Омыляемые Липиды
Омыляемые Липиды Задачи по химии
Задачи по химии Влияние пищевых добавок на здоровье человека
Влияние пищевых добавок на здоровье человека Производство минеральных удобрений
Производство минеральных удобрений Природні джерела вуглеводнів. Нафта
Природні джерела вуглеводнів. Нафта Сложные эфиры в природе и их применение
Сложные эфиры в природе и их применение Щелочноземельные металлы
Щелочноземельные металлы Химические уравнения
Химические уравнения Переосаждение. (Глава 4. § 20. Задача 12)
Переосаждение. (Глава 4. § 20. Задача 12) Кислоты
Кислоты Редкие химические элементы
Редкие химические элементы Массовая доля элемента в веществе Задачи урока: 1. Познакомиться с понятием «массовая доля элемента в веществе» 2. Научиться рассч
Массовая доля элемента в веществе Задачи урока: 1. Познакомиться с понятием «массовая доля элемента в веществе» 2. Научиться рассч Средства и методы стерилизации
Средства и методы стерилизации