Содержание
- 2. Теория электролитической диссоциации Аррениуса пригодна лишь для водных растворов, в неводных растворителях она несостоятельна. Например, NH4Cl,
- 3. Протолитическая теория кислот и оснований (Теория Бренстеда-Лоури) Основные положения: 1. Кислота – молекула или ион, отдающие
- 4. 2. Кислоты и основания существуют только как сопряженные пары. Их свойства обусловлены процессом протолиза - обмена
- 5. Амфолитами являются: гидроксиды (Zn, Al, Pb, Sn, Cr); гидроанионы многоосновных кислот (НСО3- , НРО42- , Н2РО4-
- 6. Жидкие протонсодержащие растворители вступают в обратимую реакцию автопротолиза. Например, для воды: 2Н2О = Н3О+ + ОН-
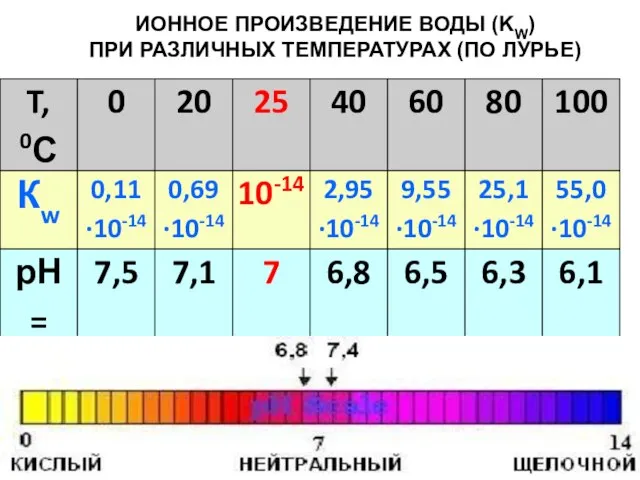
- 7. Водородный показатель (рН) Гидроксильный показатель (рОН) Логарифмируя уравнение КW =[Н+][ОН-]=10-14, получаем: Шкала кислотности воды составляет 14
- 8. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ (KW) ПРИ РАЗЛИЧНЫХ ТЕМПЕРАТУРАХ (ПО ЛУРЬЕ)
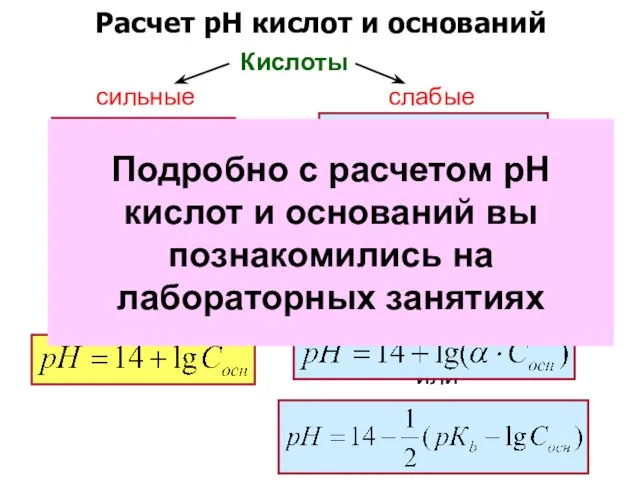
- 9. Расчет рН кислот и оснований Кислоты сильные слабые или Основания сильные слабые или Подробно с расчетом
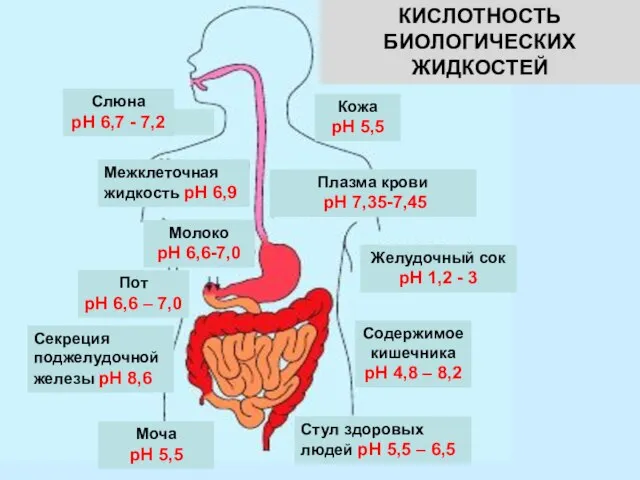
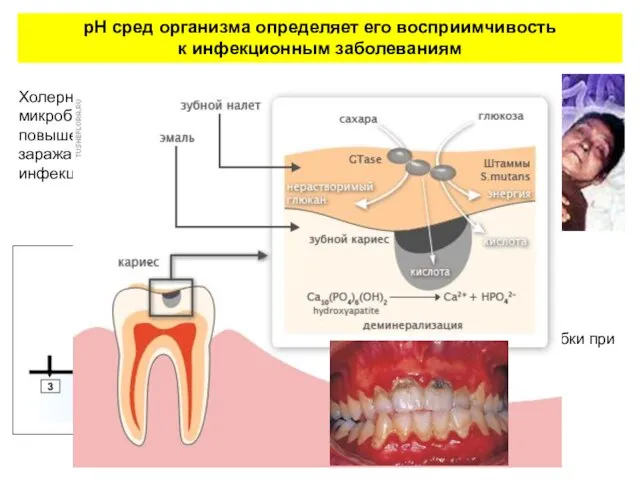
- 11. рН сред организма определяет его восприимчивость к инфекционным заболеваниям
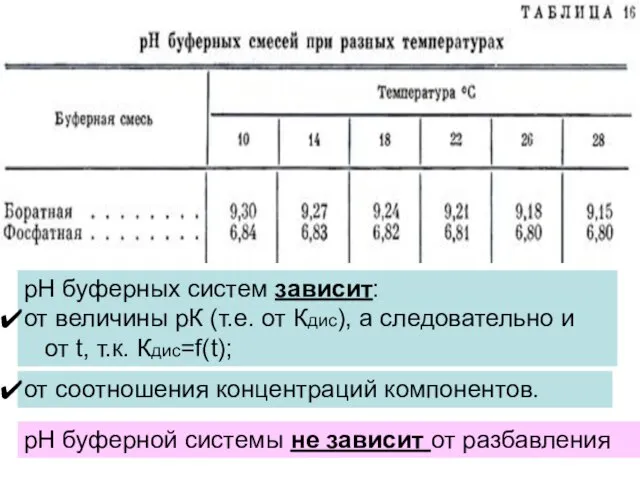
- 12. Растворы, способные сохранять значение рН при разбавлении или добавлении небольших количеств кислоты или щелочи. Классификация БС
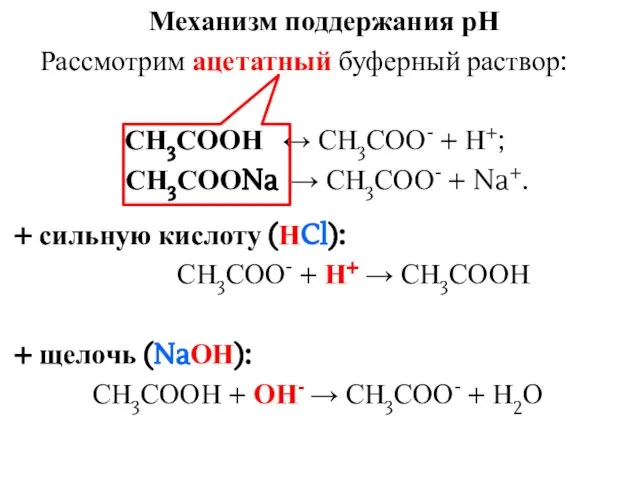
- 13. Механизм поддержания рН Рассмотрим ацетатный буферный раствор: СН3СООН ↔ СН3СОО- + Н+; СН3СООNa → СН3СОО- +
- 14. рН буферных растворов рассчитывается по формулам Гендерсона – Гассельбаха: Для кислого буфера: Для основного буфера: рН
- 15. Буферная емкость Буферная ёмкость (В) – количество моль эквивалентов сильной кислоты или щелочи, добавление которой к
- 16. Буферная ёмкость зависит от: природы добавляемых веществ и компонентов буферного раствора. исходной концентрации компонентов буферной системы.
- 17. Максимальная буферная емкость, т.е. наибольшая способность этой системы противостоять изменению рН, соответствует значению рН = рК.
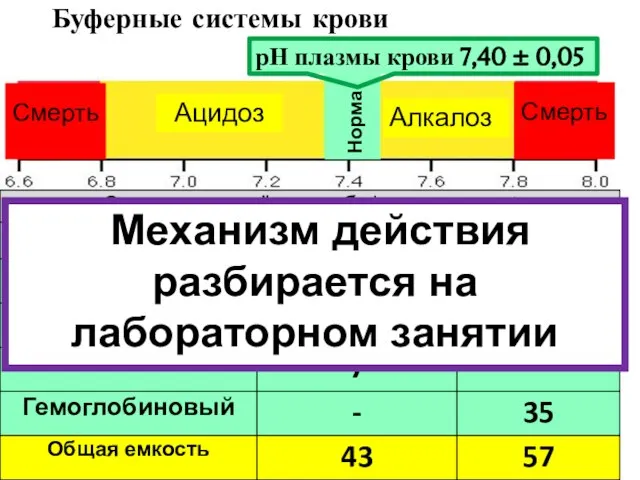
- 18. Буферные системы крови рН плазмы крови 7,40 ± 0,05 Норма Механизм действия разбирается на лабораторном занятии
- 19. Кислотно-основное состояние организма (КОС) Показатели КОС (метод микро – Аструп) Ва - буферная емкость по кислоте:
- 20. SB — стандартный бикарбонат, содержание НСОз- в крови — в норме 24,4±3 ммоль/л BE — избыток
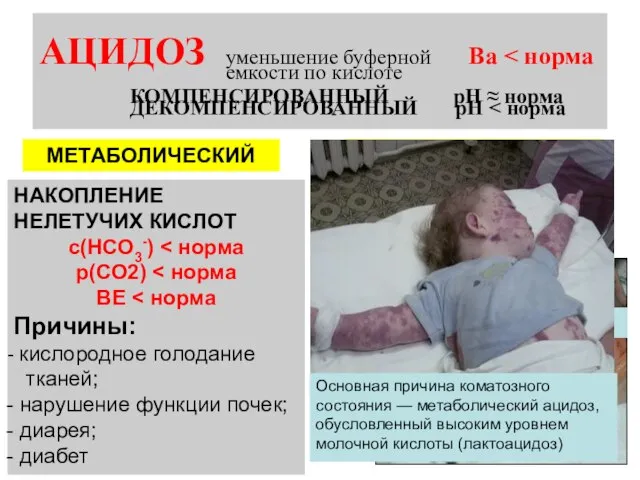
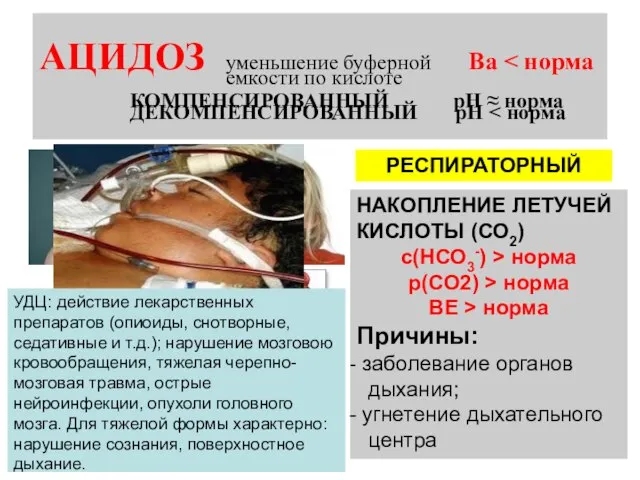
- 21. АЦИДОЗ уменьшение буферной Ва МЕТАБОЛИЧЕСКИЙ РЕСПИРАТОРНЫЙ НАКОПЛЕНИЕ НЕЛЕТУЧИХ КИСЛОТ с(НСО3-) р(СО2) ВЕ Причины: кислородное голодание тканей;
- 22. АЦИДОЗ уменьшение буферной Ва МЕТАБОЛИЧЕСКИЙ РЕСПИРАТОРНЫЙ НАКОПЛЕНИЕ ЛЕТУЧЕЙ КИСЛОТЫ (СО2) с(НСО3-) > норма р(СО2) > норма
- 23. АЛКАЛОЗ увеличение буферной Ва > норма емкости по кислоте КОМПЕНСИРОВАННЫЙ рН ≈ норма ДЕКОМПЕНСИРОВАННЫЙ рН >
- 24. АЛКАЛОЗ увеличение буферной Ва > норма емкости по кислоте КОМПЕНСИРОВАННЫЙ рН ≈ норма ДЕКОМПЕНСИРОВАННЫЙ рН >
- 25. Примечание*: значения ВЕ ± (4 – 5) – стресс-нормальное состояние ± (6 - 9) – тревожное
- 27. Скачать презентацию





![Водородный показатель (рН) Гидроксильный показатель (рОН) Логарифмируя уравнение КW =[Н+][ОН-]=10-14, получаем:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/557658/slide-6.jpg)









 Функциональные наноматериалы. (Лекция 1)
Функциональные наноматериалы. (Лекция 1) Синтез и структура медьсодержащих и серебросодержащих соединений пектина и хитозана
Синтез и структура медьсодержащих и серебросодержащих соединений пектина и хитозана Задачи, решаемые специализированными ТВ системами
Задачи, решаемые специализированными ТВ системами Аминокислоты. Свойства. Промышленные способы получения
Аминокислоты. Свойства. Промышленные способы получения Декаплінг. Ядерний ефект оверхаузера. Динамічні ефекти в ямр
Декаплінг. Ядерний ефект оверхаузера. Динамічні ефекти в ямр Органическая химия. Классификация кислот
Органическая химия. Классификация кислот Генетическая связь между классами органических веществ
Генетическая связь между классами органических веществ Сложные эфиры R-COOR'
Сложные эфиры R-COOR' Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Углерод и его соединения
Углерод и его соединения Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Химический калейдоскоп. Слайд-газета
Химический калейдоскоп. Слайд-газета Воздух. Состав воздуха. Реакция горения
Воздух. Состав воздуха. Реакция горения Волокна Презентація на тему:
Волокна Презентація на тему:  Особенности изоплотностного центрифугирования
Особенности изоплотностного центрифугирования Перспективы использования микроволнового излучения в органической химии
Перспективы использования микроволнового излучения в органической химии Лекарственные растения и сырье, содержащие флавоноиды. (Лекция 12)
Лекарственные растения и сырье, содержащие флавоноиды. (Лекция 12) Обмен триацилглицеролов и жирных кислот
Обмен триацилглицеролов и жирных кислот Островные силикаты (Орто)
Островные силикаты (Орто) Презентация по Химии "Харчові добавки" - скачать смотреть бесплатно
Презентация по Химии "Харчові добавки" - скачать смотреть бесплатно Тема 13. Состав, строение и свойства стекла и хрусталя 1. Оксид кремния 71-73% 2. Оксид натрия 13-16% 3. Оксид кальция 5-10% 4. Оксид магния 2
Тема 13. Состав, строение и свойства стекла и хрусталя 1. Оксид кремния 71-73% 2. Оксид натрия 13-16% 3. Оксид кальция 5-10% 4. Оксид магния 2 Гидролиз солей
Гидролиз солей Использование ИКТ в преподавании химии - презентация_
Использование ИКТ в преподавании химии - презентация_ Полиазометины (полишиффовы основания)
Полиазометины (полишиффовы основания) Розрахунок електронних властивостей перовскитів CsGeCl3 та CsSnCl3 як перспективних матеріалів сонячної енергетики
Розрахунок електронних властивостей перовскитів CsGeCl3 та CsSnCl3 як перспективних матеріалів сонячної енергетики Определение подлинности лекарственных веществ
Определение подлинности лекарственных веществ Факторы, влияющие на скорость химической реакции
Факторы, влияющие на скорость химической реакции Как я знаю химию! Викторина для учащихся 8 классов
Как я знаю химию! Викторина для учащихся 8 классов