Содержание
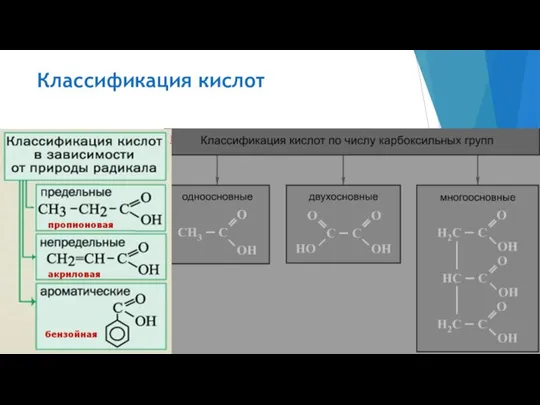
- 2. Классификация кислот
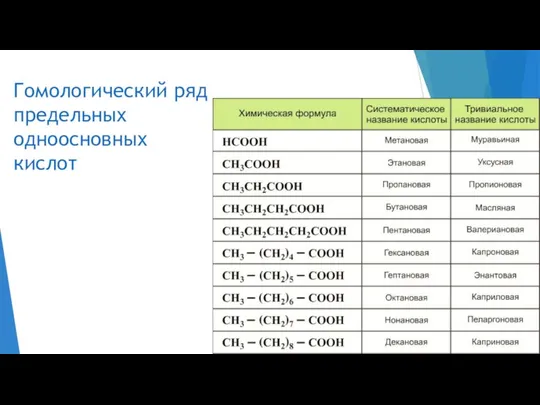
- 3. Гомологический ряд предельных одноосновных кислот
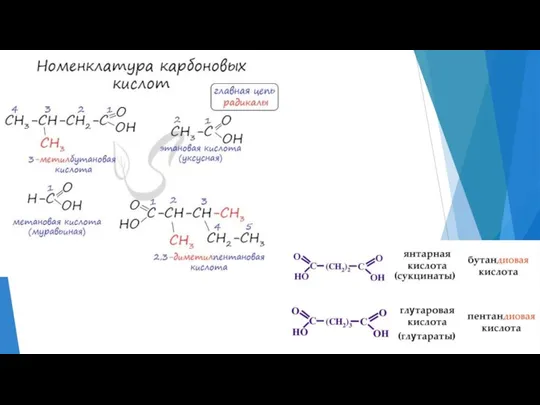
- 5. Рациональная номенклатура
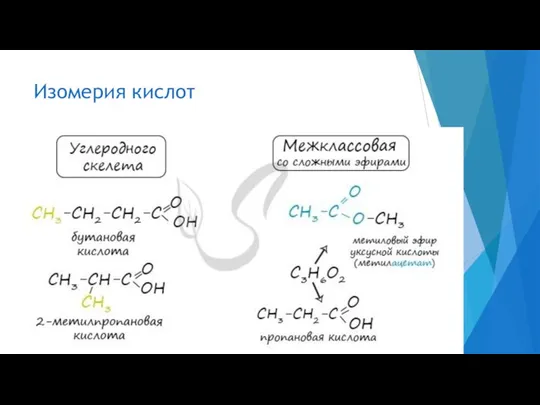
- 7. Изомерия кислот
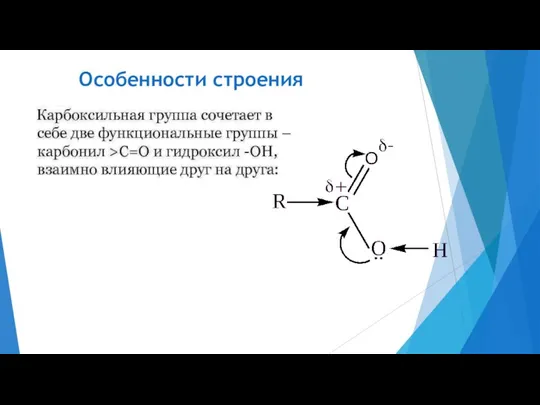
- 8. Особенности строения
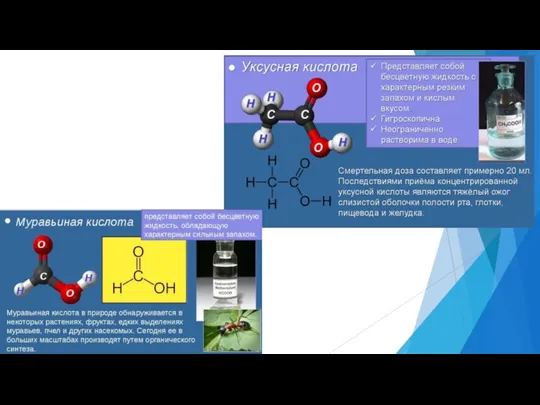
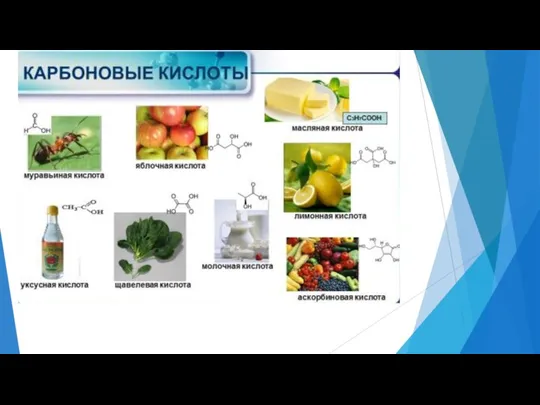
- 10. Физические свойства Между молекулами кислоты, благодаря группам ОН, образуются многочисленные водородные связи, поэтому: аномально высокие температуры
- 12. Химические свойства: реакции окисления В атмосфере кислорода, или под действием другого окислителя, карбоновые кислоты окисляются до
- 13. Химические свойства: реакция электрофильного замещения Для растворов карбоновых кислот будут возможны все реакции характерные для кислот
- 14. Химические свойства: реакция нуклеофильного замещения Наиболее важные из реакций нуклеофильного замещения – реакции этерификации. Так называют
- 15. Обратите внимание! Реакции присоединения по двойной связи, которые характерны для карбонильной группы, для кислот не характерны.
- 16. Химические свойства, обусловленные наличием радикала. Например, предельные карбоновые кислоты могут вступать в реакцию свободно-радикального замещения: CH3COOH
- 18. Получение кислот 1) окисление альдегидов; 2) окисление спиртов (без выделения альдегидов как промежуточного продукта); 3) окисление
- 20. Скачать презентацию










 LEGENDARY АВТОРСКИЕ ПРАВА ЗАЩИЩЕНЫ
LEGENDARY АВТОРСКИЕ ПРАВА ЗАЩИЩЕНЫ  Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН
Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН B-окисление жирных кислот и кетогенез
B-окисление жирных кислот и кетогенез Химия в повседневной жизни человека
Химия в повседневной жизни человека Кремний
Кремний Общая химическая технология
Общая химическая технология В глубине кристалла (11 класс)
В глубине кристалла (11 класс) Сильные и слабые электролиты. Степень диссоциации
Сильные и слабые электролиты. Степень диссоциации Белки. Аминокислоты
Белки. Аминокислоты Химический состав нефтей. Ненасыщенные углеводороды. Алкены и алкадиены
Химический состав нефтей. Ненасыщенные углеводороды. Алкены и алкадиены Кислоты. (8 класс.)
Кислоты. (8 класс.) Номенклатура органических соединений Практическое приложение
Номенклатура органических соединений Практическое приложение  Aluminium
Aluminium Промежуточный обмен
Промежуточный обмен Полезные свойства камней
Полезные свойства камней Ферменты. Свойства ферментов
Ферменты. Свойства ферментов в організмі
в організмі  Структура материала. Лекция 5
Структура материала. Лекция 5 Д. И. Менделеев в высказываниях
Д. И. Менделеев в высказываниях Общая характеристика неметаллов
Общая характеристика неметаллов Тіндер-тірі организмнің иерархиялық деңгейінің ұйымдастырудың бір түрі. Олардың құрылымдық принциптері
Тіндер-тірі организмнің иерархиялық деңгейінің ұйымдастырудың бір түрі. Олардың құрылымдық принциптері Литье под давлением термопластов
Литье под давлением термопластов Аминокислоты. Белки. Пептиды
Аминокислоты. Белки. Пептиды Выполнил: ученики 9 класса Проверил: учитель химии Санеева Л.П.
Выполнил: ученики 9 класса Проверил: учитель химии Санеева Л.П. Каталитический синтез нуклеозидов и других пребиотических производных формамида при протонном облучении метеоритов
Каталитический синтез нуклеозидов и других пребиотических производных формамида при протонном облучении метеоритов Титан. Структура, применение, свойства (11 класс)
Титан. Структура, применение, свойства (11 класс) Структура материалов
Структура материалов Работы Д.И.Менделеева в области агрохимии Автор: Залевская Марина,11 класс Научный руководитель: Голованова Галина Яковлевна, учи
Работы Д.И.Менделеева в области агрохимии Автор: Залевская Марина,11 класс Научный руководитель: Голованова Галина Яковлевна, учи