Содержание
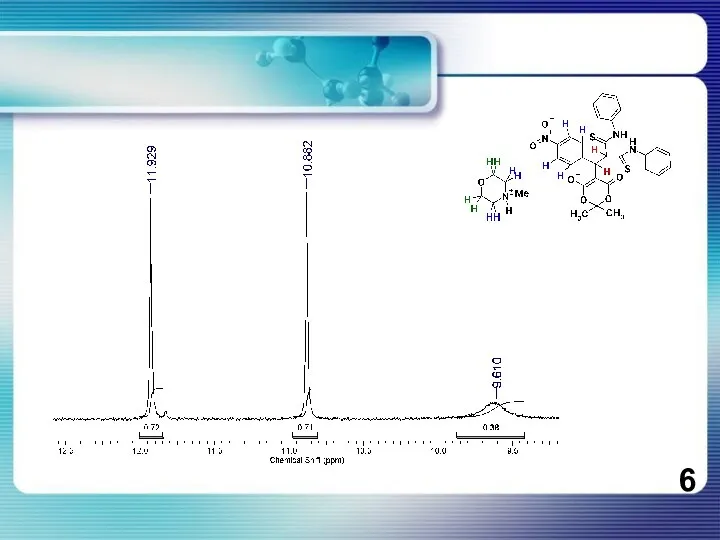
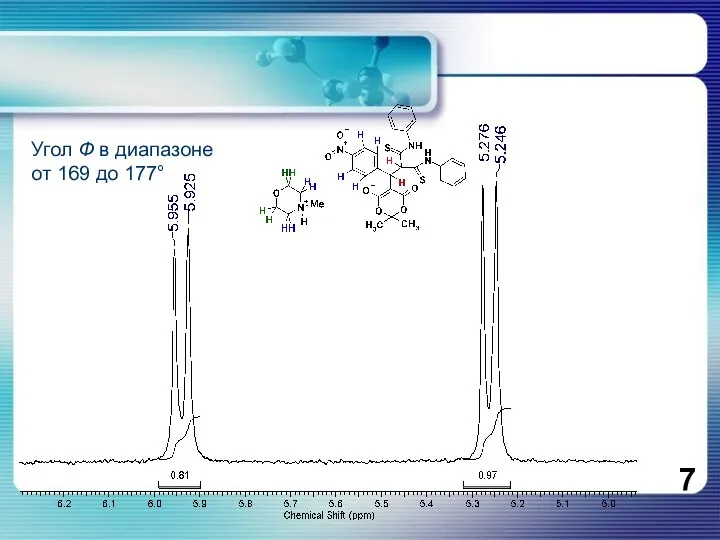
- 7. Угол Ф в диапазоне от 169 до 177°
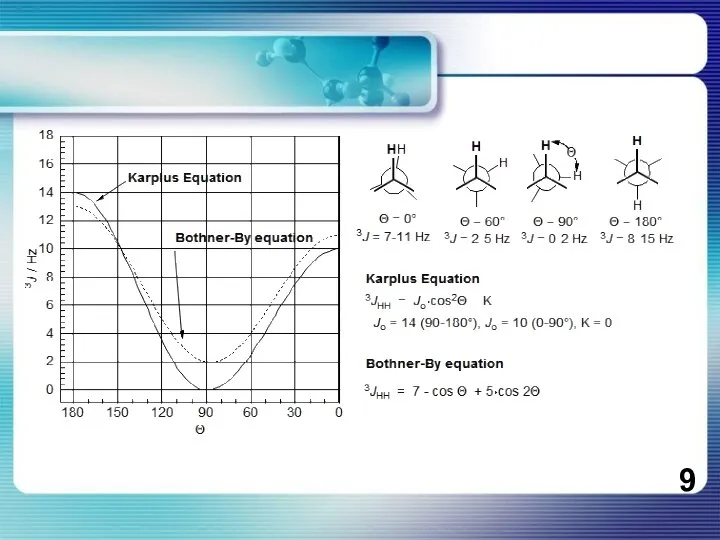
- 8. Уравнение Карплуса-Конроя Кривая КК чественно хорошо согласуются с расчетами, проведенными для фрагмента H—С—С—H. Однако эксперимент показывает,
- 10. The Karplus Equation for 3JHH (H-Csp3-sp3C-H) is: 3J = 7.8 - 1.0 cos(phi) + 5.6 cos(2*phi)
- 11. The Diez, Altona, Donders equation is: 3J = c00 + c01 S li + c10 cos(f)
- 12. The 3J vinyl and 4J allylic coupling constants are based on the modified Karplus Equation by
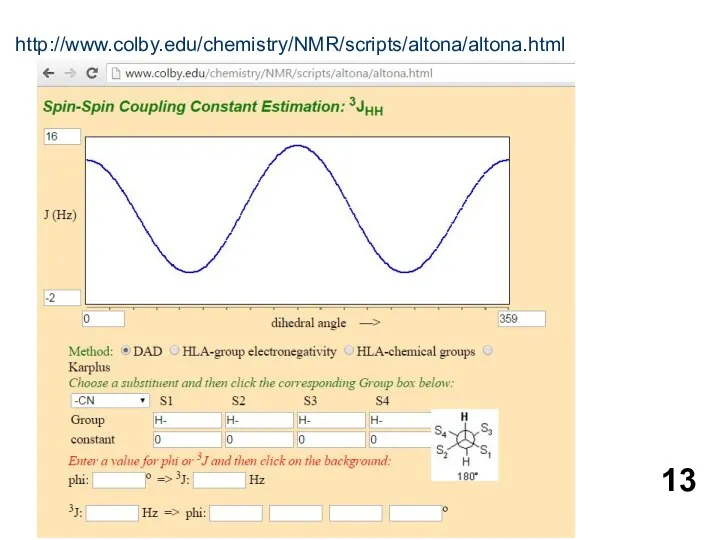
- 13. http://www.colby.edu/chemistry/NMR/scripts/altona/altona.html
- 25. Скачать презентацию
Слайд 2
Слайд 3
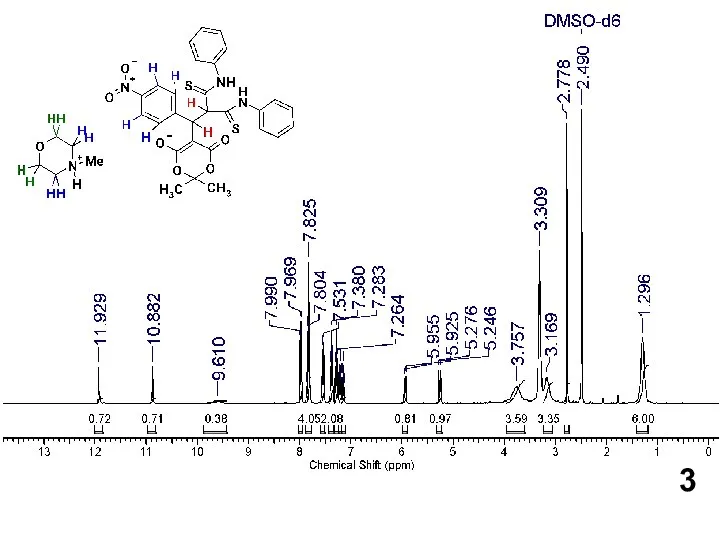
Слайд 4
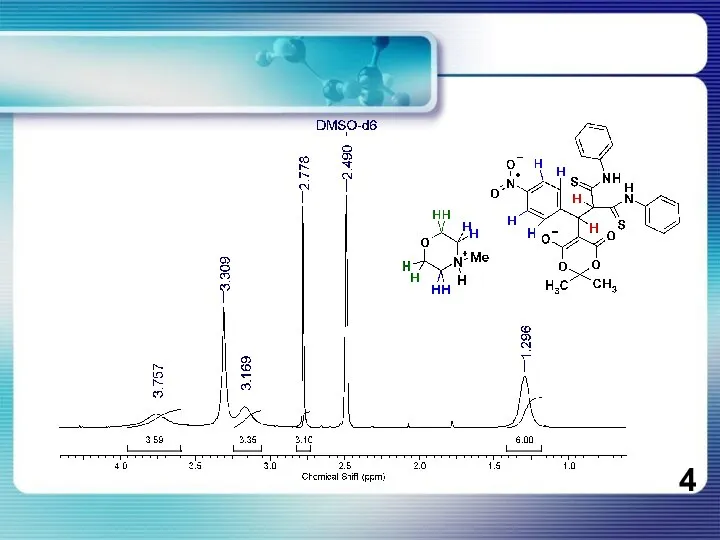
Слайд 5
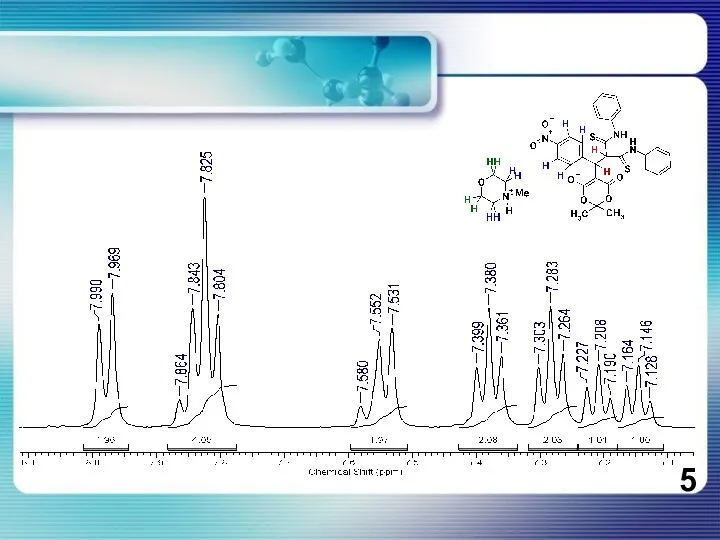
Слайд 6
Слайд 7
Угол Ф в диапазоне
от 169 до 177°
Угол Ф в диапазоне
от 169 до 177°
Слайд 8
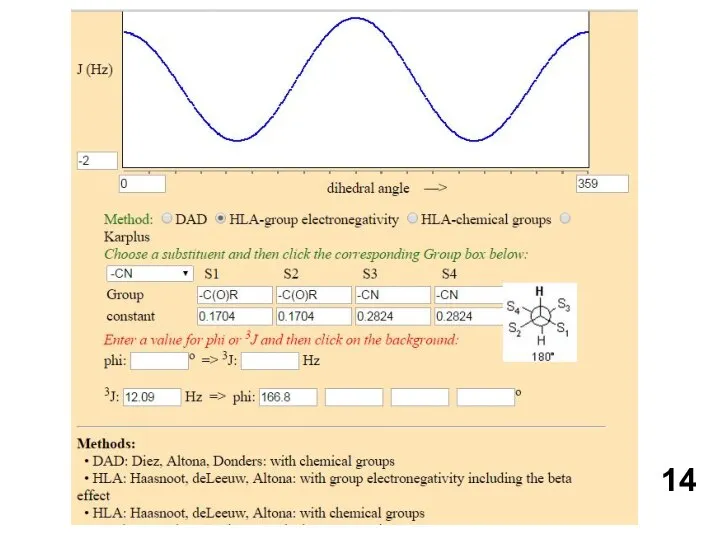
Уравнение Карплуса-Конроя
Кривая КК чественно хорошо согласуются с расчетами, проведенными для фрагмента
Уравнение Карплуса-Конроя
Кривая КК чественно хорошо согласуются с расчетами, проведенными для фрагмента
H—С—С—H. Однако эксперимент показывает, что
значения 3Jнн для ф = 0 и 180° в общем на 2-4 Гц больше, чем
рассчитанные. Поэтому для уравнения были предложены эмпирические постоянные A = 7, B = - 1 и С = 5. Кривая Карплуса — Конроя объясняет ряд важных закономерностей. Например, в олефиновых системах спин-спиновое взаимодействие между граис-протонами всегда больше, чем между цис-протонами. Поэтому легко различать цис- и транс-изомеры. Для 1,2-дизамещенных этанов справедливо соответствующее соотношение Jгош < Jтранс.
значения 3Jнн для ф = 0 и 180° в общем на 2-4 Гц больше, чем
рассчитанные. Поэтому для уравнения были предложены эмпирические постоянные A = 7, B = - 1 и С = 5. Кривая Карплуса — Конроя объясняет ряд важных закономерностей. Например, в олефиновых системах спин-спиновое взаимодействие между граис-протонами всегда больше, чем между цис-протонами. Поэтому легко различать цис- и транс-изомеры. Для 1,2-дизамещенных этанов справедливо соответствующее соотношение Jгош < Jтранс.
Слайд 9
Слайд 10
The Karplus Equation for 3JHH (H-Csp3-sp3C-H) is:
3J = 7.8 - 1.0 cos(phi) + 5.6 cos(2*phi)
This
The Karplus Equation for 3JHH (H-Csp3-sp3C-H) is: 3J = 7.8 - 1.0 cos(phi) + 5.6 cos(2*phi) This
basic form of the Karplus equation does not correct for the electronegativity of the substituents.The Altona equations for vicinal 3JHH (H-Csp3-sp3C-H) are:
3J = p1 cos2(f) + p2 cos(f) + p3 + S li (p4 + p5 cos2(ei f + p6 |li|))
where the sum is over the four substituents. The order of substitution around each carbon makes a difference. The direction coefficient, ei, is +1 for S1 and S3 and -1 for S2 and S4. The electronegativity of the substituents includes the "beta effect" and is given by:
li = (Ca -CH) + p7 S ( Cb -CH)
where Ca is the Huggin's electronegativity of the directly attached a atom, CH is the electronegativity of hydrogen, and the sum is over the b atoms that are attached to the a atom. The substituent electronegativity for each attached group is listed under the substituent name. The coefficients have also been modified to use empirical chemical group substituent constants.
Слайд 11
The Diez, Altona, Donders equation is:
3J = c00 + c01 S li + c10 cos(f)
The Diez, Altona, Donders equation is: 3J = c00 + c01 S li + c10 cos(f)
+ (c20 + c21 S li) cos(2f) + (s211 S ei l2i) sin(2f)
The coefficients for the Diez, Altona, Donders equations with chemical groups are:
c00 = 7.82 , c01 =-0.79 , c10 = -0.78 , c20 = 6.54 , c21 = -0.64 , s211 = 0.70
Please see: L. A. Donders, F. A. A. M. de Leeuw, C. Altona, "Relationship Between Proton-Proton NMR Coupling Constants and Substituent Electronegativities IV. An Extended Karplus Equation Accounting for Interactions Between Substituents and its Application to Coupling Constant Data Calculated by the Extended Huckel Method," Magn. Reson. Chem., 1989, 27, 556-563.
Слайд 12
The 3J vinyl and 4J allylic coupling constants are based on the modified Karplus Equation
The 3J vinyl and 4J allylic coupling constants are based on the modified Karplus Equation
by Garbisch:
Please see: E. W. Garbisch, Jr., "Conformations.
VI. Vinyl-Allylic Proton Spin Couplings," J. Amer. Chem. Soc, 1964, 86, 5561-5564.
VI. Vinyl-Allylic Proton Spin Couplings," J. Amer. Chem. Soc, 1964, 86, 5561-5564.
Слайд 13
http://www.colby.edu/chemistry/NMR/scripts/altona/altona.html
http://www.colby.edu/chemistry/NMR/scripts/altona/altona.html
Слайд 14
Слайд 15
Слайд 16
Слайд 17
Слайд 18
Слайд 19
Слайд 20
Слайд 21
Слайд 22
Слайд 23
- Предыдущая
Acidification in the ArcticСледующая -
Arctic Haze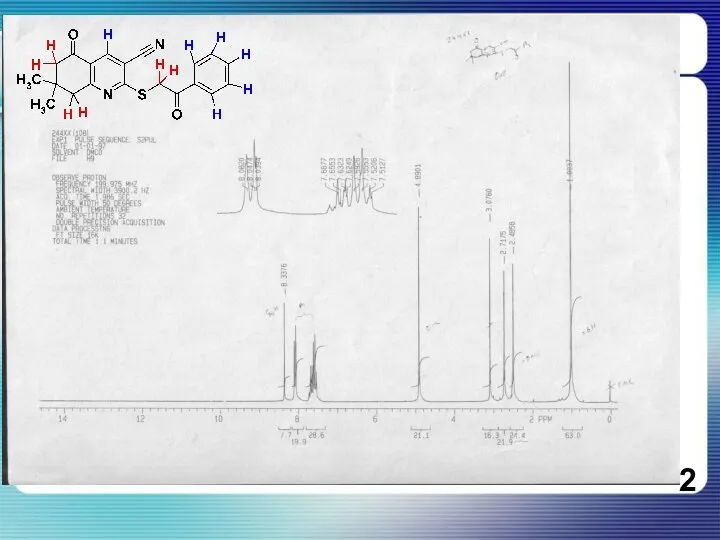




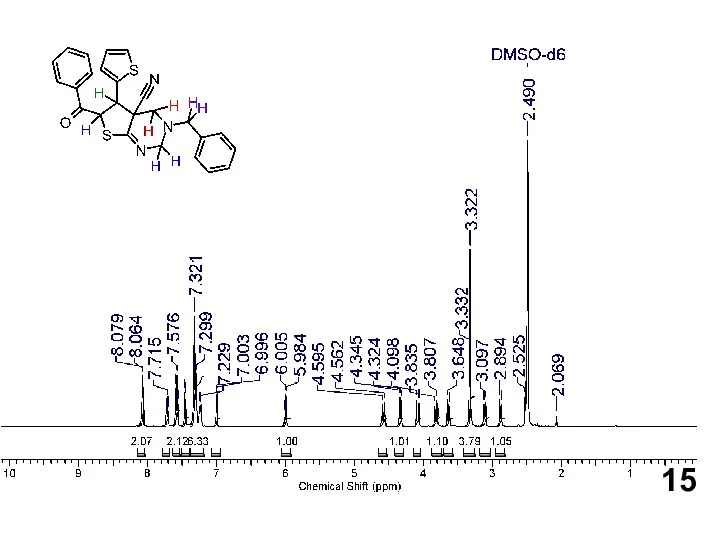
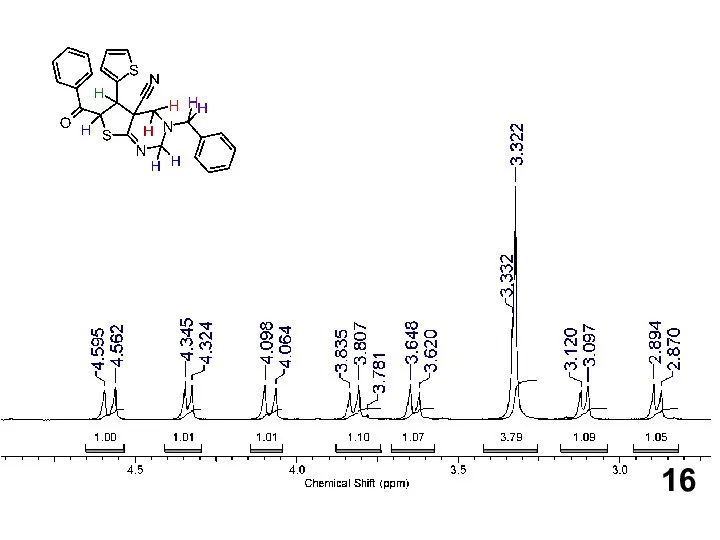
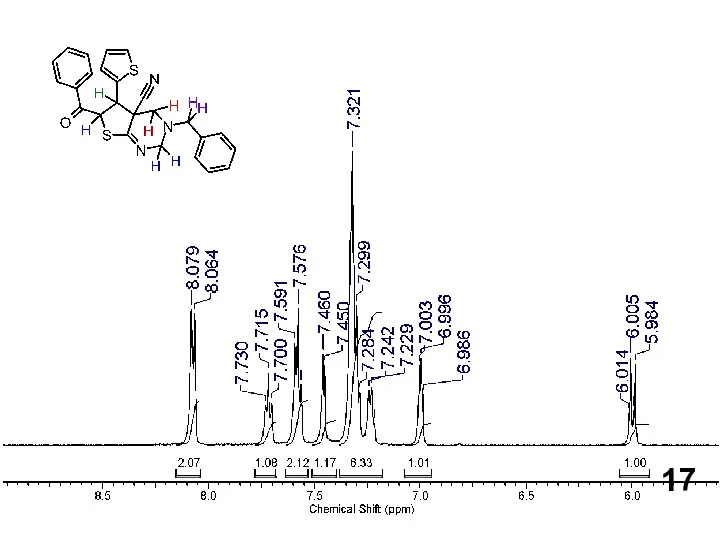
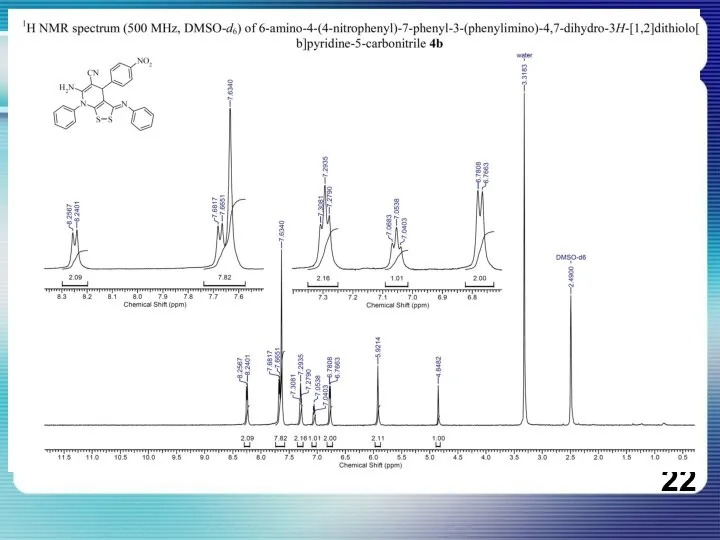
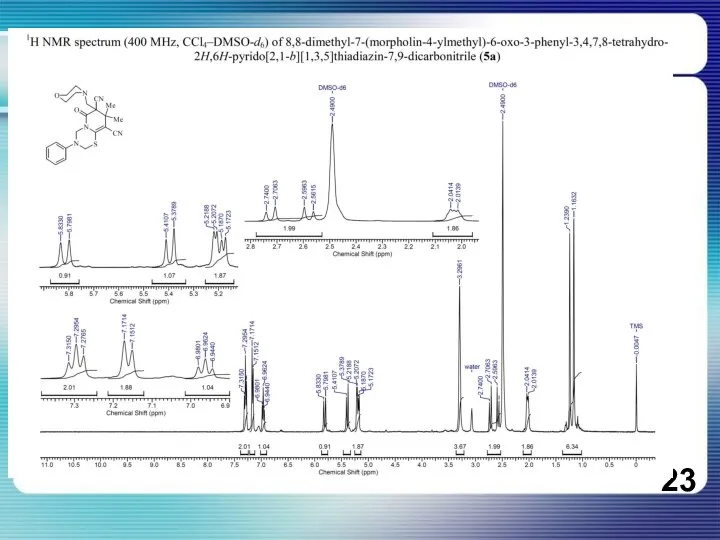
 Нефть. Свойства нефти
Нефть. Свойства нефти Химические формулы. Относительная молекулярная масса. 8 класс
Химические формулы. Относительная молекулярная масса. 8 класс Соли - это сложные вещества, которые состоят из ионов металла и кислотного остатка
Соли - это сложные вещества, которые состоят из ионов металла и кислотного остатка Метаболизм чужеродных соединений
Метаболизм чужеродных соединений Презентация по Химии "Химические тайны запаха" - скачать смотреть
Презентация по Химии "Химические тайны запаха" - скачать смотреть  Подготовка к ГИА. А14. Определение характера среды раствора кислот и щелочей с помощью индикаторов. Реакции на ионы в растворе
Подготовка к ГИА. А14. Определение характера среды раствора кислот и щелочей с помощью индикаторов. Реакции на ионы в растворе Серебро в жизни и деятельности человека
Серебро в жизни и деятельности человека Soluţiile sunt amestecuri omogene de două sau mai multe substanţe
Soluţiile sunt amestecuri omogene de două sau mai multe substanţe Химия в решении сырьевой проблемы
Химия в решении сырьевой проблемы Карбоновые кислоты
Карбоновые кислоты Полиэтилен, свойства и применение
Полиэтилен, свойства и применение Презентация Углекислый газ 9 класс
Презентация Углекислый газ 9 класс Презентация по Химии "Химия и современный мир профессий" - скачать смотреть бесплатно
Презентация по Химии "Химия и современный мир профессий" - скачать смотреть бесплатно Physical chemistry of surface phenomena. Basics of adsorptive therapy
Physical chemistry of surface phenomena. Basics of adsorptive therapy История развития химии
История развития химии Тест для подготовки к ЕГЭ по химии 2017
Тест для подготовки к ЕГЭ по химии 2017 Металловедение. Диаграмма состояния железоуглеродистых сплавов (Лекция 5)
Металловедение. Диаграмма состояния железоуглеродистых сплавов (Лекция 5) Алканы. Получение и применение алканов
Алканы. Получение и применение алканов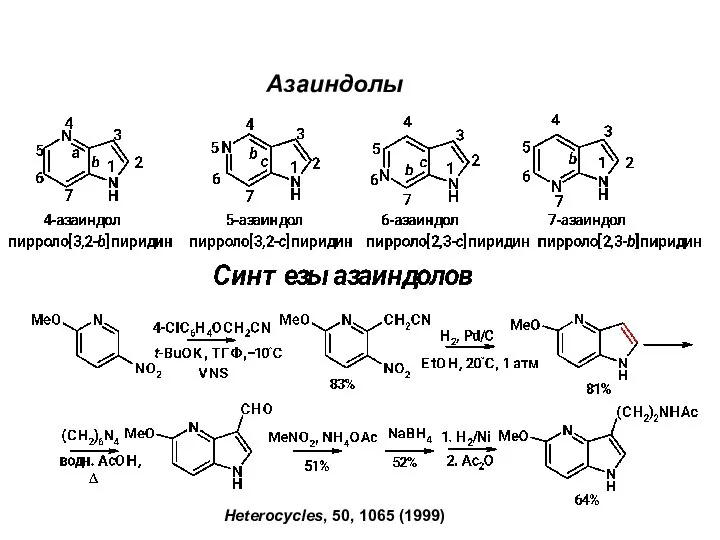 Азаиндолы. Синтeзы азаиндолов
Азаиндолы. Синтeзы азаиндолов Углеводороды. Обобщение знаний
Углеводороды. Обобщение знаний Происхождение нефти
Происхождение нефти Изопроцессы в идеальном газе
Изопроцессы в идеальном газе Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Реакционная способность соединений с карбонильной группой
Реакционная способность соединений с карбонильной группой Классификация химических реакций
Классификация химических реакций Тема Основание Гидроксид железа (II)
Тема Основание Гидроксид железа (II) Химическая кинетика
Химическая кинетика Работа по химии уч-ся МОУ ПСОШ №3 Мнацаканян Лусине учитель Радченко Н.В.
Работа по химии уч-ся МОУ ПСОШ №3 Мнацаканян Лусине учитель Радченко Н.В.