Содержание
- 2. Растворы электролитов Электролиты – вещества с ионной проводимостью. Это растворы солей, кислоты, оснований, расплавы солей. I
- 3. II закон Рауля ∆Tкип =iEm ∆Tзам=iKm Закон Вант-Гоффа ∆Pосм=icRT
- 4. i – поправочный коэффициент изотонический i – зависит от: природы раствора концентрации раствора i>1 для растворов
- 5. Теория электролитической диссоциации Аррениуса Распад молекул электролитов на ионы в среде растворителя под действием молекул растворителя.
- 6. Количественная характеристика процесса диссоциации выражается степенью электролитической диссоциации – α.
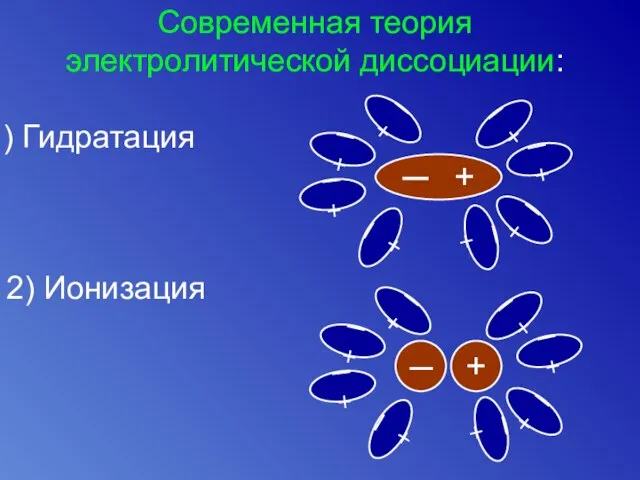
- 7. Современная теория электролитической диссоциации: Гидратация ─ + ─ + ─ + ─ + ─ + ─
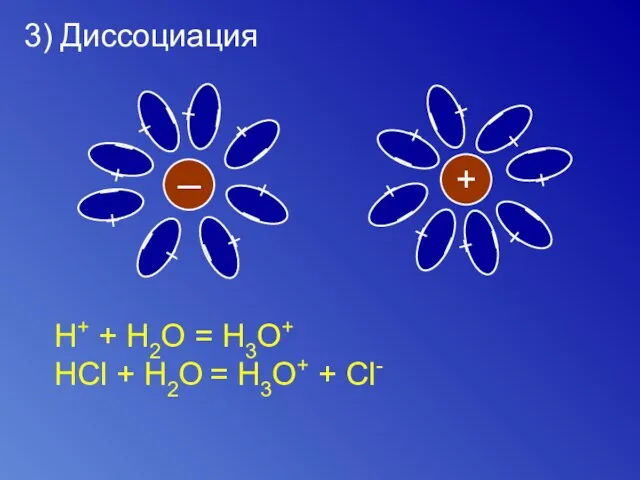
- 8. 3) Диссоциация ─ + ─ + ─ + ─ + ─ + ─ + ─ +
- 9. Способность гидратироваться зависит: - от природы ионов от заряда иона от размера иона от строения электронной
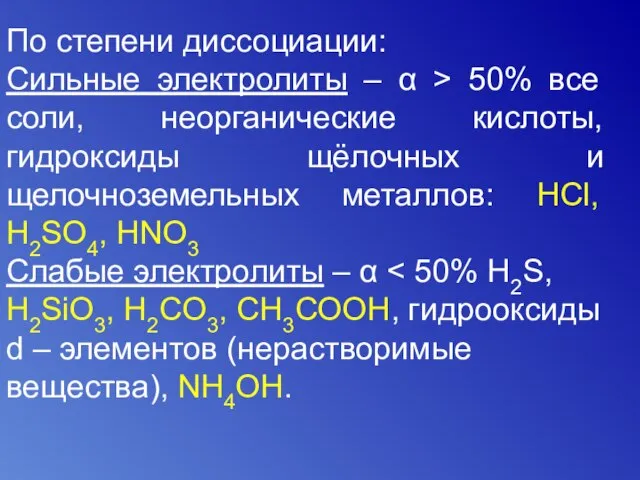
- 10. По степени диссоциации: Сильные электролиты – α > 50% все соли, неорганические кислоты, гидроксиды щёлочных и
- 11. Растворы слабых электролитов Чем больше Кд тем сильнее диссоциирует электролит. NH4OH = NH4+ + OH-
- 12. Закон разбавления Освальда α С – разбавлением раствора степень диссоциации увеличивается. с – молярная концентрация электролита
- 13. Растворы сильных электролитов NaCl i≈2 NaCl → Na+ + Cl- от наличия одноимённых ионов СН3COOH ↔
- 14. 1907 Льюис → активность (а) → эффективная концентрация ионов. а = f·c; f = 1 a
- 15. Коэффициент активности зависит от ионной силы раствора (J). А – коэффициент пропор., зависит от вида растворителя.
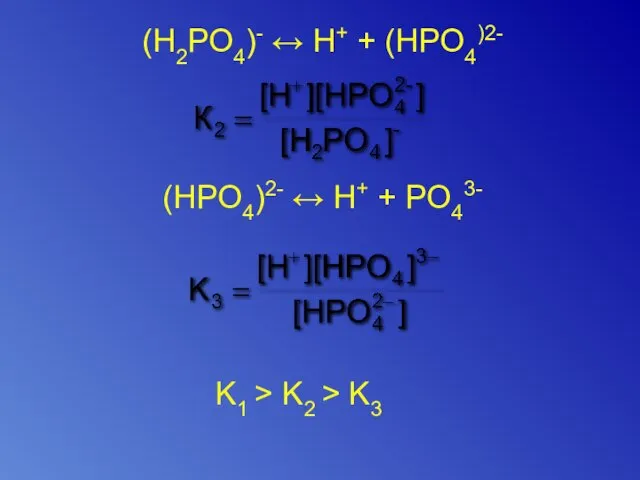
- 16. (H2PO4)- ↔ H+ + (HPO4)2- (HPO4)2- ↔ H+ + PO43- K1 > K2 > K3
- 17. Ионное произведение воды. pH – растворов. Н2О ↔ H+ + ОН- Kводы = [H+][OH-] = 1,1⋅10-14
- 18. Нейтральный раствор [H+] = 10-7 г-ион/л [OH-] = 10-7 г-ион/л Кислый раствор [H+] > 10-7 г-ион/л
- 19. В нейтральной среде: [H+] = 10-7 -Lg[10-7] = 7 → pH = 7 В кислой среде:
- 20. Пример 1: [OH-] = 10-11 pH = ? [H+][OH-] = 10-14 x⋅10-11 = 10-14 [H+] =
- 22. Скачать презентацию












![Нейтральный раствор [H+] = 10-7 г-ион/л [OH-] = 10-7 г-ион/л Кислый](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/567909/slide-17.jpg)
![В нейтральной среде: [H+] = 10-7 -Lg[10-7] = 7 → pH](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/567909/slide-18.jpg)
![Пример 1: [OH-] = 10-11 pH = ? [H+][OH-] = 10-14](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/567909/slide-19.jpg)
 03. Знакомство с лаб. оборудованием. Правила техники безопасности
03. Знакомство с лаб. оборудованием. Правила техники безопасности Силикатная промышленность
Силикатная промышленность Жиры Цели урока: Изучить жиры: состав, классификация,физические и химические свойства, переработка, применение, биологич
Жиры Цели урока: Изучить жиры: состав, классификация,физические и химические свойства, переработка, применение, биологич Презентация по Химии "Жиры животных" - скачать смотреть
Презентация по Химии "Жиры животных" - скачать смотреть  Алкілування ізобутану бутенами
Алкілування ізобутану бутенами Аттестационная работа. Исследовательская деятельность на уроках химии (8 -9 классы). Исследование речки Беленькой
Аттестационная работа. Исследовательская деятельность на уроках химии (8 -9 классы). Исследование речки Беленькой Строение электронных оболочек атомов
Строение электронных оболочек атомов Жиры
Жиры Обмен липидов
Обмен липидов Титан және оның қорытпалары
Титан және оның қорытпалары Основы химической термодинамики
Основы химической термодинамики Химическое равновесие. Азот и Фосфор. 9 класс
Химическое равновесие. Азот и Фосфор. 9 класс Неорганические вещества клетки
Неорганические вещества клетки Презентация по Химии "Нефть" - скачать смотреть бесплатно
Презентация по Химии "Нефть" - скачать смотреть бесплатно Презентация по Химии "Карбонові кислоти" - скачать смотреть бесплатно
Презентация по Химии "Карбонові кислоти" - скачать смотреть бесплатно Общая характеристика металлов
Общая характеристика металлов Химическая кинетика. Лекция 9
Химическая кинетика. Лекция 9 Коллоидная химия. Введение
Коллоидная химия. Введение Тема 1. Металлы и сплавы
Тема 1. Металлы и сплавы The way to prepare gold clusters - Every atom makes a difference
The way to prepare gold clusters - Every atom makes a difference Реакции замещения
Реакции замещения Презентация по Химии "В мире веществ и реакций" - скачать смотреть
Презентация по Химии "В мире веществ и реакций" - скачать смотреть  Презентація на тему «Основи»
Презентація на тему «Основи»  Химия. Проверочная
Химия. Проверочная Нанодисперсный политетрафторэтилен. Инертные, антифрикционные, противоизносные покрытия
Нанодисперсный политетрафторэтилен. Инертные, антифрикционные, противоизносные покрытия Электрохимический ряд напряжений металлов
Электрохимический ряд напряжений металлов  Алкены и Алкины
Алкены и Алкины Алкины
Алкины