Содержание
- 2. Реакции соединения – это такие реакции, в результате которых из нескольких простых или сложных веществ образуется
- 3. Определите тип химической реакции Реакции разложения – это такие реакции, в результате которых из одного сложного
- 4. Сравните уравнения химических реакций Fe + H2SO4 → FeSO4 + H2↑ FeO + H2SO4 → FeSO4
- 5. Тема урока: « Реакции обмена» AB+CD = AD+CB Сложные вещества обмениваются своими составными частями
- 6. Реакции обмена – это такие реакции, в результате которых два сложных вещества обмениваются своими составными частями
- 7. Эксперимент №1: Взаимодействие соляной кислоты с карбонатом натрия Наблюдайте. Сделайте выводы о признаке протекания реакций. +
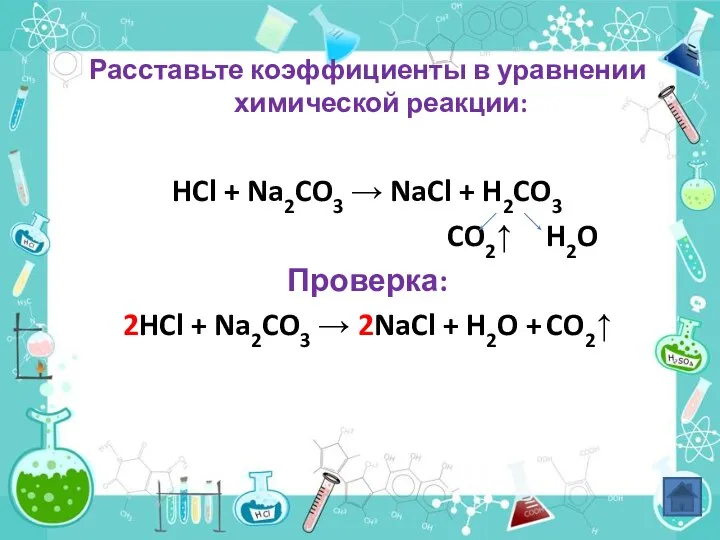
- 8. Расставьте коэффициенты в уравнении химической реакции: HCl + Na2CO3 → NaCl + H2CO3 CO2↑ H2O Проверка:
- 9. Эксперимент № 2 Взаимодействие раствора гидроксида натрия с сульфатом меди. Расставьте коэффициенты в уравнении химической реакции:
- 10. Проверяем : CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
- 11. Эксперимент №3: Взаимодействие серной кислоты с раствором хлорида бария Наблюдайте. Сделайте выводы о признаке протекания реакций.
- 12. Эксперимент №3: Взаимодействие соляной кислоты с раствором гидроксида натрия Наблюдайте. Сделайте выводы о признаке протекания реакций.
- 13. Если выделится газ- Это раз; И получится вода - Это два; А еще - нерастворимый Осаждается
- 14. Реакции обмена в быту Разрыхлители теста. Определение качества воды. Устранение жесткости воды. Определение качества продуктов питания.
- 15. Решите проблему, работая в парах Какие из реакции обмена, схемы которых: BaCl2 + AgNO3 → Cu(NO3)2
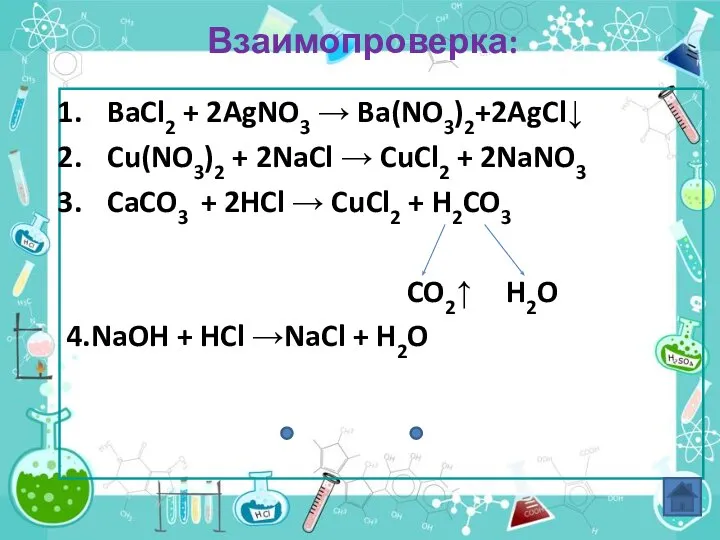
- 16. Взаимопроверка: BaCl2 + 2AgNO3 → Ba(NO3)2+2AgCl↓ Cu(NO3)2 + 2NaCl → CuCl2 + 2NaNO3 CaCO3 + 2HCl
- 17. Допишите уравнения реакций и укажите их тип по признаку « число и состав исходных веществ и
- 18. Рефлексия «Суди себя сам. Это самое трудное. Себя судить куда труднее, чем других. Если ты сумеешь
- 19. Домашнее задание «§ 32 №4-6 с.168 Исследовательская работа» (на карточках)
- 20. Желаю вам успехов в изучении химии ! Спасибо за внимание!
- 21. Задание 1 Укажите тип химической реакции Расставьте коэффициенты в уравнениях химических реакций, назовите образовавшиеся соединения: Ca
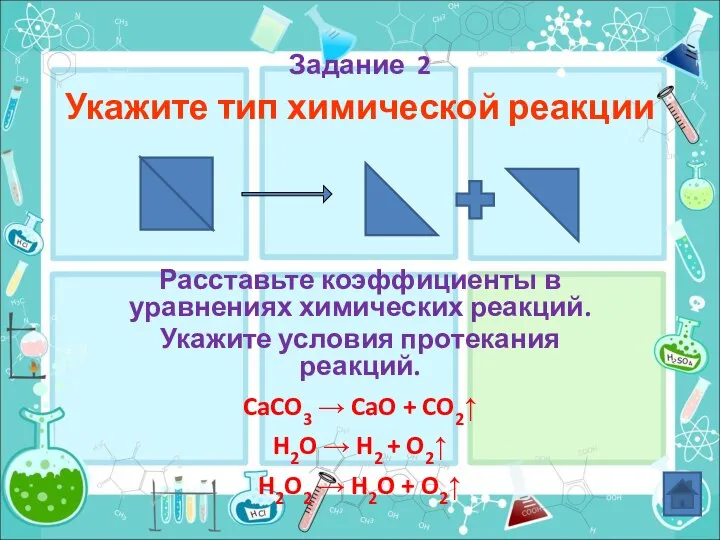
- 22. Задание 2 Укажите тип химической реакции Расставьте коэффициенты в уравнениях химических реакций. Укажите условия протекания реакций.
- 23. Задание 3. Укажите тип химической реакции 2 HCl + Zn = Zn Cl2 + H2↑ сложное
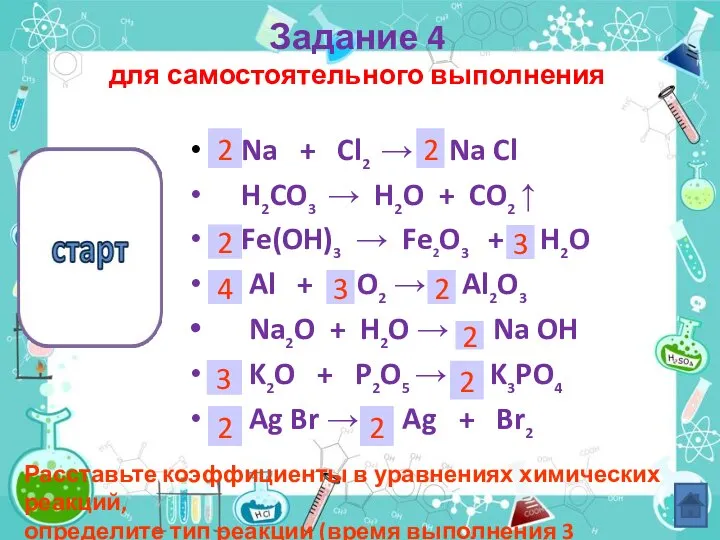
- 24. Na + Cl2 → Na Cl H2CO3 → H2O + CO2 ↑ Fe(OH)3 → Fe2O3 +
- 26. Скачать презентацию



















 Методы определения вязкости жидкости
Методы определения вязкости жидкости Творческий проект на тему химия в пище
Творческий проект на тему химия в пище Gelation in aqueous solution of L-cysteine and silver nitrate
Gelation in aqueous solution of L-cysteine and silver nitrate Абсолютное первенство по химии
Абсолютное первенство по химии Алюминий
Алюминий  Алкены. Пропилен
Алкены. Пропилен Спирты
Спирты Главная подгруппа II группы (щелочно-земельные металлы)
Главная подгруппа II группы (щелочно-земельные металлы) Жиры. Классификация жиров
Жиры. Классификация жиров Нуклеиновые кислоты
Нуклеиновые кислоты Закономерности изменения металлических и неметаллических свойств элементов в периодах и группах (8 класс)
Закономерности изменения металлических и неметаллических свойств элементов в периодах и группах (8 класс) Аминокислоты и белки
Аминокислоты и белки Буферное кислотно - основное взаимодействие
Буферное кислотно - основное взаимодействие Природный и попутный нефтяной газ
Природный и попутный нефтяной газ Пластмассы
Пластмассы pH and pH meter
pH and pH meter Химические свойства основных неорганических соединений в свете ЭД и ОВР
Химические свойства основных неорганических соединений в свете ЭД и ОВР Способы раскисления и модифицирования стали
Способы раскисления и модифицирования стали Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе
Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе Теория Электролитической Диссоциации
Теория Электролитической Диссоциации Клетка элементарная единица живого
Клетка элементарная единица живого Микроэлементы. Химические элементы в клетках живых организмов. Химия и здоровье
Микроэлементы. Химические элементы в клетках живых организмов. Химия и здоровье Химический состав фракций нефти
Химический состав фракций нефти Презентация по Химии "Гидролиз солей" - скачать смотреть бесплатно
Презентация по Химии "Гидролиз солей" - скачать смотреть бесплатно Полімери та пластмаси
Полімери та пластмаси  Оксиды (1 курс)
Оксиды (1 курс) Классификация титановых сплавов
Классификация титановых сплавов Производные индола
Производные индола