Слайд 8

25
Горение в жёлто-зелёном газе.
Юные химики решили исследовать горение различных веществ в
газе А. Это ядовитый газ жёлто-лезёного цвета, тяжелее воздуха. Им наполнили четыре банки, которые накрыли стеклянными пластинами, чтобы газ не выходил.
Газ Х, выходящий из трубки, проверили на чистоту и подожгли на воздухе. Затем трубку с горящим газом Х внесли в банку, наполненную газом А. Пламя немного побледнело и приобрело зеленоватый оттенок. При взаимодействии азов А и Х образуется новое газообразное вещество. В двух ложечках нагрели небольшие кусочки металлов У и З, предварительно очистив их от следов керосина, в котором они хранились. Затем ложечки с нагретыми металлами внесли в банки с газом А. Металлы тотчас вспыхнули. У горел в А ослепительно-жёлтым пламенем, а пламя З имело фиолетовой оттенок. При горении металлов У и З банки заполнились белым дымом, состоящим из мелких кристалликов соответствующих солей. Соль, образующаяся при горении металла У, имеет очень широкое применение. В частности, она используется в пищевой промышленности и кулинарии. При горении З образуется соль, которая применяется в качестве удобрения в сельском хозяйстве. В четвертую банку внесли кусочек бумаги, пропитанный скипидаром. Через несколько секунд бумага воспламенилась и сгорела сильно коптящим пламенем, т.е. образовалось много чёрной копоти, скажи (углерод).
Определите газы А и Х, а также металлы У и З. Известно, что все эти вещества являются простыми, причем вещества Х, У, З образованы элементами, которые находятся в одной группе Периодической системы.
Напишите уравнения реакций горения Х, У, З в газе А. Известно, что все эти реакции являются реакциями соединения.
Напишите уравнения реакции, которое описывает процесс горения скипидара в газе А. Примите, что основным компонентом скипидара является вещество состава С10Н16, а взаимодействие относится к реакциям замещения.
Газ Х горит на воздухе. С каким газом в составе воздухе взаимодействует Х? Напишите соответствующее уравнение реакции.




















 Лаборатория мирового уровня в области термического анализа и физико-химии процессов тепловых методов добычи
Лаборатория мирового уровня в области термического анализа и физико-химии процессов тепловых методов добычи Темір және оның маңызды қосылыстары
Темір және оның маңызды қосылыстары Биосинтез белка
Биосинтез белка Геолого-промышленные типы месторождений полезных ископаемых
Геолого-промышленные типы месторождений полезных ископаемых Своя игра «Знаешь ли ты химические элементы?»
Своя игра «Знаешь ли ты химические элементы?» Поверхностное натяжение
Поверхностное натяжение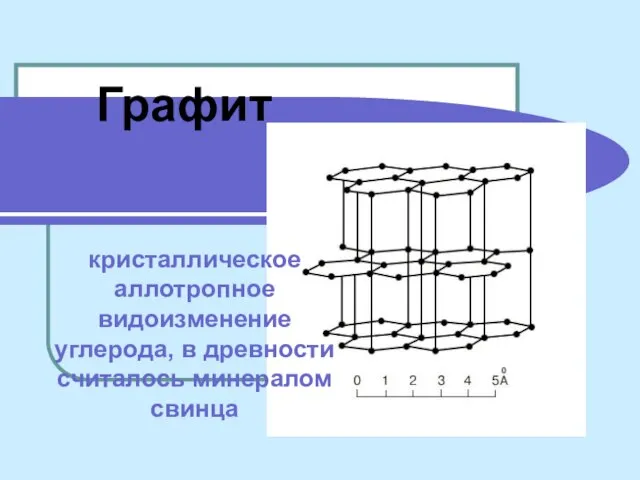 Графит кристаллическое аллотропное видоизменение углерода, в древности считалось минералом свинца
Графит кристаллическое аллотропное видоизменение углерода, в древности считалось минералом свинца Норми радіаційної безпеки (НРБУ-97)
Норми радіаційної безпеки (НРБУ-97) Основания. Гидроксид лития
Основания. Гидроксид лития Тема урока: «Генетическая связь между классами неорганических соединений » ГОУ СОШ №149 Учитель химии: Иванова Г.М.
Тема урока: «Генетическая связь между классами неорганических соединений » ГОУ СОШ №149 Учитель химии: Иванова Г.М. Нефть. Лекция 5
Нефть. Лекция 5 Оксиды. Классы неорганических соединений
Оксиды. Классы неорганических соединений Тема урока Железо Цель урока: Рассмотреть электронное строение атома железа, дать общую характеристику его. Изучить основные
Тема урока Железо Цель урока: Рассмотреть электронное строение атома железа, дать общую характеристику его. Изучить основные  Отношение масс элементов в веществе. Массовые доли элементов в веществе
Отношение масс элементов в веществе. Массовые доли элементов в веществе Тема урока: Состав, переработка нефти и экологические проблемы связанные с ней.
Тема урока: Состав, переработка нефти и экологические проблемы связанные с ней. Тканые армирующие наполнители
Тканые армирующие наполнители Презентация по химии Строение атома
Презентация по химии Строение атома  Предмет химии
Предмет химии Обмен веществ и энергии, основа существования клетки
Обмен веществ и энергии, основа существования клетки Взаимосвязь обмена веществ
Взаимосвязь обмена веществ Общая химия. Химическая термодинамика. Первый закон термодинамики. Термохимия
Общая химия. Химическая термодинамика. Первый закон термодинамики. Термохимия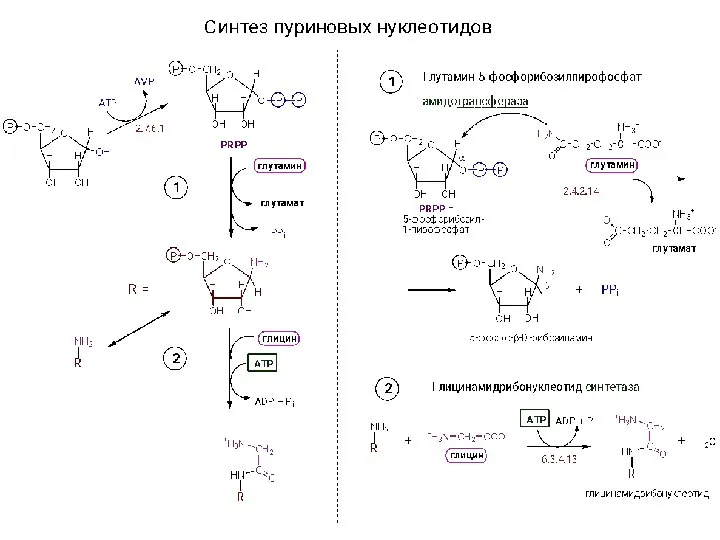 Синтез нуклеотидов
Синтез нуклеотидов Классификация и номенклатура органических соединений. (Лекция 1)
Классификация и номенклатура органических соединений. (Лекция 1) Сполуки неметалічних елементів з гідрогеном. Амоніак та хлороводень
Сполуки неметалічних елементів з гідрогеном. Амоніак та хлороводень Технологические методы производства деталей машин из ПКМ, содержащих дисперсные наполнители
Технологические методы производства деталей машин из ПКМ, содержащих дисперсные наполнители Металлические сплавы
Металлические сплавы Спирты
Спирты Атомы, молекулы, химические элементы. Формы существования элементов в природе
Атомы, молекулы, химические элементы. Формы существования элементов в природе