Содержание
- 2. Положение серы в ПСХЭ
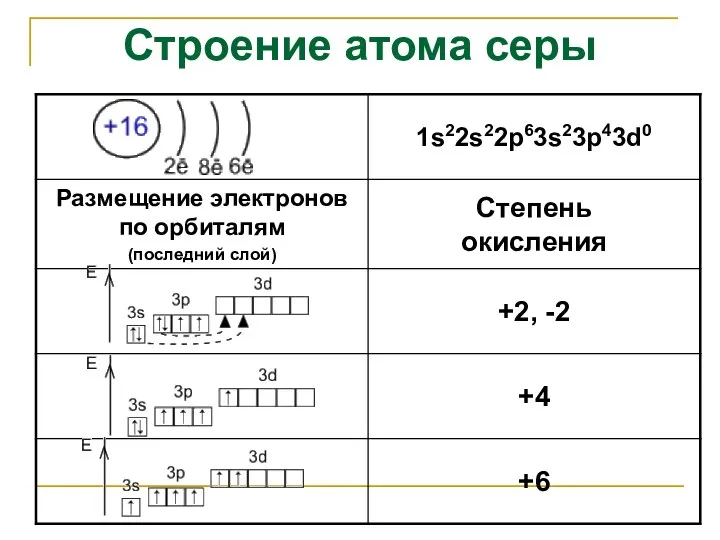
- 3. Строение атома серы
- 4. Окислительно-восстановительные свойства S-2 ⇄ S0 ⇄ S+4 ⇄ S+6 S-2 → только восстановители S0 → окислители,
- 5. *В свободном виде (самородная сера). *В виде соединений: органических и неорганических (сульфиды и сульфаты). *В составе
- 6. Самородная сера, серный колчедан FeS2, медный колчедан CuFeS2, свинцовый блеск PbS с цинковой обманкой ZnS (Балхаш
- 7. Физические свойства серы Агрегатное состояние ТВЕРДОЕ КРИСТАЛЛИЧЕСКОЕ Цвет ЖЕЛТЫЙ Запах БЕЗ ЗАПАХА Растворимость в воде НЕ
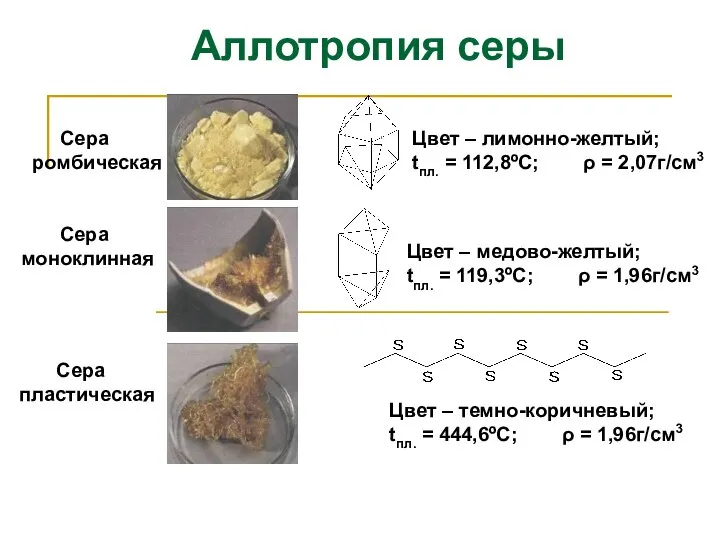
- 8. Сера ромбическая Сера пластическая Сера моноклинная Цвет – лимонно-желтый; tпл. = 112,8ºС; ρ = 2,07г/см3 Цвет
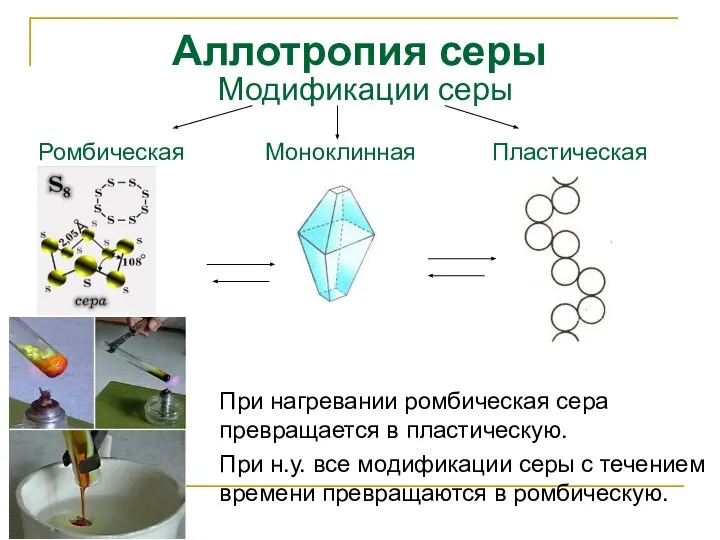
- 9. Аллотропия серы При нагревании ромбическая сера превращается в пластическую. При н.у. все модификации серы с течением
- 10. Реагирует с неметаллами (искл. азот N2 и иод I2): S + O2 = SO2 оксид серы
- 11. Реагирует с металлами (искл. золото Аu, платина Рt): 2Na + S = Na2S – сульфид натрия
- 12. Реагирует со сложными веществами: S + 2H2SO4(конц.) = 3SO2 + 2H2O S + 6HNO3(конц) = H2SO4
- 13. Получение серы 1. Неполное окисление сероводорода: 2H2S + O2 = 2S↓ + 2H2O (недостаток O2) 2.
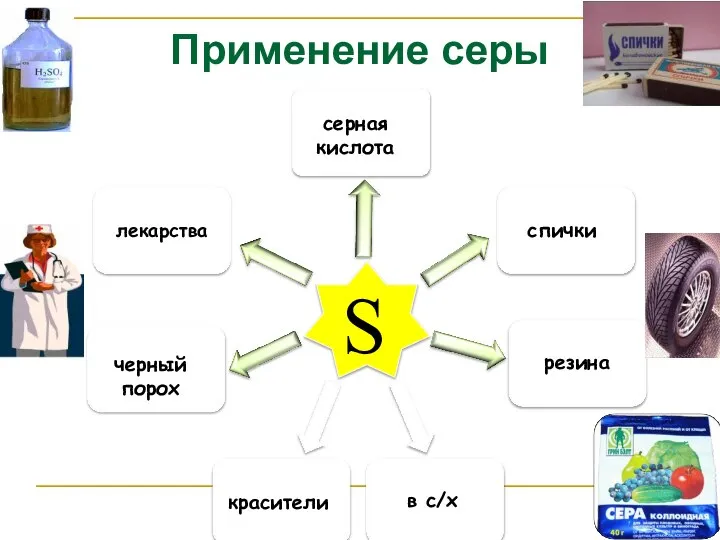
- 14. Применение серы
- 15. Сероводород Бесцветный газ с запахом тухлых яиц, тяжелее воздуха, яд Получение 1) H2 + S →
- 16. Взаимодействие H2S с водой Раствор H2S в воде – слабая двухосновная кислота (сероводородная кислота) Диссоциация происходит
- 17. . H2S + Ме, основные оксиды, основания: H2S + 2NaOH изб. → Na2S + 2H2O H2S
- 18. Многие сульфиды окрашены (используется в аналитической химии)
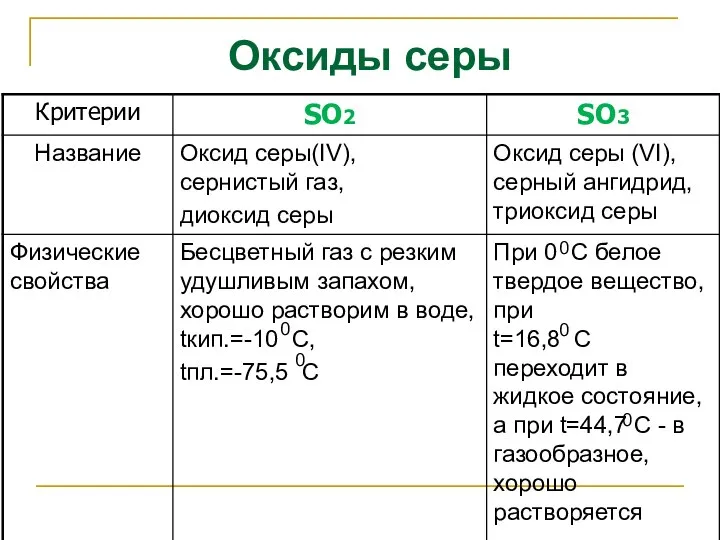
- 19. Оксиды серы 0 0 0 0 0
- 21. Скачать презентацию













 Многоатомные спирты
Многоатомные спирты Энергетика химических реакций
Энергетика химических реакций Резиновая краска
Резиновая краска Перемешивание в жидких средах
Перемешивание в жидких средах «Уксусная кислота»
«Уксусная кислота»  Інтенсивні технології вирощування дрібнокісточкових культур
Інтенсивні технології вирощування дрібнокісточкових культур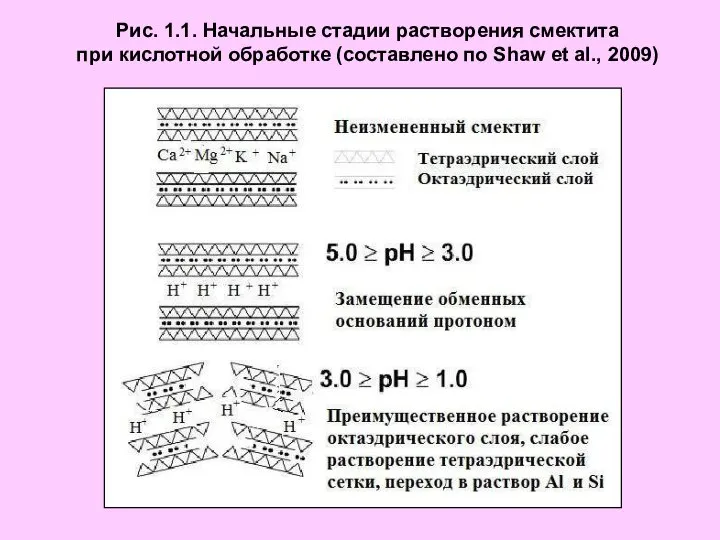 Начальные стадии растворения смектита при кислотной обработке
Начальные стадии растворения смектита при кислотной обработке Пифарнин (ribavirin)
Пифарнин (ribavirin) Динамический характер адсорбции. Лекция 2
Динамический характер адсорбции. Лекция 2 Физические и фазовые состояния полимеров
Физические и фазовые состояния полимеров Минеральные вещества
Минеральные вещества Вода: фізичні та хімічні властивості. Поширеність в природі
Вода: фізичні та хімічні властивості. Поширеність в природі Использование кислот природой и человеком
Использование кислот природой и человеком Электролиз. Задание № 20
Электролиз. Задание № 20 Магний. Электронное строение атома Mg
Магний. Электронное строение атома Mg Количество вещества
Количество вещества Газохимия. Абсорбционно-газофракционирующая установка. (Лекция 5.2)
Газохимия. Абсорбционно-газофракционирующая установка. (Лекция 5.2) Химическая кинетика. Лекция 2
Химическая кинетика. Лекция 2 Генетическая связь
Генетическая связь Группа рассеянных химических элементов
Группа рассеянных химических элементов Влияние условий хранения на качество лекарственных средств
Влияние условий хранения на качество лекарственных средств Презентация Биологическое действие радиации
Презентация Биологическое действие радиации  Органическая химия. Лекция. Стероиды
Органическая химия. Лекция. Стероиды Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Задача №9. Глицерин. Команда «Карбораны»
Задача №9. Глицерин. Команда «Карбораны» Нерівноважна термодинаміка та хімічна кінетика. Лекція 1
Нерівноважна термодинаміка та хімічна кінетика. Лекція 1 Физиология и биохимия бактерий. Дыхание и размножение микробов. Питание
Физиология и биохимия бактерий. Дыхание и размножение микробов. Питание Обзор основных методов исследования супрамолекулярных объектов
Обзор основных методов исследования супрамолекулярных объектов