Содержание
- 2. 1.Составьте электронную и графическую формулы кислорода. 2.Какие степени окисления может проявлять кислород? 3 .Что такое аллотропия?
- 3. «В древней магии присутствую при рождении огня, называют … издавна меня»
- 4. Химик синтезировал оранжево-жёлтые кристаллы нитрида неметалла состава Э4N4 и приступил к изучению его свойств. Поручив лаборанту
- 5. Сера
- 6. Цели 1. Изучить нахождение серы в природе и ее свойства. 2. Установить взаимосвязь «строение-свойства» и «свойства-применение».
- 7. Строение и свойства атома серы 1.Какое положение занимает сера в ПСХЭ Д.И.Менделеева? 2.Каков физический смысл каждого
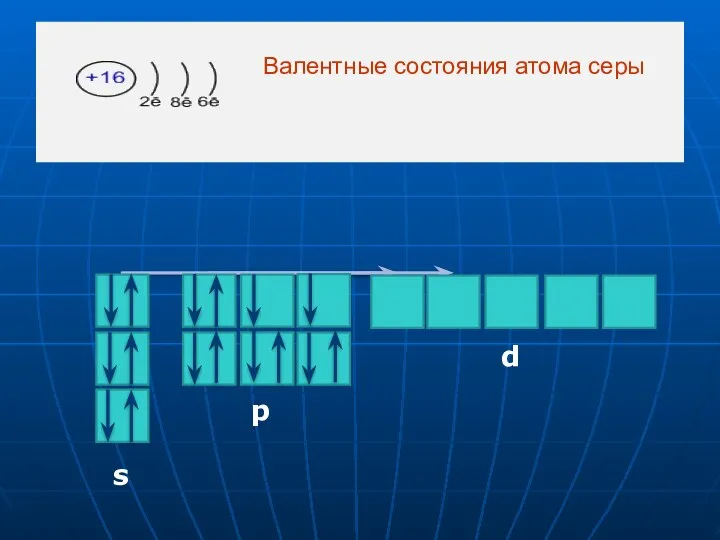
- 9. Валентные состояния атома серы s p d
- 10. Степени окисления серы
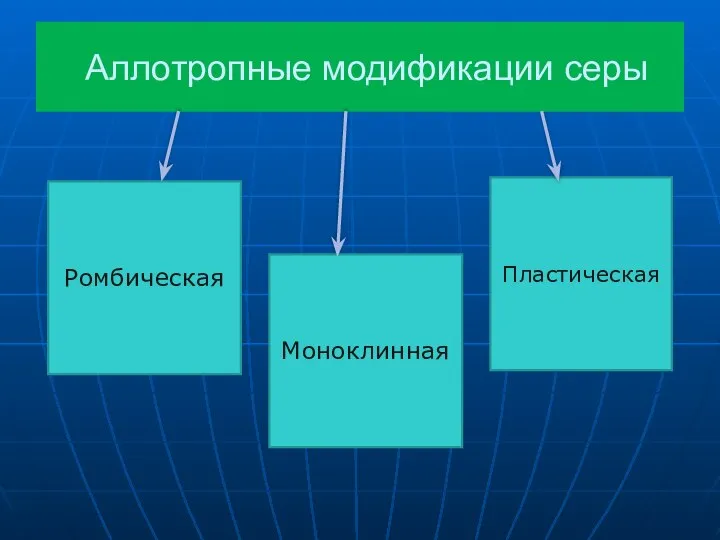
- 11. Аллотропные модификации серы Ромбическая Моноклинная Пластическая
- 12. Сера ромбическая α−Сера ромбическая или - сера, S8, твердое вещество желтого цвета, нерастворимо в воде, Тпл.
- 13. Сера моноклинная Получаются кристаллы при медленном охлаждении расплавленной серы, кристаллы длинные игольчатые, темно-желтые. Тпл.=+119,3 Устойчива при
- 14. Сера пластическая Пластическая сера- коричневая резиноподобная (аморфная) масса. Она неустойчива и через некоторое время становится хрупкой,
- 15. Сера в природе Сера довольно широко распространена в природе. В земной коре ее содержание оценивается в
- 16. В вулканических местностях часто наблюдается выделение из-под земли газа сероводорода H2S; в этих же регионах сероводород
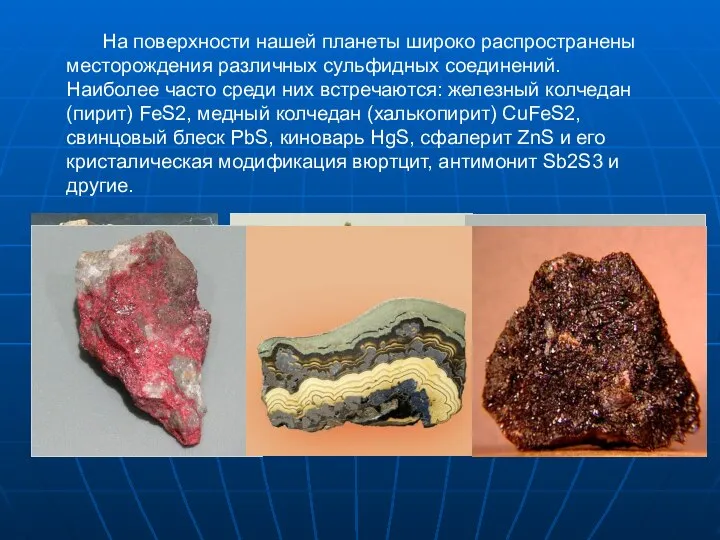
- 17. На поверхности нашей планеты широко распространены месторождения различных сульфидных соединений. Наиболее часто среди них встречаются: железный
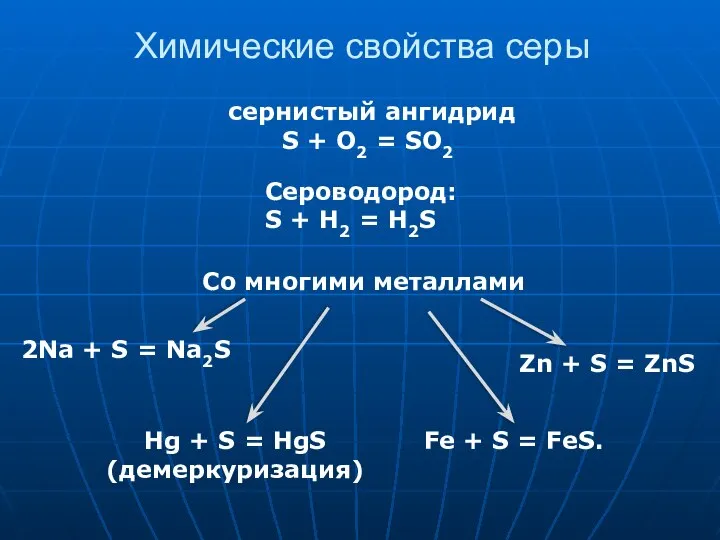
- 18. Химические свойства серы сернистый ангидрид S + O2 = SO2 Сероводород: S + H2 = H2S
- 19. Биологическая роль серы Сера является составной частью растений. Известны также бактерии, обладающие способностью вырабатывать серу. Некоторые
- 20. Диоксид серы (SO2) (диоксид серы, сернистый ангидрид) - бесцветный газ с резким запахом. Образуется в процессе
- 21. Домашнее задание Параграф 26, упражнение № 1 и № 3
- 23. Скачать презентацию
















 Оксиды. Классификация
Оксиды. Классификация Побутові хімікати Підготувала Нечай Катерина, учениця 41 групи
Побутові хімікати Підготувала Нечай Катерина, учениця 41 групи  Характеристика шкідливих хімічних речовин, забруднювачів атмосфери
Характеристика шкідливих хімічних речовин, забруднювачів атмосфери Анализ физико-химических свойств синтетических моющих средств (СМС) и их значение в жизни человека
Анализ физико-химических свойств синтетических моющих средств (СМС) и их значение в жизни человека Инструктаж Правила поведения на каникулах
Инструктаж Правила поведения на каникулах  Цікаві факти про хімію
Цікаві факти про хімію Структура периодической системы элементов
Структура периодической системы элементов Орагническая химия. Теория А.М. Бутлерова
Орагническая химия. Теория А.М. Бутлерова Предмет химии. Вещества
Предмет химии. Вещества Методы исследования наноструктурных композиционных электродов
Методы исследования наноструктурных композиционных электродов Изотопы. Химические и физические свойства
Изотопы. Химические и физические свойства Презентация по Химии "Мило" - скачать смотреть бесплатно
Презентация по Химии "Мило" - скачать смотреть бесплатно Бытовая химия в нашей жизни
Бытовая химия в нашей жизни Теоретические основы метода потенциалов самопроизвольной поляризации - ПС
Теоретические основы метода потенциалов самопроизвольной поляризации - ПС Основы молекулярно-кинетической теории и термодинамики. (Лекция 9)
Основы молекулярно-кинетической теории и термодинамики. (Лекция 9) Горение. Подводный факел
Горение. Подводный факел Полярные электронные эффекты в органических соединениях
Полярные электронные эффекты в органических соединениях Элементы триады железа: Fe, Co, Ni. (Лекция 16)
Элементы триады железа: Fe, Co, Ni. (Лекция 16) Kлассификация органических соединений. Углеводороды (алканы, алкены, алкины) лекция 1.2
Kлассификация органических соединений. Углеводороды (алканы, алкены, алкины) лекция 1.2 КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КУБАНСКИЙ МЕДИЦИНСКИЙ ИНСТИТУТ КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ БИОХИМ
КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КУБАНСКИЙ МЕДИЦИНСКИЙ ИНСТИТУТ КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ БИОХИМ Водород в космосе
Водород в космосе В мире кристаллов
В мире кристаллов Закономерности процессов тепло- и газообмена на пожаре
Закономерности процессов тепло- и газообмена на пожаре Правила поведения в кабинете химии
Правила поведения в кабинете химии Теория химического строения органических соединений А.М. Бутлерова
Теория химического строения органических соединений А.М. Бутлерова Получение препаратов алкалоидов
Получение препаратов алкалоидов Химия плутония, америция и трансамерициевых актиноидов
Химия плутония, америция и трансамерициевых актиноидов Презентация по Химии "«Подгруппа углерода»" - скачать смотреть
Презентация по Химии "«Подгруппа углерода»" - скачать смотреть