Содержание
- 2. Цели занятия Назад Учебная: добиться прочного усвоения системы знаний, сформировать умение объяснять факты на основе причинно-следственных
- 3. Введение Электронный дидактический материал на тему: «Сера. Важнейшие соединения серы» предназначен для проведения теоретического занятия и
- 4. Требования к студентам Назад После изучения темы «Сера. Важнейшие соединения серы» студент должен знать: общую характеристику
- 5. Актуальность Назад В группе VIA к широко известным химическим элементам относится сера. В фармации применяются сера
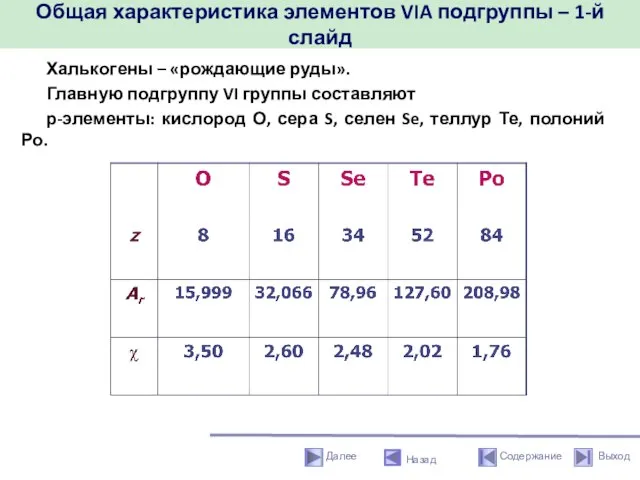
- 6. Общая характеристика элементов VIA подгруппы – 1-й слайд Халькогены – «рождающие руды». Главную подгруппу VI группы
- 7. Сера в природе – 1-й слайд Сера широко распространена в природе и встречается как в свободном
- 8. Сера в природе (продолжение) Назад Пирит Халькозин Ковелин Халькопирит Гипс Мирабилит
- 9. Сера в природе (окончание) Назад Содержание серы в земной коре составляет 0,0048 %. Много соединений серы
- 10. Физические свойства серы Назад Сера - твердое хрупкое вещество желтого цвета, в воде практически нерастворима, не
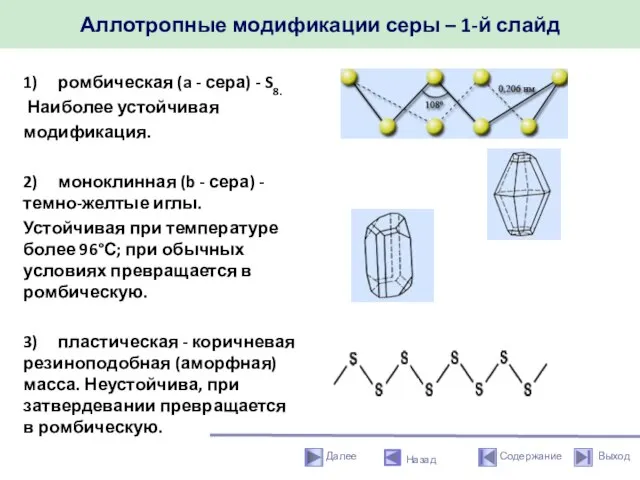
- 11. Аллотропные модификации серы – 1-й слайд Назад 1) ромбическая (a - сера) - S8. Наиболее устойчивая
- 12. Аллотропные модификации серы (окончание) Назад
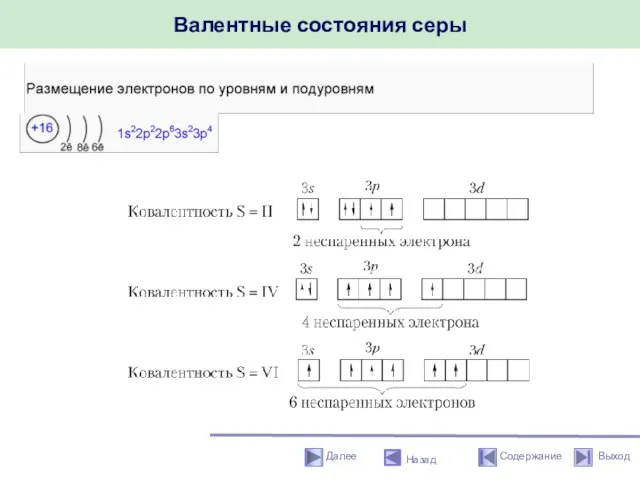
- 13. Валентные состояния серы Назад
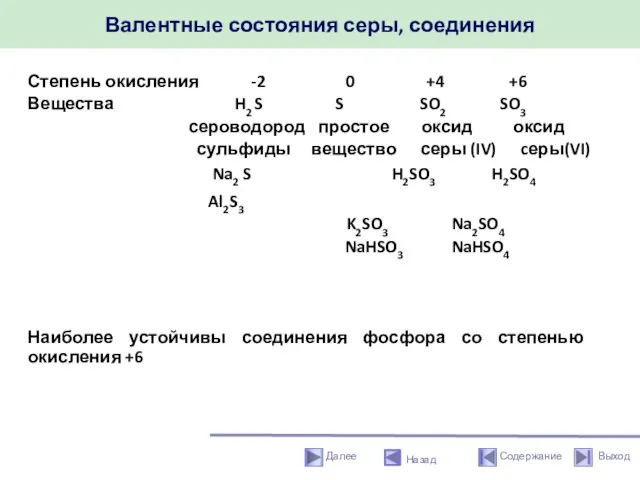
- 14. Валентные состояния серы, соединения Назад Степень окисления -2 0 +4 +6 Вещества H2 S S SO2
- 15. Получение серы Назад 1. При нагревании пирита без доступа воздуха FeS2 → FeS + S. 2.
- 16. Химические свойства серы 1-й слайд Назад При комнатной температуре сера вступает в реакции только с ртутью.
- 17. Химические свойства серы (продолжение) Назад Окислительные свойства серы (S0 + 2ē → S-2) 1) Сера реагирует
- 18. Химические свойства серы (продолжение) Назад С некоторыми неметаллами сера образует бинарные соединения. 2)Взаимодействие с водородом происходит
- 19. Химические свойства серы (продолжение) Назад Восстановительные свойства сера проявляет в реакциях с сильными окислителями: (S -
- 20. Химические свойства серы (окончание) Назад 7)Сера способна к реакциям диспропорционирования, при взаимодействии со щелочью образуются сульфиды
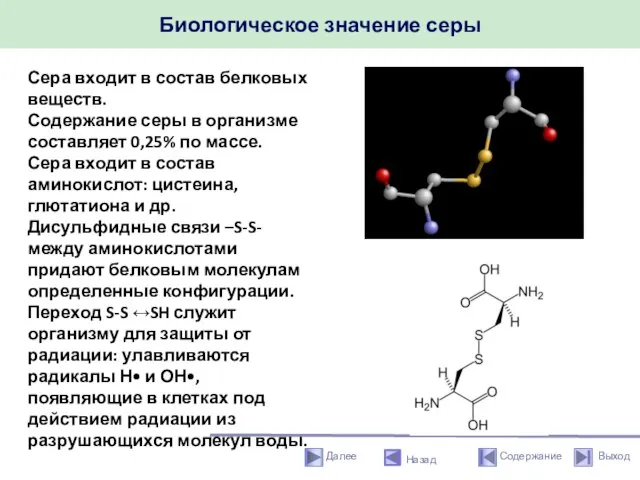
- 21. Биологическое значение серы Назад Сера входит в состав белковых веществ. Содержание серы в организме составляет 0,25%
- 22. Сероводород Назад Строение молекулы сероводорода H2S аналогично строению молекулы воды, однако в отличие от воды молекулы
- 23. Физические свойства сероводорода Назад При обычных условиях сероводород – бесцветный газ, с сильным характерным запахом тухлых
- 24. Химические свойства сероводорода -1-й слайд Назад 1)В водном растворе сероводород обладает свойствами слабой двухосновной кислоты: H2S
- 25. Химические свойства сероводорода (продолжение) Назад 3)Сероводород обладает восстановительными свойствами. В зависимости от условий сероводород может окисляться
- 26. Химические свойства сероводорода (продолжение) Назад Взаимодействие сероводорода с сернистым газом используется для получения серы из отходящих
- 27. Получение сероводорода Назад 1)Реакция разбавленной соляной кислоты с сульфидом железа (II) FeS + 2HCl = FeCl2
- 28. Сероводородная кислота и её соли Назад Сероводородной кислоте присущи все свойства слабых кислот. Она реагирует с
- 29. Получение сульфидов Назад 1)Прямое взаимодействие простых веществ при нагревании в инертной атмосфере Fe + S =
- 30. Химические свойства сульфидов Назад 1)Растворимые сульфиды в воде сильно гидролизованны, имеют щелочную среду: Na2S + H2O
- 31. Токсичность сероводорода Назад На воздухе сероводород воспламеняется около 300 °С. Взрывоопасны его смеси с воздухом, содержащие
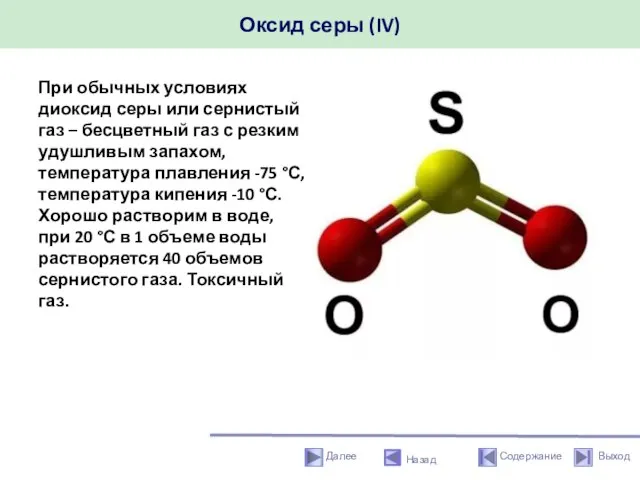
- 32. Оксид серы (IV) Назад При обычных условиях диоксид серы или сернистый газ – бесцветный газ с
- 33. Получение оксида серы (IV) Назад Получение: 1)Сжигание серы на воздухе S + O2 = SO2. 2)Окисление
- 34. Химические свойства оксида серы (IV) – 1-й слайд Назад 1)Сернистый газ обладает высокой реакционной способностью. Диоксид
- 35. Химические свойства оксида серы (IV) - окончание Назад 3)Для сернистого газа характерна окислительно-восстановительная двойственность, например, он,
- 36. Химические свойства сульфитов Назад 1)Растворимые сульфиты сильно гидролизуются: Na2SO3 + H2O = NaHSO3 + NaOH SO32-
- 37. Соединения серы (VI) Назад Степень окисления +6 для серы является довольно устойчивой и проявляется в соединениях
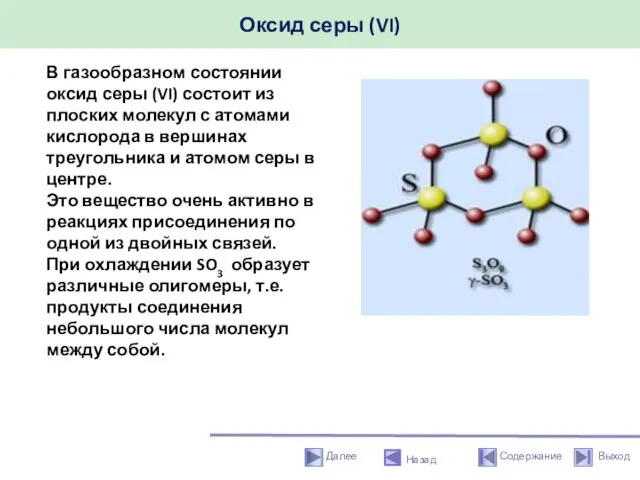
- 38. Оксид серы (VI) Назад В газообразном состоянии оксид серы (VI) состоит из плоских молекул с атомами
- 39. Получение оксида серы (VI) Назад Получение оксида серы (VI) 1)В промышленности производится в огромных масштабах с
- 40. Химические свойства оксида серы (VI) Назад 1)Серный ангидрит термически неустойчив. Его разложение начинается при 450 °С,
- 41. Химические свойства оксида серы (VI) Назад 3)Проявляет свойства типичного кислотного оксида : SO3 + CaO =
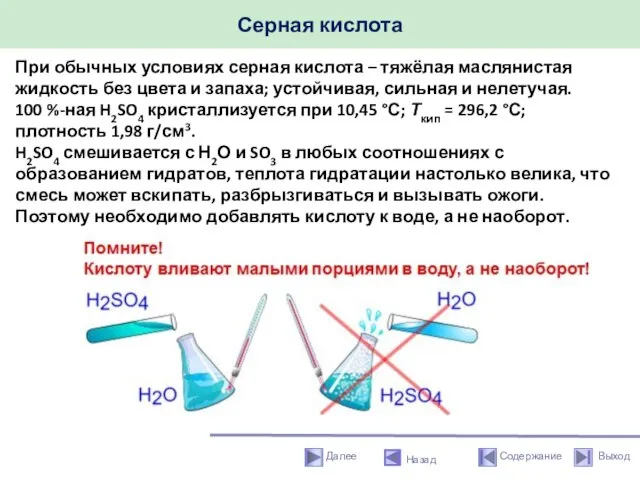
- 42. Серная кислота Назад При обычных условиях серная кислота – тяжёлая маслянистая жидкость без цвета и запаха;
- 43. Химические свойства оксида серы (VI) Назад 1)В водном растворе серная кислота диссоциирует, образуя ион водорода и
- 44. Химические свойства оксида серы (VI) Назад Концентрированная кислота («купоросное масло») обладает окислительными свойствами. Возможные продукты взаимодействия
- 45. Химические свойства оксида серы (VI) Назад Концентрированная серная кислота при обычной температуре со многими металлами не
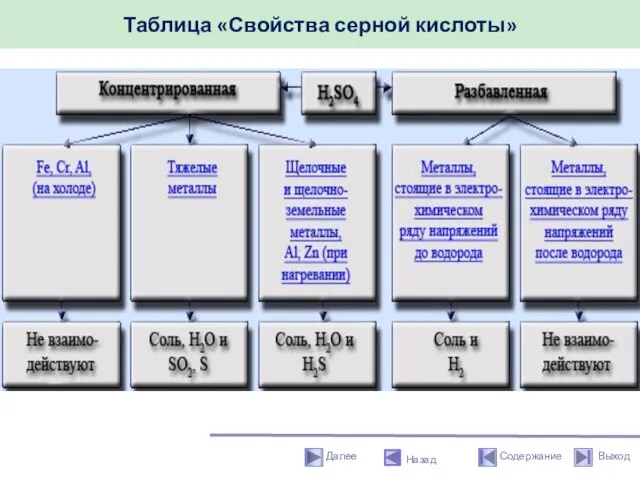
- 46. Таблица «Свойства серной кислоты» Назад
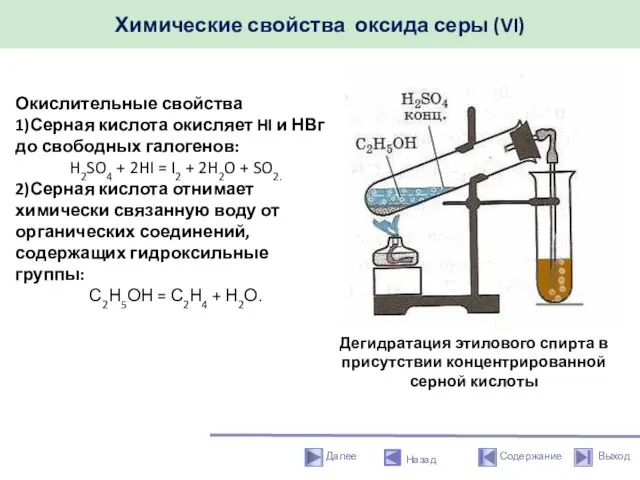
- 47. Химические свойства оксида серы (VI) Назад Окислительные свойства 1)Серная кислота окисляет HI и НВг до свободных
- 48. Химические свойства оксида серы (VI) Назад Окислительные свойства Обугливание сахара, целлюлозы, крахмала и др. углеводов при
- 49. Соли серной кислоты Назад Серная кислота, будучи двухосновной, образует два ряда солей: средние, называемые сульфатами, и
- 50. Соли серной кислоты Назад Большинство солей серной кислоты растворимо в воде. Соли СаSO4и РbSO4мало растворимы в
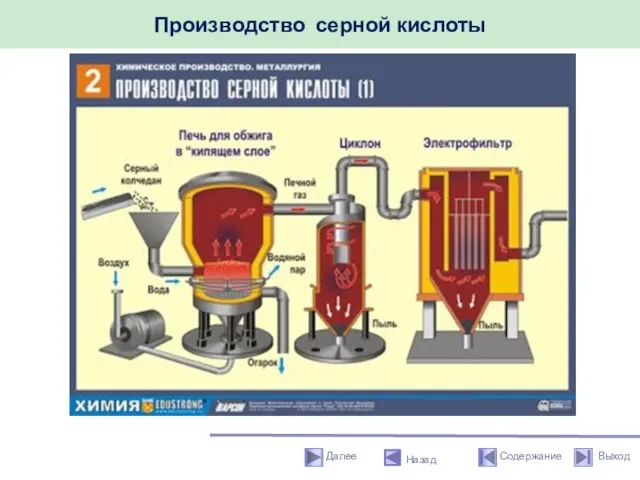
- 51. Производство серной кислоты Назад
- 52. Производство серной кислоты Назад ПЕРВАЯ СТАДИЯ - обжиг пирита в печи для обжига в "кипящем слое".
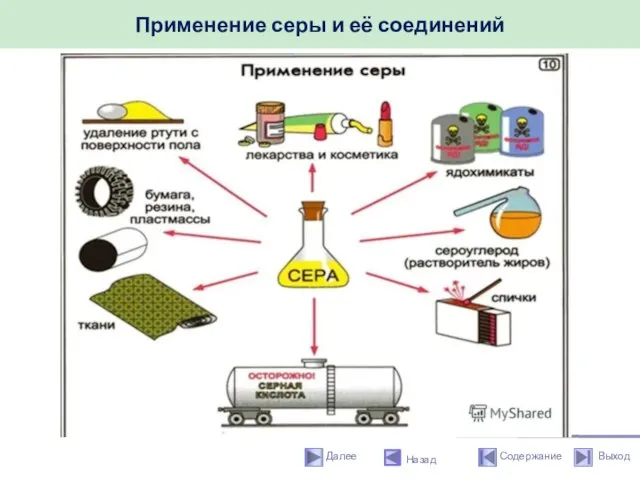
- 53. Применение серы и её соединений Назад Серу используют для производства серной кислоты, изготовления спичек, черного пороха,
- 54. Применение серы и её соединений Назад
- 55. Применение серной кислоты Назад Серная кислота – один из важнейших продуктов основной химической промышленности. Служит электролитом
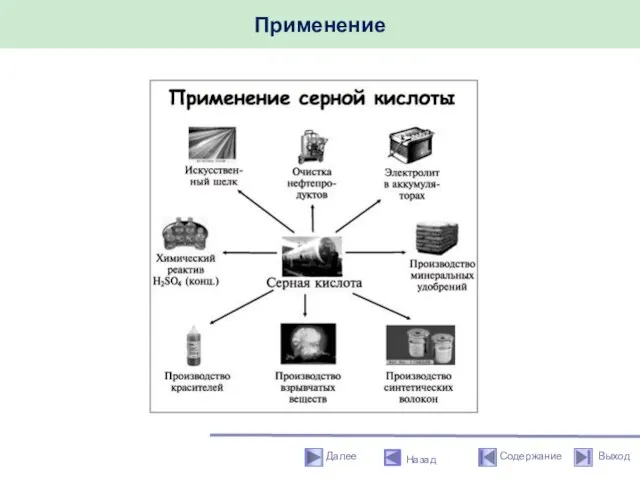
- 56. Применение Назад
- 57. Тиосерная кислота. Тиосульфат натрия. Назад Н2S2O3 – тиосерная кислота Содержит серу в разных степенях окисления S+4
- 58. Тиосерная кислота. Тиосульфат натрия. Назад Физические свойства натрия тиосульфата - белое кристаллическое вещество, хорошо растворяется в
- 60. Скачать презентацию












































 Основи біохімії. (Лекція 1)
Основи біохімії. (Лекція 1) Gmp – тиісті өндірістік тәжірибе
Gmp – тиісті өндірістік тәжірибе Алмаз. Внутренняя структура алмаза
Алмаз. Внутренняя структура алмаза Устойчивость и коагуляция коллоидных систем
Устойчивость и коагуляция коллоидных систем Витамин В
Витамин В Циклоалканы
Циклоалканы Растворы
Растворы Презентация по Химии "Вода для жизни!" - скачать смотреть бесплатно
Презентация по Химии "Вода для жизни!" - скачать смотреть бесплатно ХРОМ Учитель химии МБОУ лицей №1 г. Волжский Волгоградская область Солдатова Татьяна Михайловна.
ХРОМ Учитель химии МБОУ лицей №1 г. Волжский Волгоградская область Солдатова Татьяна Михайловна. Определение площади поверхности и пористости материалов методом сорбции газов
Определение площади поверхности и пористости материалов методом сорбции газов 10 класс семинар-написание формул органических веществ
10 класс семинар-написание формул органических веществ Аминокислоты
Аминокислоты Электролитическая диссоциация
Электролитическая диссоциация Моторные масла
Моторные масла Углерод и его соединения Лекция.(§29 -30, с.172 -178). Цель: Какие соединения образует углерод? Какие свойства, связанные со строением атома углерода, характерны для углерода и его соединений? Где находят применение соединения углерода?
Углерод и его соединения Лекция.(§29 -30, с.172 -178). Цель: Какие соединения образует углерод? Какие свойства, связанные со строением атома углерода, характерны для углерода и его соединений? Где находят применение соединения углерода? Петрография некоторых распространенных метаморфических пород
Петрография некоторых распространенных метаморфических пород Мас-спектр кластерів вуглецю
Мас-спектр кластерів вуглецю Лекарственные формы для глаз в условиях аптечного производства
Лекарственные формы для глаз в условиях аптечного производства Фізичні властивості етилену й ацетилену. Отримання алкенів та алкінів. Хімічні властивості: відношення до розчинів кислот, л
Фізичні властивості етилену й ацетилену. Отримання алкенів та алкінів. Хімічні властивості: відношення до розчинів кислот, л Основы теории энергетических зон кристаллов. Волны Блоха
Основы теории энергетических зон кристаллов. Волны Блоха Простые вещества неметаллы
Простые вещества неметаллы Физические и химические свойства воды
Физические и химические свойства воды Відносна молекулярна маса. Масова частка елемента в складній речовині
Відносна молекулярна маса. Масова частка елемента в складній речовині Метаболизм углеводов
Метаболизм углеводов Образование раствора
Образование раствора Обмен нуклеотидов
Обмен нуклеотидов Презентация по Химии "Адсорбція" - скачать смотреть бесплатно
Презентация по Химии "Адсорбція" - скачать смотреть бесплатно Домашняя аптечка исследовательская работа Авторы: Полынникова Анастасия, Савина Мария учащиеся 9 «Б» класса Руководитель: Ма
Домашняя аптечка исследовательская работа Авторы: Полынникова Анастасия, Савина Мария учащиеся 9 «Б» класса Руководитель: Ма