Содержание
- 2. 1. ОПРЕДЕЛЕНИЕ. Щелочные металлы – это металлы главной подгруппы I группы.К ним относятся литий, натрий, калий,
- 3. НАТРИЙ
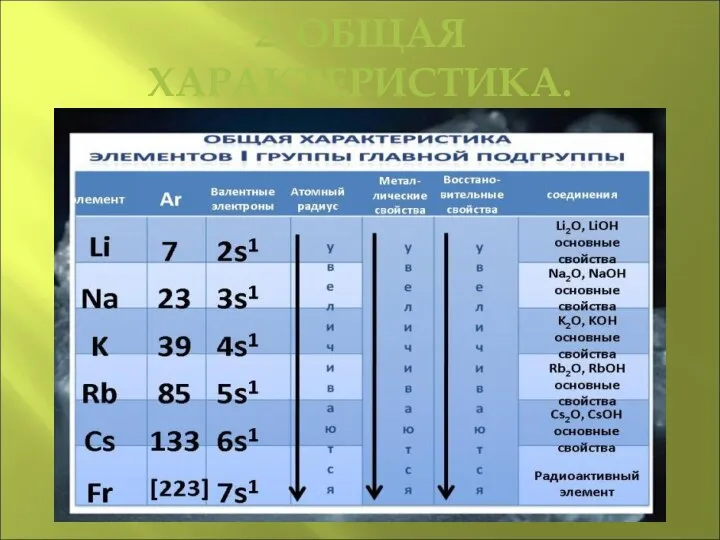
- 4. 2. ОБЩАЯ ХАРАКТЕРИСТИКА.
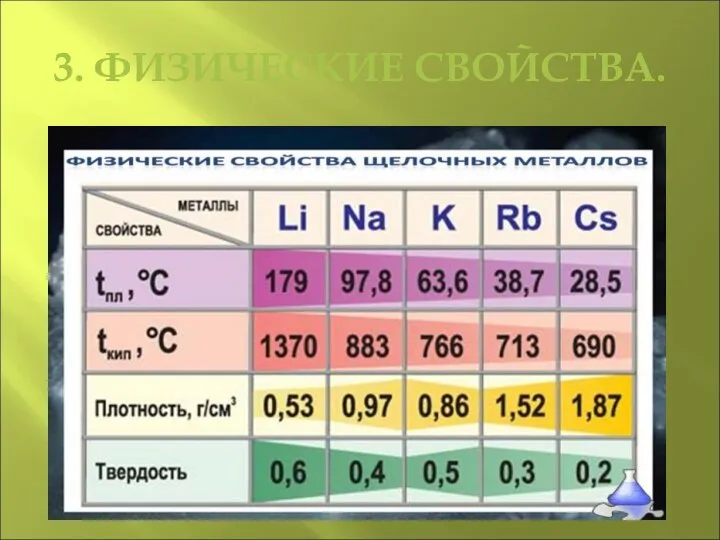
- 5. 3. ФИЗИЧЕСКИЕ СВОЙСТВА.
- 6. 4. ХИМИЧЕСКИЕ СВОЙСТВА. Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, азоту их
- 7. а) Ваимодействие с водой. Взаимодействие с водой. Важное свойство щелочных металлов — их высокая активность по
- 8. б) Взаимодействие с кислородом. Взаимодействие с кислородом. Продукты горения щелочных металлов на воздухе имеют разный состав
- 9. Формула кислородного соединения Li2O Белый Na2O Белый K2O Желтоватый Rb2O Жёлтый Cs2O Оранжевый Na2O2 Светло-жёлтый KO2
- 10. в) Получение оксидов. Для получения оксидов натрия и калия нагревают смеси гидроксида, пероксида или надпероксида с
- 11. г) Взаимодействие с другими веществами. Щелочные металлы реагируют со многими неметаллами. При нагревании они соединяются с
- 12. Щелочные металлы растворяются в жидком аммиаке и его производных — аминах и амидах: При растворении в
- 13. Щелочные металлы взаимодействуют с органическими веществами спиртами (с образованием алкоголятов) и карбоновыми кислотами (с образованием солей):
- 14. 5. Получение щелочных металлов. 1. Для получения щелочных металлов используют в основном электролиз расплавов их галогенидов,
- 15. ИНТЕРЕСНЫЕ ФАКТЫ. ДЛЯ ЧЕГО НУЖЕН ЦИАНИСТЫЙ КАЛИЙ? Для извлечения золота и серебра из руд. Для гальванического
- 16. Цезий и давление Все щелочные металлы сильно изменяются под действием высокого давления. Но именно цезий реагирует
- 18. Скачать презентацию













 Презентація на тему “Дмитро Іванович Менделєєв”
Презентація на тему “Дмитро Іванович Менделєєв”  Сера и её свойства
Сера и её свойства Анализ пригодности природной воды в качестве питьевой по формуле М.Г. Курлова
Анализ пригодности природной воды в качестве питьевой по формуле М.Г. Курлова Горные породы
Горные породы Основные классы неорганических веществ
Основные классы неорганических веществ Коррозия металлов
Коррозия металлов Кислотность и основностьорганических соединений
Кислотность и основностьорганических соединений Вуглеводи. Класифікація вуглеводів
Вуглеводи. Класифікація вуглеводів Регуляция водно-солевого обмена. Обмен кальция и фосфора. Регуляция. (Тема 5)
Регуляция водно-солевого обмена. Обмен кальция и фосфора. Регуляция. (Тема 5) Вуглеводи
Вуглеводи Любимый Алюминий
Любимый Алюминий Электрометрические методы анализа ЛВ. Термографические методы
Электрометрические методы анализа ЛВ. Термографические методы Галогены
Галогены Углеводы. Химические свойства
Углеводы. Химические свойства X-Ray Diffraction in Biology (XRD). Физический принцип кристаллографии
X-Ray Diffraction in Biology (XRD). Физический принцип кристаллографии КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ  Презентация по Химии "Генетические связи между классами неорганических веществ" - скачать смотреть бесплатно
Презентация по Химии "Генетические связи между классами неорганических веществ" - скачать смотреть бесплатно Человек в мире веществ, материалов и химических реакций. Химия и пища. Муниципальное бюджетное общеобразовательное учреждение
Человек в мире веществ, материалов и химических реакций. Химия и пища. Муниципальное бюджетное общеобразовательное учреждение  Анализ ЕГЭ по химии 2011
Анализ ЕГЭ по химии 2011 Презентация по Химии "Простые вещества - неметаллы." - скачать смотреть бесплатно_
Презентация по Химии "Простые вещества - неметаллы." - скачать смотреть бесплатно_ Химическая посуда и её назначение (3)
Химическая посуда и её назначение (3) Философы химии Кант и Гегель
Философы химии Кант и Гегель Презентация АТОМНАЯ ЭНЕРГЕТИКА
Презентация АТОМНАЯ ЭНЕРГЕТИКА Химиялық элементтердің тірі және өлі табиғатта таралуы
Химиялық элементтердің тірі және өлі табиғатта таралуы Презентация по Химии "Свойства полимеров" - скачать смотреть бесплатно
Презентация по Химии "Свойства полимеров" - скачать смотреть бесплатно Обобщение и систематизация знаний по теме «Спирты и фенолы»
Обобщение и систематизация знаний по теме «Спирты и фенолы» Органические производные пятивалентного фосфора. Способы получения
Органические производные пятивалентного фосфора. Способы получения Основные понятия органической химии
Основные понятия органической химии