Содержание
- 2. Введение Сложные эфиры или эстеры — производные кислородных кислот (как карбоновых, так и неорганических), имеющих общую
- 3. Цель Целью данной работы является исследование сложных эфиров, Цели и способы применения, проанализировать значимость эфиров для
- 4. Данная цель требует решения следующих задач: Изучить сложные эфиры Узнать, где они применятся Узнать, как их
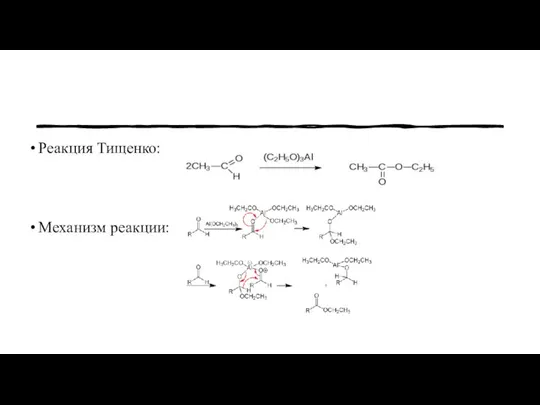
- 5. Основная часть История открытия сложных эфиров Вячеслав Евгеньевич Тищенко в1906 году открыл реакцию сложноэфирной конденсации, или
- 6. Реакция Тищенко: Механизм реакции:
- 7. Физические свойства Сложные эфиры низших карбоновых кислот и простейших спиртов - бесцветные летучие жидкости, часто с
- 8. Высшие карбоновые кислоты Примеры предельных высших жирных кислот: 1. Каприновая кислота - C9H19COOH, 2. Лауриновая кислота
- 9. Изомерия 1. Изомерия углеродной цепи начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку –
- 10. Номенклатура По систематической номенклатуре сложные эфиры называют, прибавляя в качестве приставки название спиртового радикала к названию
- 11. Способы получения 1. Сложные эфиры могут быть получены при взаимодействии карбоновых кислот со спиртами (реакция этерификации).
- 12. 3. Взаимодействие солей кислот с алкилгалогенидами. 4. Присоединение карбоновых кислот к алкенам в условиях кислотного катализа.
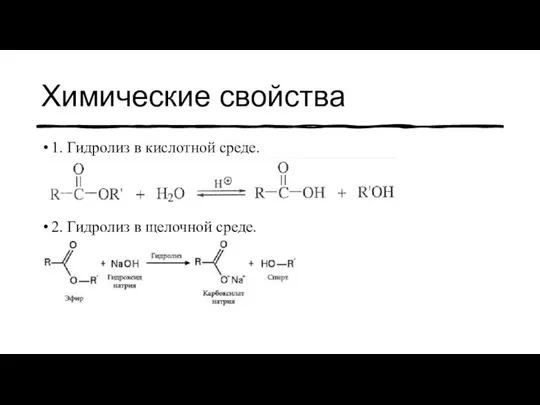
- 13. Химические свойства 1. Гидролиз в кислотной среде. 2. Гидролиз в щелочной среде.
- 14. 3. Горение 4. Реакция гидрирования (восстановления)
- 15. Жиры Жиры-это сложные эфиры трёхатомного спирта (триглицерида) и высших жирных карбоновых кислот
- 16. Классификация 1. По однородности кислотных остатков. где R,R1,R2 это одна я та же карбоновая кислота 2.
- 17. Способы получения Реакция Бертло Где R – это высшие жирные карбоновые кислоты
- 18. Химические свойства 1. Гидролиз жиров 2. Щелочной гидролиз
- 19. 3. Гидрогалогенизация(характерна для жидких жиров) 4. Обесцвечивание бромной воды.
- 20. Мыла Мыла-это соли жирных кислот, включающие ионы щелочных металлов. Соли Na –твёрдое мыло Соли K- жидкое
- 21. Способы получения Вместо Naoh можно брать Koh
- 22. Способы применения сложных эфиров 1. Лаки, краски, клеи. 2. Лекарственные средства 3. Напитки и кондитерские изделия
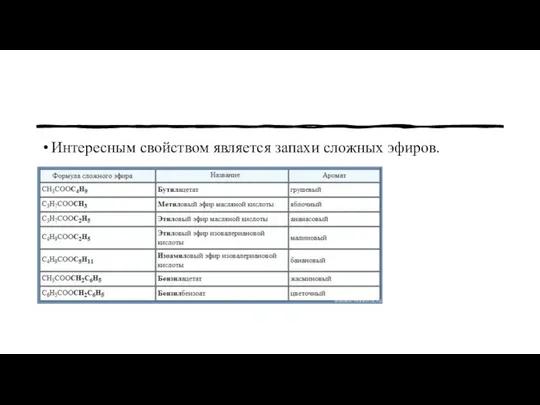
- 23. Интересным свойством является запахи сложных эфиров.
- 25. Скачать презентацию



















 Степень окисления
Степень окисления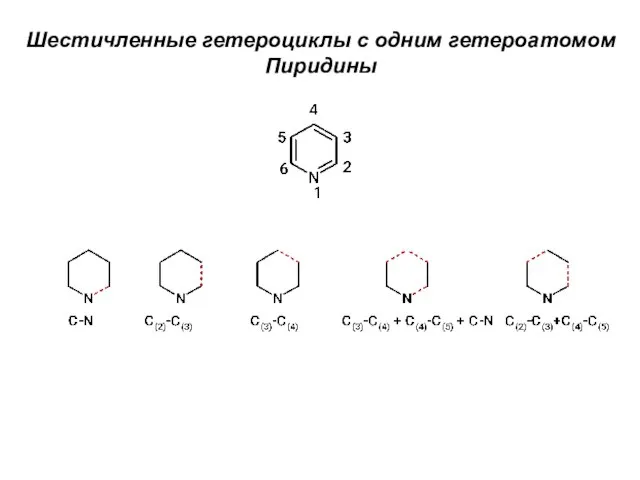 Шестичленные гетероциклы с одним гетероатомом. Пиридины
Шестичленные гетероциклы с одним гетероатомом. Пиридины Аскорбиновая кислота. Глютаминовая кислота. Кислота аминокапроновая
Аскорбиновая кислота. Глютаминовая кислота. Кислота аминокапроновая Коллигативные свойства растворов
Коллигативные свойства растворов Выделение нефтегазоматеринских пород по данным пиролиза. Построение геохимического разреза
Выделение нефтегазоматеринских пород по данным пиролиза. Построение геохимического разреза Переваривание углеводов в пищеварительном тракте. Гликолиз. Окислительное декарбоксилирование пирувата. (Тема 6)
Переваривание углеводов в пищеварительном тракте. Гликолиз. Окислительное декарбоксилирование пирувата. (Тема 6) Ароматические углеводороды. Гомологический ряд, изомерия
Ароматические углеводороды. Гомологический ряд, изомерия Презентация по Химии "Презентація на тему : «Нітратні добрива в продукції СГ. Їх вплив на наше здоров’я»" - скачать смотреть бе
Презентация по Химии "Презентація на тему : «Нітратні добрива в продукції СГ. Їх вплив на наше здоров’я»" - скачать смотреть бе Электролиз
Электролиз Амінокислоти
Амінокислоти Нанокомпозиционный материал на основе фенолоформальдегидной смолы, эпоксидной смолы, полистирола
Нанокомпозиционный материал на основе фенолоформальдегидной смолы, эпоксидной смолы, полистирола Топливо и его химические реакции при сгорании
Топливо и его химические реакции при сгорании Строение электронных оболочек атомов
Строение электронных оболочек атомов Изучение работы массспектрометрических приборов. Анализ остаточных газов
Изучение работы массспектрометрических приборов. Анализ остаточных газов Металлические элементы группы IA. ЛИТИЙ. Работу выполнила: Ученица 11 класса Иванова Ксения
Металлические элементы группы IA. ЛИТИЙ. Работу выполнила: Ученица 11 класса Иванова Ксения Превращение веществ
Превращение веществ Источники сырья для производства полимера полиуретана, области применения, его свойства, объемы его производства
Источники сырья для производства полимера полиуретана, области применения, его свойства, объемы его производства Загрязнение почв пестицидами. Проблемы и решения
Загрязнение почв пестицидами. Проблемы и решения Electrochemistry. (Chapter 6)
Electrochemistry. (Chapter 6) Використання нафтопродуктів
Використання нафтопродуктів  Общая и неорганическая химия
Общая и неорганическая химия Получение гидроген хлорида
Получение гидроген хлорида Электролит және бейэлектролит ерітінділерінің коллигативтік қасиеттері
Электролит және бейэлектролит ерітінділерінің коллигативтік қасиеттері Аммиак. Строение атома азота
Аммиак. Строение атома азота Ионное уравнения
Ионное уравнения Общие закономерности реакций спиртов
Общие закономерности реакций спиртов Структурный тип
Структурный тип Свойства ртути
Свойства ртути