Содержание
- 2. Оксид серы (VI).
- 3. Физические свойства серной кислоты. Безводная серная кислота - это бесцветная маслянистая жидкость без запаха, смешивается с
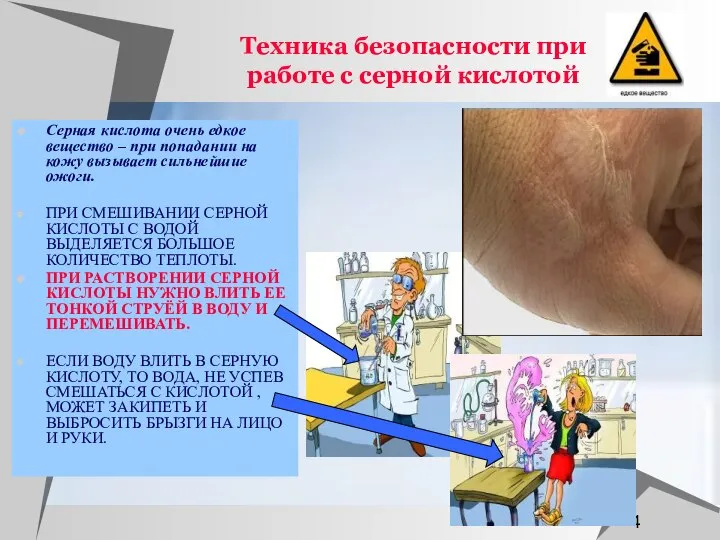
- 4. Техника безопасности при работе с серной кислотой Серная кислота очень едкое вещество – при попадании на
- 5. Химические свойства серной кислоты. Выберите, с какими из перечисленных веществ реагирует разбавленная серная кислота: серебро, алюминий,
- 6. Раствор серной кислоты взаимодействует с металлами , стоящими в ряду активности до водорода. Ag + H2SO4
- 7. Раствор серной кислоты взаимодействует с основными и амфотерными оксидами. МnO + H2SO4 = MnSO4 + H2O
- 8. Серная кислота взаимодействует с основаниями и амфотерными гидроксидами. 2КOН + H2SO4 = К2SO4 + 2H2O сульфат
- 9. Серная кислота взаимодействует с солями, если образуется газ или осадок. FeS + H2SO4 =FeSO4 +H2S FeS
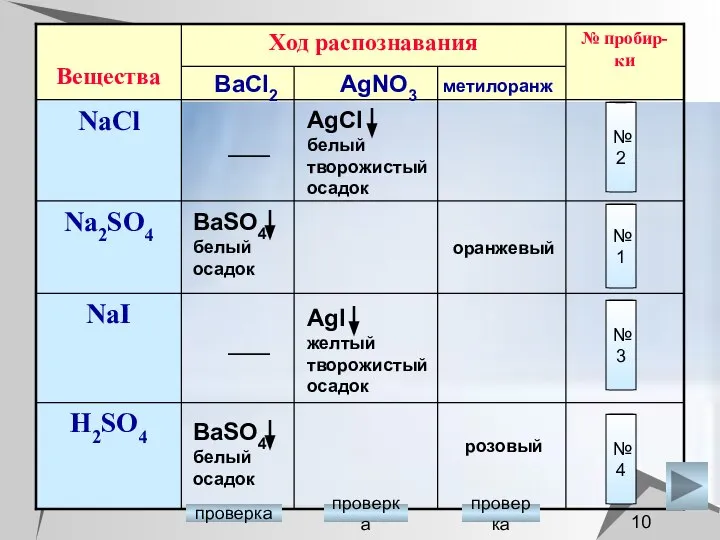
- 10. №2 №1 №3 №4 BaCl2 AgNO3 метилоранж BaSO4 белый осадок BaSO4 белый осадок AgCl белый творожистый
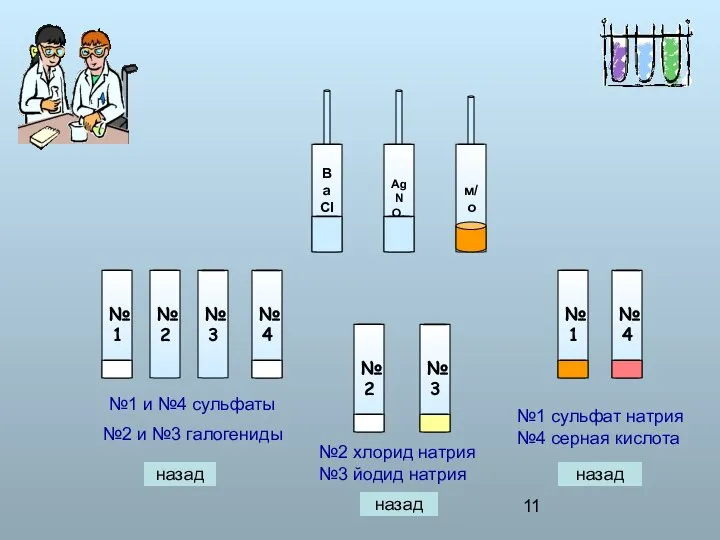
- 11. №1 №3 №2 №4 BaCl2 AgNO3 м/о №1 и №4 сульфаты №2 и №3 галогениды №1
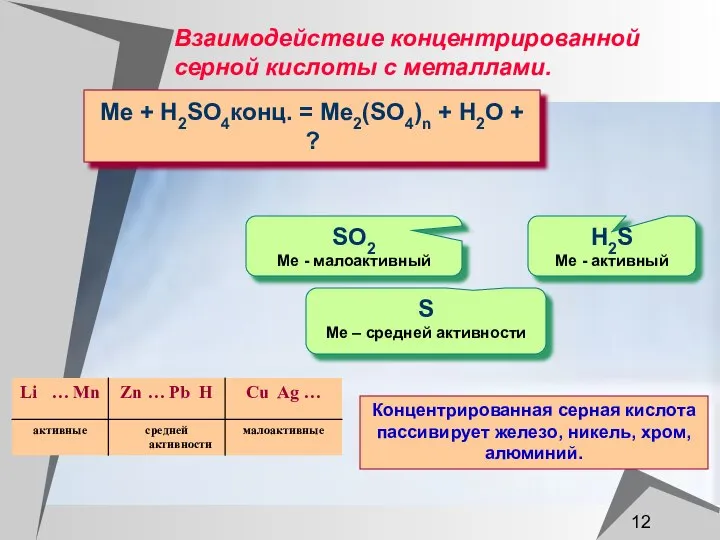
- 12. Взаимодействие концентрированной серной кислоты с металлами. Me + H2SO4конц. = Me2(SO4)n + H2O + ? S
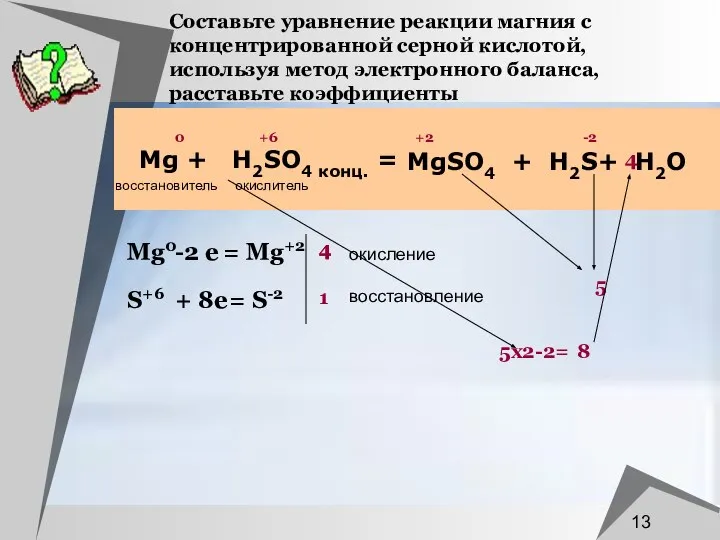
- 13. Составьте уравнение реакции магния с концентрированной серной кислотой, используя метод электронного баланса, расставьте коэффициенты Mg +
- 14. Составьте уравнение реакции меди с концентрированной серной кислотой, используя метод электронного баланса, расставьте коэффициенты Cu +
- 15. Производство серной кислоты Производство H2SO4 в мире неуклонно растет. Так, в период с 2000 по 2005
- 16. Серная кислота используется для получения фосфорных и азотных удобрений: простого суперфосфата, двойного суперфосфата, преципитата и сернокислого
- 17. Применение серной кислоты в металлургии «Травление» – обнаружение трещин на поверхности металлов. В гальванических цехах серную
- 18. Серная кислота используется в качестве электролита в автомобильных аккумуляторах.
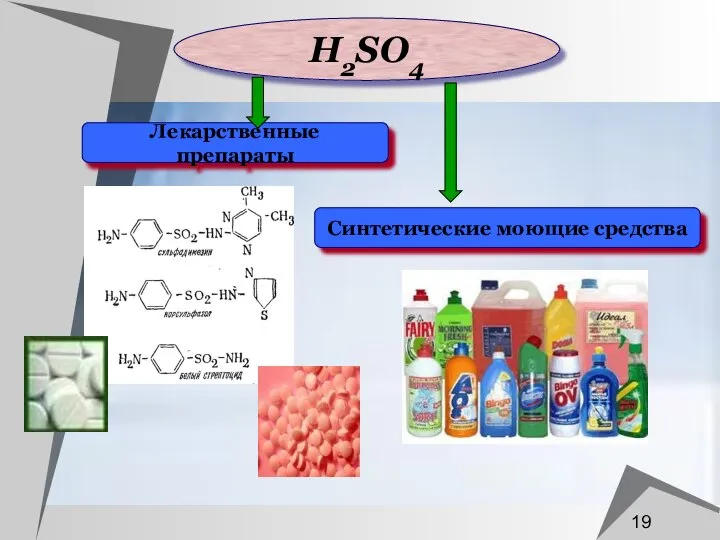
- 19. H2SO4 Лекарственные препараты Синтетические моющие средства
- 20. Вулкан Малый Семячик Вулканический хребет длиной около 3 км., на гребне которого имеются три кратера. В
- 22. Скачать презентацию













 Щелочные металлы
Щелочные металлы Винная кислота
Винная кислота Презентация по Химии "Горение кислорода" - скачать смотреть
Презентация по Химии "Горение кислорода" - скачать смотреть  Амины - производные аммиака
Амины - производные аммиака Минерал гранат
Минерал гранат Живопись Англии 17 века
Живопись Англии 17 века  Алканы
Алканы Галогены. Хлор
Галогены. Хлор Конструкционные материалы на основе легких металлов: сплавы алюминия
Конструкционные материалы на основе легких металлов: сплавы алюминия Барометр – анероид. Атмосферное давление на различных высотах. Манометры
Барометр – анероид. Атмосферное давление на различных высотах. Манометры Тест по неорганической химии
Тест по неорганической химии Использование химии в медицине
Использование химии в медицине Кремний және оның қосылыстары
Кремний және оның қосылыстары Эрбий. Жалпы сипаттамасы
Эрбий. Жалпы сипаттамасы Анод + Катод = Электролиз Выполнил: ученик 11М класса МОУ лицея №6 Аббязов Эрик
Анод + Катод = Электролиз Выполнил: ученик 11М класса МОУ лицея №6 Аббязов Эрик Азотсодержащие органические соединения
Азотсодержащие органические соединения Моделирование фазовых систем. Тройные взаимные системы
Моделирование фазовых систем. Тройные взаимные системы Факторы, влияющие на смещение химического равновесия (концентрация реагентов, температура, давление )
Факторы, влияющие на смещение химического равновесия (концентрация реагентов, температура, давление ) Гетероорганические углеводороды нефти и асфальто-смолистые вещества
Гетероорганические углеводороды нефти и асфальто-смолистые вещества Поверхностные явления
Поверхностные явления Кондуктометрия. Приборы кондуктометрии. Достоинства метода. Классификация
Кондуктометрия. Приборы кондуктометрии. Достоинства метода. Классификация Химические реакции. Реакции по тепловому эффекту
Химические реакции. Реакции по тепловому эффекту МОУ «Средняя школа № 14» г. Кимры Тверской Области урок химии в 11 классе Учитель: Иванова Ирина Викторовна
МОУ «Средняя школа № 14» г. Кимры Тверской Области урок химии в 11 классе Учитель: Иванова Ирина Викторовна  Кислородсодержащие органические соединения. Спирты. Фенолы. Альдегиды
Кислородсодержащие органические соединения. Спирты. Фенолы. Альдегиды Презентация по Химии "Теория тарелок. Хроматографические идентификация. Количественный анализ" - скачать смотреть
Презентация по Химии "Теория тарелок. Хроматографические идентификация. Количественный анализ" - скачать смотреть  Растворение. Растворимость веществ в воде
Растворение. Растворимость веществ в воде Бензол. Получение бензола. Химические свойства бензола. Применение бензола на основе его свойств
Бензол. Получение бензола. Химические свойства бензола. Применение бензола на основе его свойств Химические вещества парабены
Химические вещества парабены