Содержание
- 2. Сероводоро́д, сернистый водород Н2S
- 3. Сероводоро́д, сернистый водород Н2S Общие Систематическое наименование сероводород / hydrogen sulphide Химическая формула H2S Отн. молек.
- 4. Сероводоро́д, сернистый водород Н2S Бесцветный газ с неприятным запахом (тухлого яйца) и сладковатым вкусом. Плохо растворим
- 5. Сероводоро́д Н2S Физические свойства Термически неустойчив (при температурах больше 400 °C разлагается на простые вещества Термически
- 6. Сероводоро́д Н2S Химические свойства В воде сероводород мало растворим, водный раствор H2S является очень слабой кислотой:
- 7. Сероводоро́д Н2S Химические свойства Сульфиды Соли сероводородной кислоты называют сульфидами. В воде хорошо растворимы только сульфиды
- 8. Применеие сероводорода Н2S Сероводород из-за своей токсичности находит ограниченное применение. В аналитической химии сероводород и сероводородная
- 9. Оксид серы (IV)
- 10. Оксид серы (IV) Общие свойства Систематическое наименование Оксид серы(IV) Химическая формула SO2 Относительная молекулярная массаОтносительная молекулярная
- 11. Химические свойства оксида серы (IV) Относится к кислотным оксидам. Растворяется в воде с образованием сернистой кислоты
- 12. Химические свойства оксида серы (IV) Данная реакция является качественной реакцией на сульфит-ион SO32- и на SO2
- 13. Сернистая кислота H2SO3 Неустойчивая двухосновная кислотаНеустойчивая двухосновная кислота средней силы, существует лишь в разбавленных водных растворах
- 14. Химические свойства Сернистой кислоты H2SO3 Кислота средней силы: H2SO3 H+ + HSO3-, KI = 2·10-2 HSO3-
- 15. Применение Сернистой кислоты H2SO3 Сернистая кислота и её соли применяют как восстановители, для беления шерстиСернистая кислота
- 16. Оксид серы (VI)
- 17. Оксид серы (VI) Общие свойства Систематическое наименование Оксид серы(VI) Химическая формула SO3 Отн. молек. МассаОтн. молек.
- 18. Оксид серы (VI) Физические свойства Окси́д се́ры(VI) (се́рный ангидри́д, трео́кись се́ры, се́рный га́з) SO3 — высший
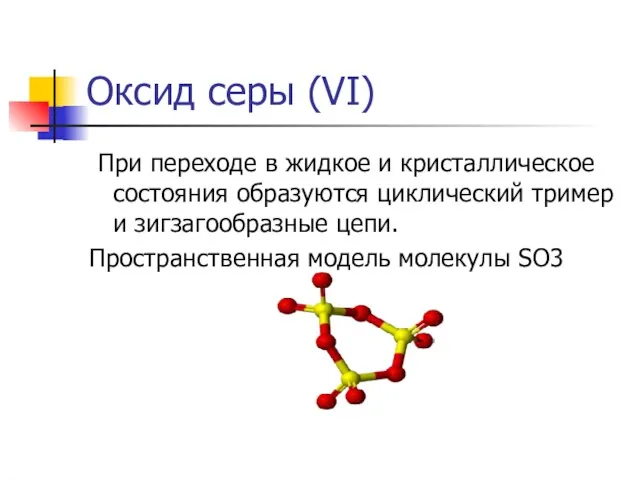
- 19. Оксид серы (VI) При переходе в жидкое и кристаллическое состояния образуются циклический тример и зигзагообразные цепи.
- 20. Получение оксида серы (VI) Получают, окисляя оксид серы(IV)Получают, окисляя оксид серы(IV) кислородомПолучают, окисляя оксид серы(IV) кислородом
- 21. Оксид серы (VI) Химические свойства 1. Кислотно-основные: SO3 — типичный кислотный оксид — типичный кислотный оксид,
- 22. Оксид серы (VI) Химические свойства 2. Окислительно-восстановительные: SO3 характеризуется сильными окислительными свойствами, восстанавливается, обычно, до сернистого
- 23. Серная кислота Н2 SO4
- 24. Серная кислота Н2 SO4 Общие свойства Систематическое наименование серная кислота Химическая формула H2SO4 Отн. молек. МассаОтн.
- 25. Физические свойства серной кислоты Н2 SO4 Се́рная кислота́ H2SO4 — сильная двухосновная кислота, отвечающая высшей степени
- 26. Химические свойства серной кислоты Н2 SO4 Серная кислота - сильная двухосновная кислота, диссоциация ее протекает по
- 27. Химические свойства серной кислоты Н2 SO4 Серная кислота проявляет все свойства сильных кислот: а) взаимодействует с
- 28. Химические свойства серной кислоты Н2 SO4 Железо, алюминий, хром концентрированной серной кислотой пассивируются, однако при сильном
- 29. Задания для самостоятельной работы: Напишите уравнения взаимодействия разбавленной серной кислоты с металлами; основными оксидами; амфотерными оксидами;
- 30. Соли серной кислоты Серная кислота как двухосновная кислота образует два ряда солей - кислые - гидросульфаты
- 31. Производство серной кислоты Сырьём для получения серной кислоты служат сераСырьём для получения серной кислоты служат сера,
- 32. Производство серной кислоты Реакции по производству серной кислоты из минерала пирита на катализаторе — оксиде ванадия
- 33. Схема «Производство серной кислоты контактным способом»:
- 34. Применение серной кислоты В производстве минеральных удобрений; как электролит в свинцовых аккумуляторах; для получения различных минеральных
- 35. Исторические сведения о серной кислоте Серная кислота известна с древности. Первое упоминание о кислых газах, получаемых
- 36. Дополнительные сведения о серной кислоте Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях
- 37. В печь, где жар-огонь горит (поз. 1), Вносят раздробленный Серный колчедан, пирит (FeS2). Вот он, раскаленный,
- 39. Скачать презентацию
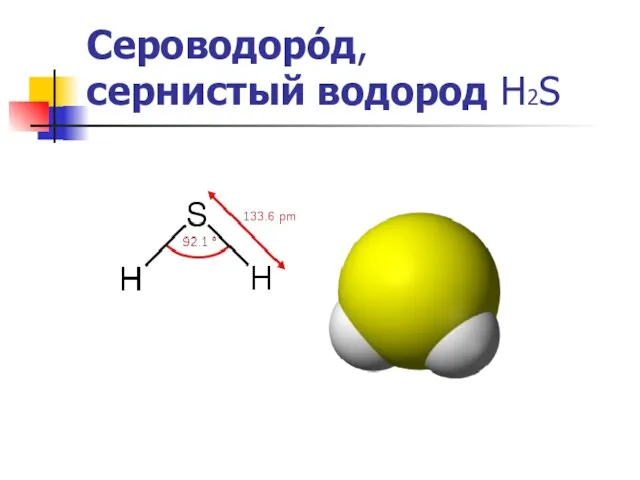
Сероводоро́д,
сернистый водород Н2S
Сероводоро́д,
сернистый водород Н2S
Сероводоро́д,
сернистый водород Н2S
Общие
Систематическое наименование сероводород / hydrogen sulphide
Химическая формула H2S
Отн.
Сероводоро́д,
сернистый водород Н2S
Общие
Систематическое наименование сероводород / hydrogen sulphide
Химическая формула H2S
Отн.
Молярная массаМолярная масса34.082 г/моль
Физические свойства
СостояниеСостояние (ст. усл.)бесцветный газ
Плотность1.5392 г/л г/см³
Термические свойства
Температура плавления-82.30 °C
Температура кипения-60.28 °C
Химические свойства pKa6.89, 19±2
Растворимость в воде0.25 (40 °C) г/100 мл
КлассификацияРег. номер CAS7782-79-8
Сероводоро́д,
сернистый водород Н2S
Бесцветный газ с неприятным запахом (тухлого яйца) и
Сероводоро́д,
сернистый водород Н2S
Бесцветный газ с неприятным запахом (тухлого яйца) и
В природе встречается очень редко в виде смешанных веществ нефти и газа. Имеет очень неприятный запах, вреден для лёгких и всего организма. Сейчас сероводород используют в лечебных целях, например, в сероводородных ваннах
Сероводоро́д Н2S
Физические свойства
Термически неустойчив (при температурах больше 400 °C разлагается на
Сероводоро́д Н2S
Физические свойства
Термически неустойчив (при температурах больше 400 °C разлагается на
Молекула Молекула сероводорода имеет угловую форму, поэтому она полярна (μ = 0,34·10-29 Кл·м). В отличие от молекул воды, молекулы сероводорода не образуют прочных водородных связей, поэтому H2S — газ. Насыщенный водныйS — газ. Насыщенный водный растворS — газ. Насыщенный водный раствор (сероводородная вода) H2S является очень слабой сероводородной кислотой.
Сероводоро́д Н2S
Химические свойства
В воде сероводород мало растворим, водный раствор H2S является
Сероводоро́д Н2S
Химические свойства
В воде сероводород мало растворим, водный раствор H2S является
H2S → HS− + H+
Ka = 6.9×10−7 моль/л; pKa = 6.89.
С основаниями реагирует:
H2S + 2NaOH = Na2S + 2H2O (обычная соль, при избытке NaOH)
H2S + NaOH = NaHS + H2O (кислая соль, при отношении 1:1)
Сероводород — сильный восстановитель. На воздухе он горит синим пламенем:
2H2S + ЗО2 = 2Н2О + 2SO2
при недостатке кислорода:
2H2S + O2 = 2S + 2H2O
(на этой реакции основан промышленный способ получения серы).
Сероводород реагирует также со многими другими окислителями, при его окислении в растворах образуется свободная сера или SO42-, например:
3H2S + 4HClO3 = 3H2SO4 + 4HCl
2H2S + SO2 = 2Н2О + 3S
H2S + I2 = 2HI + S
Сероводоро́д Н2S
Химические свойства
Сульфиды
Соли сероводородной кислоты называют сульфидами. В воде хорошо
Сероводоро́д Н2S
Химические свойства
Сульфиды
Соли сероводородной кислоты называют сульфидами. В воде хорошо
Для щелочных и щелочноземельных металлов известны также гидросульфиды M+HS и M2+(HS)². Гидросульфиды Са²+ и Sr2+ очень нестойки. Являясь солями слабой кислоты, растворимые сульфиды подвергаются гидролизу. Гидролиз сульфидов, содержащих металлы в высоких степенях окисления (Al2S3, Cr2S3 и др.) часто проходит необратимо.
Многие природные сульфиды в виде минералов являются ценными рудами (пиритМногие природные сульфиды в виде минералов являются ценными рудами (пирит, халькопиритМногие природные сульфиды в виде минералов являются ценными рудами (пирит, халькопирит, киноварь).
Получение
Взаимодействие разбавленных кислот на сульфиды:
Взаимодействие сульфида алюминияВзаимодействие сульфида алюминия с водой (эта реакция отличается чистотой полученного сероводорода):
Применеие сероводорода Н2S
Сероводород из-за своей токсичности находит ограниченное применение.
В аналитической химии
Применеие сероводорода Н2S
Сероводород из-за своей токсичности находит ограниченное применение.
В аналитической химии
В медицине — в составе природных и искусственных сероводородных ванн, а также в составе некоторых минеральных вод
Сероводород применяют для получения серной кислоты, элементной серы, сульфидов
Используют в органическом синтезеИспользуют в органическом синтезе для получения тиофенаИспользуют в органическом синтезе для получения тиофена и меркаптанов
В последние годы рассматривается возможность использования сероводорода, накопленного в глубинах Чёрного моряВ последние годы рассматривается возможность использования сероводорода, накопленного в глубинах Чёрного моря, в качестве энергетического (сероводородная энергетика) и химического сырья.
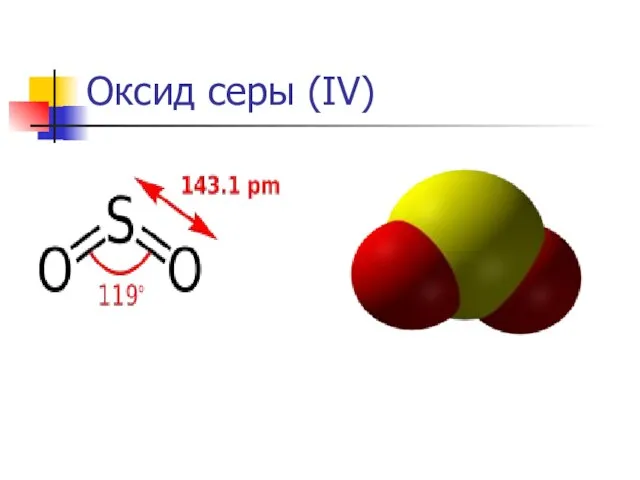
Оксид серы (IV)
Оксид серы (IV)
Оксид серы (IV)
Общие свойства
Систематическое наименование Оксид серы(IV)
Химическая формула SO2
Относительная молекулярная
Оксид серы (IV)
Общие свойства
Систематическое наименование Оксид серы(IV)
Химическая формула SO2
Относительная молекулярная
Молярная массаМолярная масса 64.054 г/моль
Физические свойства
Состояние (норм. условия )бесцветный газ,
Плотность 2,927 г/л (г/см³)
Термические свойства
Температура плавления−75,5 °C
Температура кипения−10,01 °C
Химические свойства
Растворимость в воде11,5 г/100 мл
Классификация Рег. номер CAS[7446-09-5]
Химические свойства
оксида серы (IV)
Относится к кислотным оксидам. Растворяется в воде
Химические свойства
оксида серы (IV)
Относится к кислотным оксидам. Растворяется в воде
SO2 + H2O ↔ H2SO3.
Со щелочами образует сульфиты:
SO2 + 2NaOH → Na2SO3 + H2O.
Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2, степень окисления серы в таких реакциях повышается:
SO2 + Br2 + 2H2O → H2SO4 + 2HBr,
2SO2 + O2 → 2SO3 (требуется катализатор V2O5 и температура 450°С),
Химические свойства
оксида серы (IV)
Данная реакция является качественной реакцией на сульфит-ион
Химические свойства
оксида серы (IV)
Данная реакция является качественной реакцией на сульфит-ион
5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + 2MnSO4 + K2SO4.
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например, для извлечения серы их отходящих газов металлургической промышленности используют восстановление SO2 оксидом углерода(II):
SO2 + 2CO → 2CO2 + S↓.
Или для получения фосфорноватистой кислоты:
PH3 + SO2 → H(PH2O2) + S↓
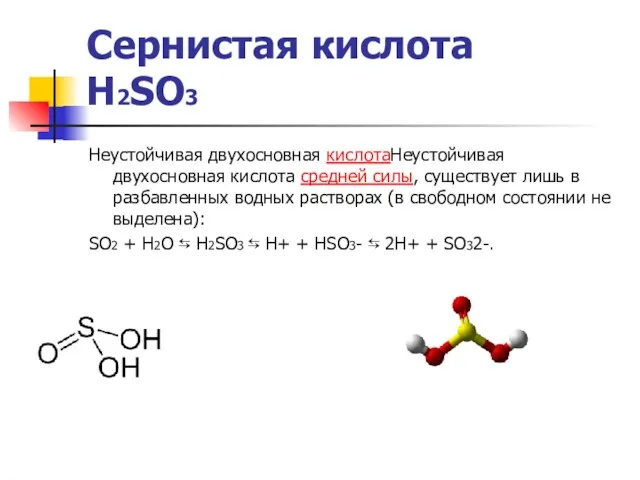
Сернистая кислота
H2SO3
Неустойчивая двухосновная кислотаНеустойчивая двухосновная кислота средней силы, существует лишь
Сернистая кислота
H2SO3
Неустойчивая двухосновная кислотаНеустойчивая двухосновная кислота средней силы, существует лишь
SO2 + H2O ⇆ H2SO3 ⇆ H+ + HSO3- ⇆ 2H+ + SO32-.
Химические свойства
Сернистой кислоты H2SO3
Кислота средней силы:
H2SO3 <=> H+ +
Химические свойства
Сернистой кислоты H2SO3
Кислота средней силы:
H2SO3 <=> H+ +
HSO3- <=> H+ + SO32-, KII = 6·10-8
Растворы H2SO3 всегда имеют резкий специфический запах (похожий на запах зажигающейся спичкивсегда имеют резкий специфический запах (похожий на запах зажигающейся спички), обусловленный наличием химически не связанного водой SO2.
Двухосновная кислотаДвухосновная кислота, образует два ряда солей: кислые — гидросульфитыДвухосновная кислота, образует два ряда солей: кислые — гидросульфиты (в недостатке щёлочи):
и средние — сульфитыи средние — сульфиты (в избытке щёлочи):
Как и сернистый газ, сернистая кислота и её соли являются сильными восстановителями:
При взаимодействии с ещё более сильными восстановителями может играть роль окислителя:
Качественная реакция на сульфит-ионы — обесцвечивание раствора перманганата калия:
Применение
Сернистой кислоты H2SO3
Сернистая кислота и её соли применяют как
Применение
Сернистой кислоты H2SO3
Сернистая кислота и её соли применяют как
Сернистую кислоту применяют при консервировании плодов и овощей.
Гидросульфит кальция Са(HSO3)2 (сульфитный щелок) используют для переработки древесины в так называемую сульфитную целлюлозуГидросульфит кальция Са(HSO3)2 (сульфитный щелок) используют для переработки древесины в так называемую сульфитную целлюлозу (раствор гидросульфита кальция растворяет лигнинГидросульфит кальция Са(HSO3)2 (сульфитный щелок) используют для переработки древесины в так называемую сульфитную целлюлозу (раствор гидросульфита кальция растворяет лигнин — вещество, связывающее волокна целлюлозы, в результате чего волокна отделяются друг от друга; обработанную таким образом древесину используют для получения бумаги).
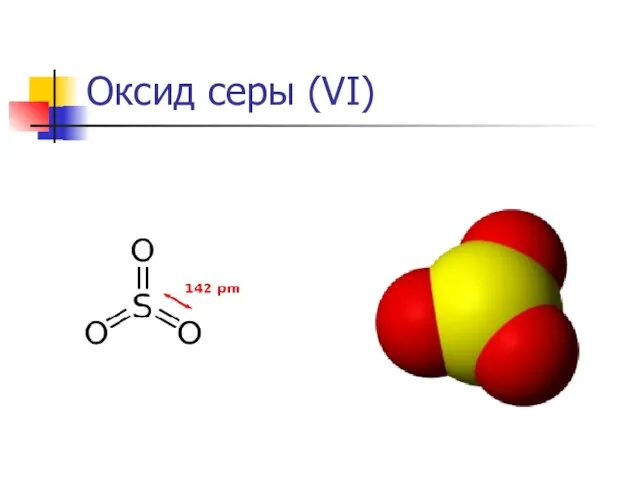
Оксид серы (VI)
Оксид серы (VI)
Оксид серы (VI)
Общие свойства
Систематическое наименование Оксид серы(VI)
Химическая формула SO3
Отн. молек. МассаОтн.
Оксид серы (VI)
Общие свойства
Систематическое наименование Оксид серы(VI)
Химическая формула SO3
Отн. молек. МассаОтн.
Молярная массаМолярная масса 80.06 г/моль
Физические свойства
СостояниеСостояние (ст. усл.) бесцветный газ
Плотность1.92 г/см³
Термические свойства
Температура плавления16,9 °C
Температура кипения45 °C
Энтальпия образованияЭнтальпия образования (ст. усл.)−397.77 кДж/моль Классификация Рег. номер CAS[7446-11-9]
Оксид серы (VI)
Физические свойства
Окси́д се́ры(VI) (се́рный ангидри́д, трео́кись се́ры, се́рный га́з)
Оксид серы (VI)
Физические свойства
Окси́д се́ры(VI) (се́рный ангидри́д, трео́кись се́ры, се́рный га́з)
SO3 — высший оксид серы,
тип химической связи: ковалентная полярная
В обычных условиях легколетучая бесцветная жидкость с удушающим запахом.
При температурах ниже 16,9 °C застывает с образованием смеси различных кристаллических модификаций твёрдого SO3.
Оксид серы (VI)
При переходе в жидкое и кристаллическое состояния образуются
Оксид серы (VI)
При переходе в жидкое и кристаллическое состояния образуются
Пространственная модель молекулы SO3
Получение оксида серы (VI)
Получают, окисляя оксид серы(IV)Получают, окисляя оксид серы(IV) кислородомПолучают,
Получение оксида серы (VI)
Получают, окисляя оксид серы(IV)Получают, окисляя оксид серы(IV) кислородомПолучают,
2SO2 + O2 → 2SO3 + Q.
Можно получить термическим разложением сульфатов:
Fe2(SO4)3 → Fe2O3 + 3SO3,
или взаимодействием SO2 с озоном:
SO2 + O3 → SO3 + O2↑.
Для окисления SO2 используют также NO2:
SO2 + NO2 → SO3 + NO↑.
Эта реакция лежит в основе исторически первого, нитрозного способа получения серной кислоты.
Оксид серы (VI)
Химические свойства
1. Кислотно-основные: SO3 — типичный кислотный оксид —
Оксид серы (VI)
Химические свойства
1. Кислотно-основные: SO3 — типичный кислотный оксид —
При взаимодействии с водой образует серную кислоту:
SO3 + H2OO → H2SO4.
Взаимодействует с основаниями:
2KOH + SO3 → K2SO4 + H2O,
основными оксидами:
CaO + SO3 → CaSO4,
c амфотерными оксидами:
3SO3 + Al2O3 → Al2(SO4)3.
SO3 растворяется в 100%-й серной кислоте, образуя олеум:
H2SO4 (100 %) + SO3 → H2S2O7.
Оксид серы (VI)
Химические свойства
2. Окислительно-восстановительные: SO3 характеризуется сильными окислительными свойствами, восстанавливается,
Оксид серы (VI)
Химические свойства
2. Окислительно-восстановительные: SO3 характеризуется сильными окислительными свойствами, восстанавливается,
5SO3 + 2P + 2P→ P2O5 + 5SO2
3SO3 + H2SS → 4SO2 + H2O
2SO3 + 2KI + 2KI → SO2 + I2 + K2SO4.
3. При взаимодействии с хлороводородом образуется хлорсульфоновая кислота:
SO3 + HCl + HCl → HSO3Cl
Также присоединяет хлор, образуя тионилхлорид:
SO3 + Cl2 + 2SCl2 → 3SOCl2
Серная кислота Н2 SO4
Серная кислота Н2 SO4
Серная кислота Н2 SO4
Общие свойства
Систематическое наименование серная кислота
Химическая формула H2SO4
Отн. молек.
Серная кислота Н2 SO4
Общие свойства
Систематическое наименование серная кислота
Химическая формула H2SO4
Отн. молек.
Молярная массаМолярная масса98.078 г/моль
Физические свойства
СостояниеСостояние (ст. усл.)бесцветная маслянистая жидкость без запаха
Плотность1,8356 г/см³
Термические свойства
Температура плавления10,38 °C
Температура кипения279,6 °C
Химические свойства
Растворимость в водесмешивается во всех соотношениях г/100 мл
Классификация
Рег. номер CAS7664-93-
Физические свойства
серной кислоты Н2 SO4
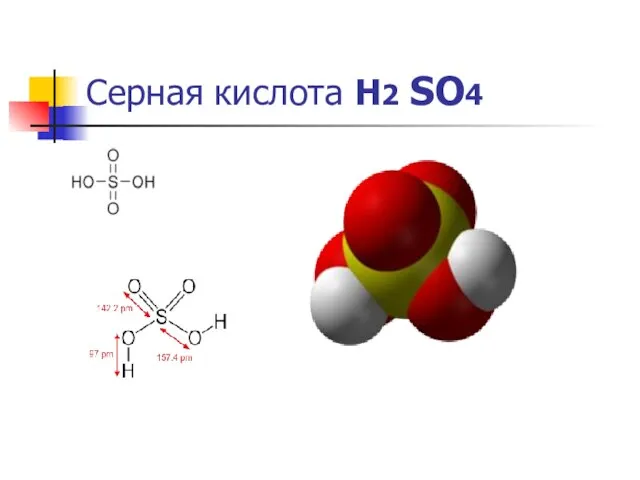
Се́рная кислота́ H2SO4 — сильная двухосновная кислота,
Физические свойства
серной кислоты Н2 SO4
Се́рная кислота́ H2SO4 — сильная двухосновная кислота,
При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха.
В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3.
Если молярное отношение SO3:H2O < 1, то это водный раствор серной кислоты, если > 1, — раствор SO3 в серной кислоте (олеум).
Химические свойства
серной кислоты Н2 SO4
Серная кислота - сильная двухосновная кислота,
Химические свойства
серной кислоты Н2 SO4
Серная кислота - сильная двухосновная кислота,
H2SO4 = H+ + HSO4- - первая ступень
HSO4- =H+ + SO42- - вторая ступень
В концентрированных растворах диссоциация серной кислоты по второй ступени незначительна.
Серная кислота - сильнейшее дегидратирующее (водоотнимающее) вещество. Она поглощает влагу из воздуха (гигроскопична), отнимает воду
1. от кристаллогидратов:
CuSO4*5H2O голубой ------------------------> CuSO4 белый + 5H2O
2. углеводов (обугливает дерево и бумагу):
C12H22O11 --------------------------> 12C + 11H2O
3. спиртов:
C2H5OH -----------------------------> CH2=CH2 + H2O
В окислительно-восстановительных реакциях разбавленная серная кислота проявляет свойства обычной кислоты (неокислитель) - при этом восстанавливаются ионы Н+, например:
Fe + H2SO4 разб.= FeSO4 + H2
Разбавленная H2SO4 не взаимодействует с металлами, стоящими в ряду напряжений правее водорода.
Концентрированная серная кислота - кислота-окислитель, при этом восстанавливается сера (+6).
Она окисляет металлы, стоящие в ряду напряжений правее водорода:
Cu + 2H2SO4конц. = CuSO4 + SO2 + 2H2O
Химические свойства
серной кислоты Н2 SO4
Серная кислота проявляет все свойства сильных
Химические свойства
серной кислоты Н2 SO4
Серная кислота проявляет все свойства сильных
а) взаимодействует с основными оксидами:
CuO + H2SO4 = CuSO4 + H2O
б) с основаниями:
2NaOH + H2SO4= Na2SO4 + 2H2O
в) вытесняет другие кислоты из их солей, например те, которые слабее нее:
CaCO3 + H2SO4 = CaSO4 + CO2 + H2O
или более летучие (обладающие температурами кипения ниже, чем у серной кислоты):
NaNO3твердый + H2SO4 конц.= NaHSO4 + HNO3- при нагревании
и металлы,стоящие левее водорода, при этом сера восстанавливается до степени окисления +4, 0 и -2:
Zn + 2H2SO4 = ZnSO4 + SO2 + 2H2O
3Zn + 4H2SO4 = 3ZnSO4 + S + 4H2O
4Zn + 5H2SO4 = 4ZnSO4 + H2S + 4H2O
Химические свойства
серной кислоты Н2 SO4
Железо, алюминий, хром концентрированной серной кислотой
Химические свойства
серной кислоты Н2 SO4
Железо, алюминий, хром концентрированной серной кислотой
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O
Концентрированная серная кислота окисляет неметаллы, например:
C + 2H2SO4 = CO2 + 2SO2 + 2H2O
S +2H2SO4 = 3SO2 + 2H2O
Концентрированная серная кислота окисляет также сложные вещества, например HI и HBr:
2HBr + H2SO4 = Br2 + SO2 + 2H2O
8HI + H2SO4 = 4I2 + H2S + 4H2O
соли железа (2):
2FeSO4 + 2H2SO4 = Fe2(SO4)3 + 2H2O + SO2
Задания для самостоятельной работы:
Напишите уравнения взаимодействия разбавленной серной кислоты с
Задания для самостоятельной работы:
Напишите уравнения взаимодействия разбавленной серной кислоты с
основными оксидами;
амфотерными оксидами;
основаниями;
амфотерными гидроксидами.
Соли серной кислоты
Серная кислота как двухосновная кислота образует два ряда солей
Соли серной кислоты
Серная кислота как двухосновная кислота образует два ряда солей
Na2SO4*10H2O - глауберова соль (мирабилит) - бесцветная
MgSO4*7H2O - горькая (английская) соль - бесцветная
CuSO4*5H2O - медный купорос - голубой
FeSO4*7H2O - железный купорос - голубовато-зеленый
CaSO4*2H2O - гипс - белый
Сульфаты при нагревании разлагаются (кроме сульфатов щелочных металлов, которые термически устойчивы), например CaSO4 - при 1400oС:
2CaSO4 = 2CaO + 2SO2 + O2
Сульфаты переходных металлов разлагаются при более низких температурах, например Fe2(SO4)3 - при 700-800oС:
Fe2(SO4)3 = Fe2O3 + 3SO3
Производство серной кислоты
Сырьём для получения серной кислоты служат сераСырьём для
Производство серной кислоты
Сырьём для получения серной кислоты служат сераСырьём для
Основные этапы получения серной кислоты:
Обжиг сырья с получением SO2
Окисление SO2 в SO3
АбсорбцияАбсорбция SO3
В промышленности применяют два метода окисления SO2 в производстве серной кислоты: контактный — с использованием твердых катализаторов в производстве серной кислоты: контактный — с использованием твердых катализаторов (контактов), и нитрозный — с оксидами азота.
Производство серной кислоты
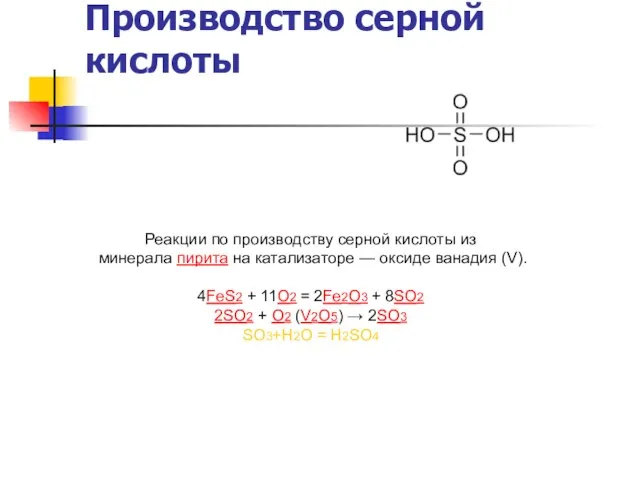
Реакции по производству серной кислоты из
минерала пирита на
Производство серной кислоты
Реакции по производству серной кислоты из
минерала пирита на
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
2SO2 + O2 (V2O5) → 2SO3
SO3+Н2О = Н2SO4
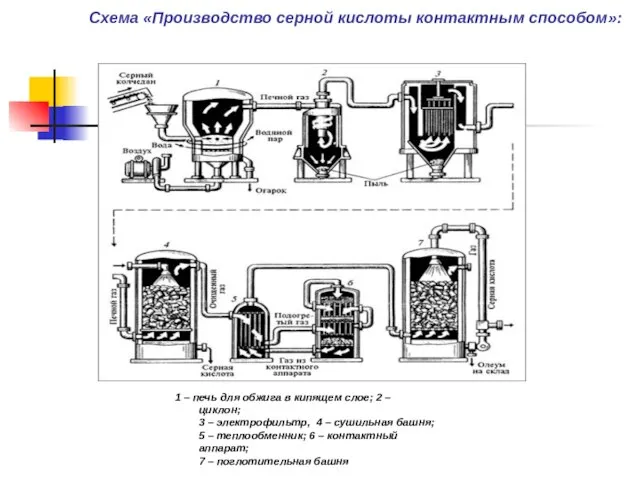
Схема «Производство серной кислоты контактным способом»:
Схема «Производство серной кислоты контактным способом»:
Применение серной кислоты
В производстве минеральных удобрений;
как электролит в свинцовых аккумуляторах;
Применение серной кислоты
В производстве минеральных удобрений;
как электролит в свинцовых аккумуляторах;
для получения различных минеральных кислот и солей;
в производстве химических волокон, красителей, дымообразующих веществ и взрывчатых веществ;
в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
в пищевой промышленности — зарегистрирована в качестве пищевой добавки E513(эмульгатор);
в промышленном органическом синтезе в реакциях:
дегидратации (получение диэтилового эфира, сложных эфиров);
гидратации (этанолгидратации (этанол из этилена);
сульфирования (синтетические моющие средства и промежуточные продукты в производстве красителей);
алкилирования (получение изооктанаалкилирования (получение изооктана, полиэтиленгликоля, капролактама) и др.
Самый крупный потребитель серной кислоты — производство минеральных удобрений.
Исторические сведения
о серной кислоте
Серная кислота известна с древности. Первое упоминание о
Исторические сведения
о серной кислоте
Серная кислота известна с древности. Первое упоминание о
Позже, в IX веке персидский алхимик Ар-РазиПозже, в IX веке персидский алхимик Ар-Рази, прокаливая смесь железного и медного купороса (FeSO4•7H2O и CuSO4•5H2O), также получил раствор серной кислоты. Этот способ усовершенствовал европейский алхимик Альберт Магнус, живший в XIII веке.
В XV веке алхимики обнаружили, что серную кислоту можно получить, сжигая смесь серы и селитрыВ XV веке алхимики обнаружили, что серную кислоту можно получить, сжигая смесь серы и селитры, или из пиритаВ XV веке алхимики обнаружили, что серную кислоту можно получить, сжигая смесь серы и селитры, или из пирита — серного колчедана, более дешевого и распространенного сырья, чем сера. Таким способом получали серную кислоту на протяжении 300 лет, небольшими количествами в стеклянных ретортахВ XV веке алхимики обнаружили, что серную кислоту можно получить, сжигая смесь серы и селитры, или из пирита — серного колчедана, более дешевого и распространенного сырья, чем сера. Таким способом получали серную кислоту на протяжении 300 лет, небольшими количествами в стеклянных ретортах. И только в середине 18 столетия, когда было установлено, что свинец не растворяется в серной кислоте, от стеклянной лабораторной посуды перешли к большим промышленным свинцовым камерам.
Дополнительные сведения
о серной кислоте
Мельчайшие капельки серной кислоты могут образовываться в
Дополнительные сведения
о серной кислоте
Мельчайшие капельки серной кислоты могут образовываться в
В печь, где жар-огонь горит (поз. 1),
Вносят раздробленный
Серный колчедан, пирит (FeS2).
Вот
В печь, где жар-огонь горит (поз. 1), Вносят раздробленный Серный колчедан, пирит (FeS2). Вот
Производство серной кислоты
контактным способом
Их циклон отделит враз (поз. 2):
В нем для них барьеры.
Два цилиндра в нем, и вот,
Сверху вниз обычно,
По спирали газ идет.
Пыль из газа упадет,
Но не вся, частично.
Смесь в электрофильтр подав (поз. 3),
Где сплошные сетки
И под током провода,
Пыль, как птицу в клетку,
Ловят каждый раз подряд,
Ведь частички пыли
Обретают здесь заряд,
Подчиняясь силе
Электрических полей.
Минус-знак поймала
Пыль, прилипнув массой всей
К сетке из металла.
В бункер или просто в ров
Опадает сразу.
Но очистить от паров
Еще надо газы.




























 Магматичні родовища
Магматичні родовища Альдегидтер және кетондар
Альдегидтер және кетондар Расчёты по уравнению реакции
Расчёты по уравнению реакции Нуклеиновые кислоты
Нуклеиновые кислоты Алифатические соединения. Тема № 6
Алифатические соединения. Тема № 6 Чугуны и стали
Чугуны и стали Фотохимические превращения ДНК. Люминесцентные метки и зонды и их применение в биологии и медицине
Фотохимические превращения ДНК. Люминесцентные метки и зонды и их применение в биологии и медицине Отчет по ПП.03.01 «Лаборант химического анализа»
Отчет по ПП.03.01 «Лаборант химического анализа» Растворение веществ. Гидраты
Растворение веществ. Гидраты Хімія в харчовій промисловості Харчові добавки
Хімія в харчовій промисловості Харчові добавки  Титан. История открытия титана
Титан. История открытия титана Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады) Углеводы. Моносахариды, олигосахариды (дисахариды)
Углеводы. Моносахариды, олигосахариды (дисахариды) Сплавы серебра
Сплавы серебра Материаловедение и технология конструкционных материалов
Материаловедение и технология конструкционных материалов Характеристика галогенів. Їх біологічне значення Виконали учениці 10-Б класу Халімон Заріна Петрова Оксана Борисенко Юлія Ми
Характеристика галогенів. Їх біологічне значення Виконали учениці 10-Б класу Халімон Заріна Петрова Оксана Борисенко Юлія Ми Решение 33 задания
Решение 33 задания Презентация для класса Дмитрий Иванович Менделеев
Презентация для класса Дмитрий Иванович Менделеев  Периодический закон Д.И. Менделеева. Историческая формулировка периодического закона
Периодический закон Д.И. Менделеева. Историческая формулировка периодического закона Жиры в природе
Жиры в природе Путешествие в мир углеводородов нефти
Путешествие в мир углеводородов нефти Химическое действие света
Химическое действие света Химическая лаборатрия. Химический состав растений
Химическая лаборатрия. Химический состав растений ВМС и растворы ВМС
ВМС и растворы ВМС Обмен триацилглицеролов и жирных кислот
Обмен триацилглицеролов и жирных кислот Роль химических элементов в жизнедеятельности организма
Роль химических элементов в жизнедеятельности организма Кислоты, основания, соли в свете ТЭД подготовила: Мартынова Е.Ю._
Кислоты, основания, соли в свете ТЭД подготовила: Мартынова Е.Ю._ Влияние границы раздела с наполнителем на надмолекулярную структуру линейных и пространственных аморфных полимеров
Влияние границы раздела с наполнителем на надмолекулярную структуру линейных и пространственных аморфных полимеров