Содержание
- 2. Вступление Цель: найти способ вызвать быструю, но контролируемую коррозию железа. Решение: создать агрессивную среду и/или образовать
- 3. Процесс коррозии Коррозия железа, или ржавение – это его окисление под действием кислорода воздуха или кислорода,
- 4. Процесс коррозии
- 5. Гальваника Присутствие примесей металлов, менее активных, чем железо, «провоцирует» коррозию. Два различных металла в контакте друг
- 6. Гальваника
- 7. Агрессивная среда Разрушение железа сильно ускоряется, если вместо пресной воды на него будет действовать морская соль
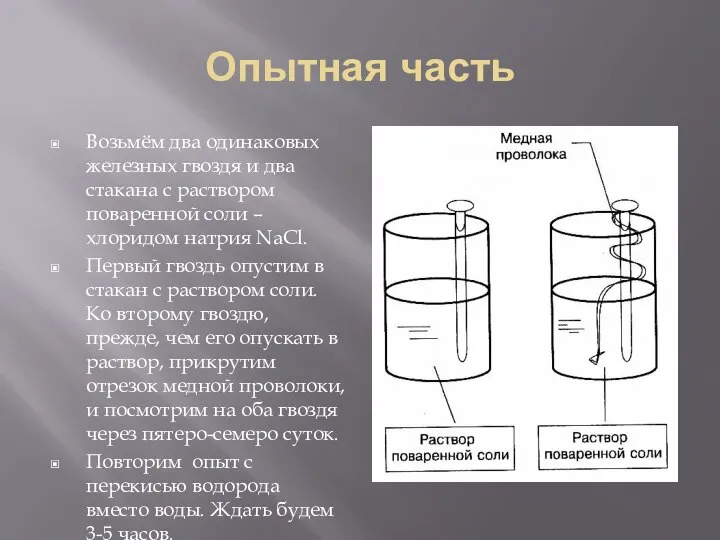
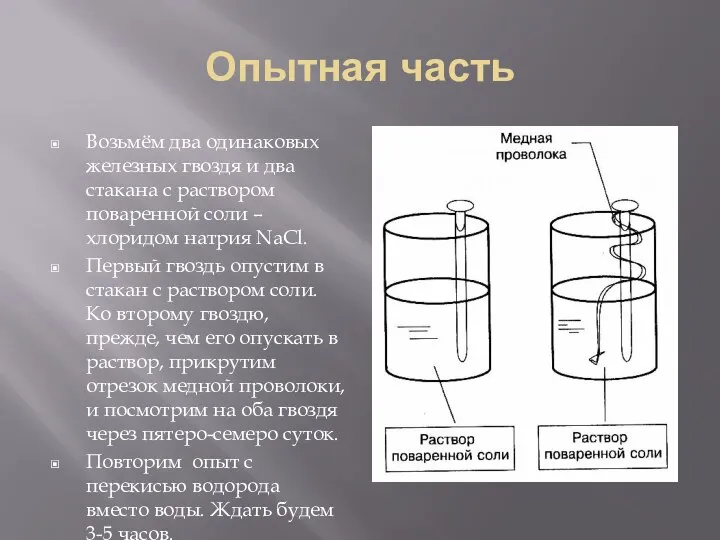
- 8. Опытная часть Возьмём два одинаковых железных гвоздя и два стакана с раствором поваренной соли – хлоридом
- 9. Процесс Через 3 минуты в стакане с перекисью и медью уже видны признаки реакции
- 10. Процесс Через 10 минут признаки реакции появляются и в стаканчике без проволоки
- 11. Процесс Проверим все гвоздики через 1 час после начала эксперимента. Что же обнаружится? Все наши гвоздики
- 12. Результат Гвозди после нескольких часов в перекиси и 7 дней в воде.
- 13. Опытная часть Возьмём два одинаковых железных гвоздя и два стакана с раствором поваренной соли – хлоридом
- 14. Агрессивная среда Разрушение железа сильно ускоряется, если вместо пресной воды на него будет действовать морская соль
- 16. Скачать презентацию











 Хроматография
Хроматография Презентация Коррозия
Презентация Коррозия Пластмассы, синтетические каучуки Презентацию подготовили ученицы 11-А класса Алчевской ИТГ Мозолевская Анастасия, Ткаченко
Пластмассы, синтетические каучуки Презентацию подготовили ученицы 11-А класса Алчевской ИТГ Мозолевская Анастасия, Ткаченко Кислоты в свете ТЭД
Кислоты в свете ТЭД Вуглецеві матеріали
Вуглецеві матеріали Хімічні речовини у побуті підготували Стебко Марія, Бондар Аліна 11-Ф
Хімічні речовини у побуті підготували Стебко Марія, Бондар Аліна 11-Ф  Коллоидная химия
Коллоидная химия Превращение веществ
Превращение веществ Набор № 3 ВС "Щелочи". Техника безопасности при работе со щелочами
Набор № 3 ВС "Щелочи". Техника безопасности при работе со щелочами Изомерия алкенов. Цель урока: закрепить понятие изомеры, познакомить с геометрической изомерией
Изомерия алкенов. Цель урока: закрепить понятие изомеры, познакомить с геометрической изомерией Презентация по Химии "Неметалічні елементи" - скачать смотреть бесплатно
Презентация по Химии "Неметалічні елементи" - скачать смотреть бесплатно Нуклеиновые кислоты. Строение. Схема образования
Нуклеиновые кислоты. Строение. Схема образования Проведение лабораторных анализов образцов почвы
Проведение лабораторных анализов образцов почвы Платина. Свойства
Платина. Свойства Дифузія у побуті
Дифузія у побуті Радон и его дочерние продукты распада радона
Радон и его дочерние продукты распада радона Атомы. Молекулы. Ионы
Атомы. Молекулы. Ионы Химическая связь
Химическая связь КОВАЛЕНТНАЯ СВЯЗЬ ПОЛЯРНАЯ И НЕПОЛЯРНАЯ
КОВАЛЕНТНАЯ СВЯЗЬ ПОЛЯРНАЯ И НЕПОЛЯРНАЯ Осадительное титрование. (Лекция 11)
Осадительное титрование. (Лекция 11) Задачи в школьном курсе химии
Задачи в школьном курсе химии 6-членные гетероциклы с одним гетероатомом
6-членные гетероциклы с одним гетероатомом Применение газовых разрядов в быту Подготовила: ученица 9-А класса СООШ №18 Кальченко Елена
Применение газовых разрядов в быту Подготовила: ученица 9-А класса СООШ №18 Кальченко Елена  Альдегидтер және кетондар
Альдегидтер және кетондар Нефть, состав и свойства. Переработка нефти. Нефтепродукты, их применение
Нефть, состав и свойства. Переработка нефти. Нефтепродукты, их применение Обмен нуклеотидов
Обмен нуклеотидов Гальванический элемент Даниэля-Якоби. Потенцометрия. Стеклянный электрод
Гальванический элемент Даниэля-Якоби. Потенцометрия. Стеклянный электрод Аминокислоты. Белки
Аминокислоты. Белки