Степень окисления Автор Акимова Ольга Васильевна учитель химии, высшая квалификационная категория МАОУ Барыбинская СОШ г.Домо
Содержание
- 2. Цель урока: Разобраться, что такое «степень окисления» Научиться находить степень окисления по формуле
- 3. Поваренная соль NaCl «Хлеб да соль» - пожелание добра «Надо вместе съесть пуд соли, чтобы узнать
- 4. Влияние Na на организм человека Хранят простое вещество «натрий» как Кощееву смерть. Как может повлиять натрий
- 5. Влияние Cl2 на организм человека Хлор – отравляющее вещество, применявшееся во время первой мировой войны
- 6. Образование сложного вещества Na0 +11 2е,8е,1е Cl0 +17 2e,8e,7e Какой вид связи может образоваться между этими
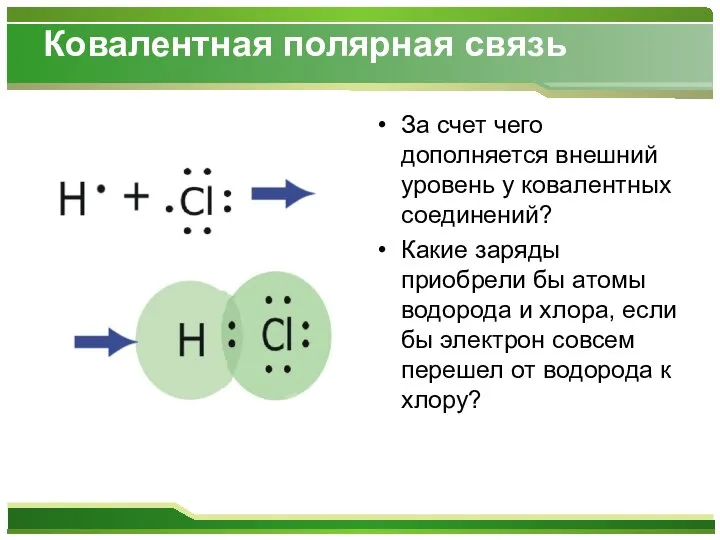
- 7. Ковалентная полярная связь За счет чего дополняется внешний уровень у ковалентных соединений? Какие заряды приобрели бы
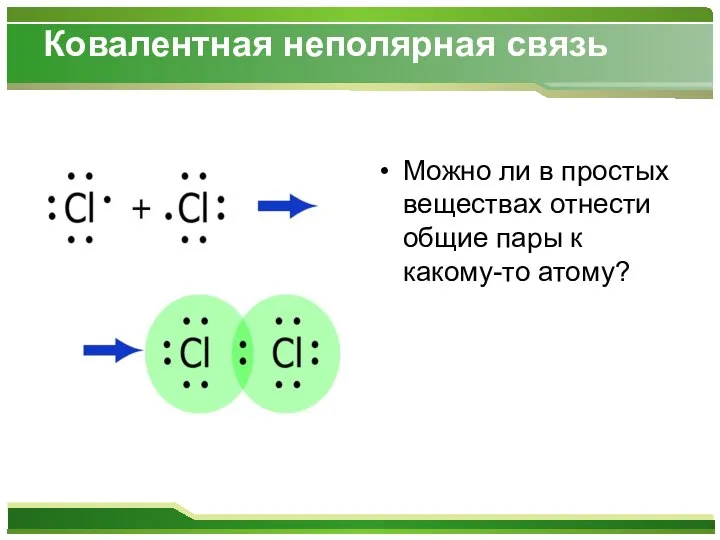
- 8. Ковалентная неполярная связь Можно ли в простых веществах отнести общие пары к какому-то атому?
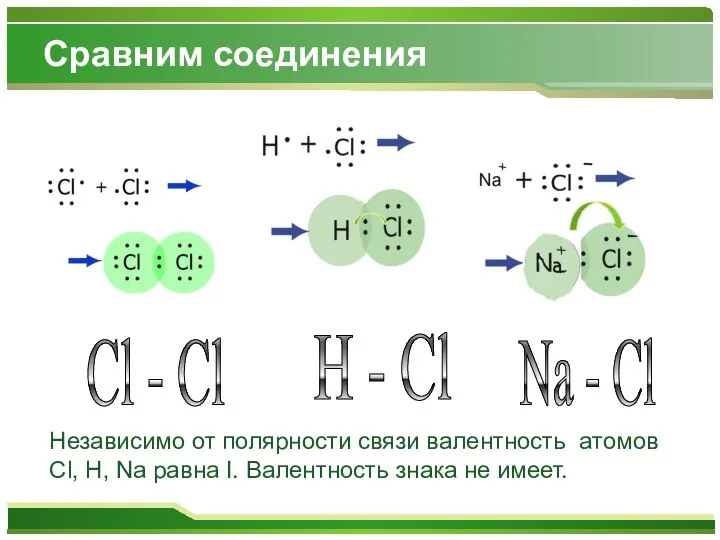
- 9. Сравним соединения H - Cl Cl - Cl Na - Cl Независимо от полярности связи валентность
- 10. Степень окисления – это условный заряд атомов химических элементов в соединении, вычисленный на основе предположения, что
- 11. Правила определения с.о. С.о. атомов в простых веществах = 0 С.о. фтора = -1 С.о. кислорода
- 12. Возможные с.о. Положительная «+» равна числу отданных электронов. Максимальная с.о. равна номеру группы Отрицательная «-» равна
- 13. Промежуточные с.о. Рассмотрим возможные с.о. серы – S Максимальная +6 SO3 Минимальная -2 H2S Сера может
- 14. Определение с.о. N2O3 На первом месте стоит элемент с «+» с.о., на втором с «-» У
- 15. Задание 1 Определите С.О. по формулам Cl2O7, NaH, Na2S, MgO, H3N, N2, Al2S3, Cu2O
- 17. Скачать презентацию











 Контроль в процессе обучения химии на старшей ступени школы
Контроль в процессе обучения химии на старшей ступени школы Аналитическая химия
Аналитическая химия Rates of reaction
Rates of reaction Светоносный элемент
Светоносный элемент Общая характеристика элементов I группы главной подгруппы Периодической системы химических элементов Д.И. Менделеева
Общая характеристика элементов I группы главной подгруппы Периодической системы химических элементов Д.И. Менделеева Сероводород. Сульфиды
Сероводород. Сульфиды Аммиак. Соли аммония. Методы получения
Аммиак. Соли аммония. Методы получения Превращения в нашей жизни: физические и химические
Превращения в нашей жизни: физические и химические «Природные источники углеводородов и их переработка»
«Природные источники углеводородов и их переработка» Производство цемента. Сухой цемент
Производство цемента. Сухой цемент Металлы Общая характеристика
Металлы Общая характеристика Классификация веществ
Классификация веществ Кондуктометрия
Кондуктометрия Методические рекомендации к уроку по теме Скорость химических реакций в 11классе
Методические рекомендации к уроку по теме Скорость химических реакций в 11классе Представники d-елементів (перехідних елементів) періодичної системи елементів
Представники d-елементів (перехідних елементів) періодичної системи елементів Серебро. Химические свойства
Серебро. Химические свойства Химические свойства неорганических соединений
Химические свойства неорганических соединений Современные положения теории А.М. Бутлерова
Современные положения теории А.М. Бутлерова Лекарственное растительное сырье, содержащее жиры
Лекарственное растительное сырье, содержащее жиры Алкалоидтар негіздік қасиеттері бар азотты органикалық қосылыстар
Алкалоидтар негіздік қасиеттері бар азотты органикалық қосылыстар Неметаллические материалы
Неметаллические материалы Презентация по Химии "Шкода запаху гуми і її токсичність. Які хвороби характерні для працівників шинних заводів?" - скачать см
Презентация по Химии "Шкода запаху гуми і її токсичність. Які хвороби характерні для працівників шинних заводів?" - скачать см Колообіг нітрогену в природі
Колообіг нітрогену в природі Методи очищення води в побуті
Методи очищення води в побуті Обмен углеводов. Углеводы как химические соединения. Функции углеводов
Обмен углеводов. Углеводы как химические соединения. Функции углеводов Спецификация КИМ ОГЭ. Химия 2016. Задание 17. Первоначальные сведения об органических веществах
Спецификация КИМ ОГЭ. Химия 2016. Задание 17. Первоначальные сведения об органических веществах Повышение огнестойкости деревянных конструкций методом поверхностной и объёмной пропитки
Повышение огнестойкости деревянных конструкций методом поверхностной и объёмной пропитки Периодический закон и ПСХЭ Д.И. Менделеева в свете учения о строении атома
Периодический закон и ПСХЭ Д.И. Менделеева в свете учения о строении атома