Содержание
- 2. 01. Предмет, задачи и понятия химии Не являются предметом химии субатомные частицы, ядерные превращения, сверхплот-ное состояние,
- 3. 1. Предмет, задачи, понятия физической химии 1.1. Физическая химия изучает различные свойства веществ в зависимости от
- 4. 1. Предмет, задачи, понятия физической химии 1.2. Основные понятия физической химии Среда (твёрдая, жидкая, газообразная), потоки
- 5. 1. Предмет, задачи, понятия физической химии 1.3. Способы описания предмета физической химии Модели формализованные - уравнения
- 6. 1. Предмет, задачи, понятия физической химии 1.3. Способы описания предмета физической химии Представление о системах (гомогенные,
- 7. 1.3. Способы описания предмета физической химии 2. Физико-химические модели модель границы раздела фаз (д.э.с., поверхностные плёнки);
- 8. 2. Диаграммы состояния Фаза — это совокупность гомогенных частей системы, имеющих одинаковые химические, физические и термодинамические
- 9. 2. Диаграммы состояния Системы из одной фазы (Ф = 1), называются гомогенными, а из нескольких фаз
- 10. 2. Диаграммы состояния Примеры подсчёта числа независимых компонентов (К)
- 11. 2. Диаграммы состояния Условие химического равновесия: фазы системы находятся в химическом равновесии друг с другом относительно
- 12. 2. Диаграммы состояния Поэтому условие равенства химических потенциалов может сводиться к равенству либо к определённому отношению
- 13. 2. Диаграммы состояния ПРАВИЛО ФАЗ ГИББСА Оно определяет число степеней свободы системы (С), т.е. количество параметров,
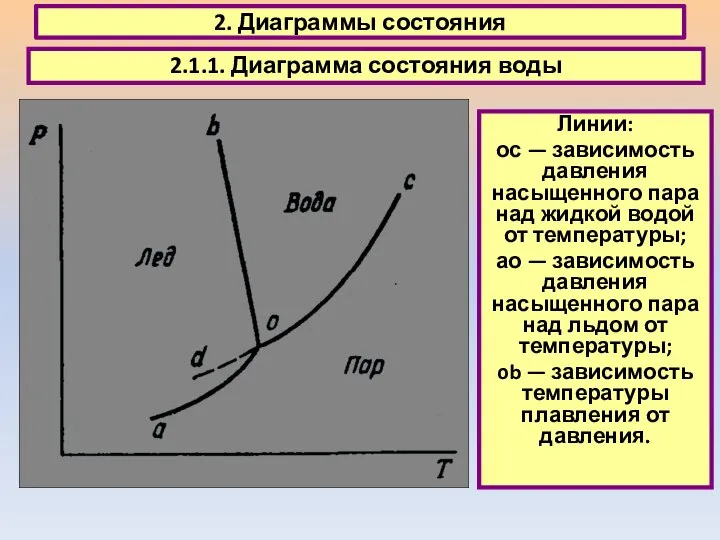
- 14. 2. Диаграммы состояния 2.1.1. Диаграмма состояния воды Линии: ос — зависимость давления насыщенного пара над жидкой
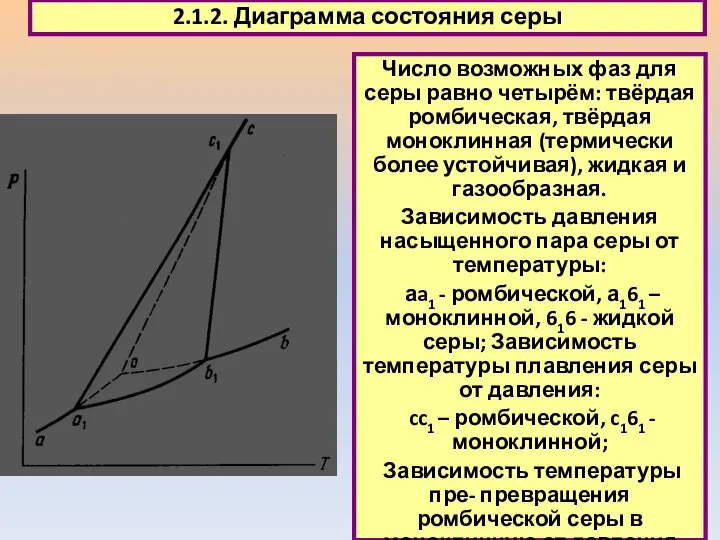
- 15. 2.1.2. Диаграмма состояния серы Число возможных фаз для серы равно четырём: твёрдая ромбическая, твёрдая моноклинная (термически
- 16. 2. Диаграммы состояния 2.2. Физико-химический анализ Физико-химический анализ (ФХА) основан на изучении экспериментальных зависимостей свойств равновесной
- 17. 2.2. Физико-химический анализ Для физико-химического анализа действуют два принципа, установленных Н.С. Курнаковым. Принцип непрерывности: при неизменном
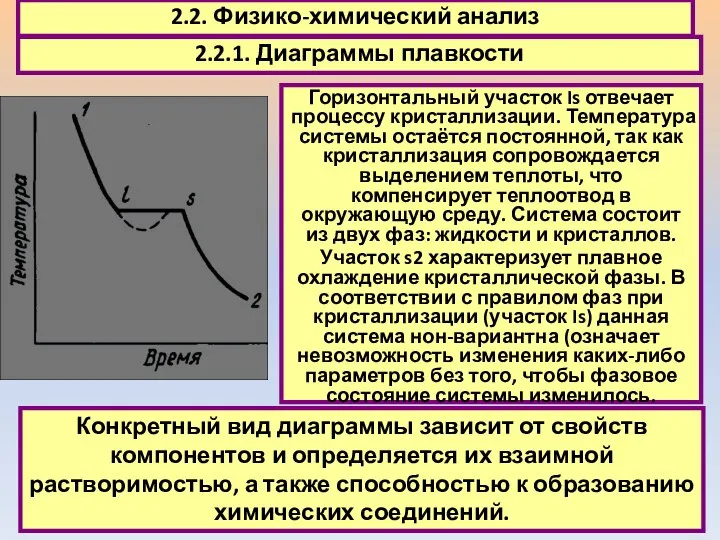
- 18. 2.2. Физико-химический анализ 2.2.1. Диаграммы плавкости Горизонтальный участок Is отвечает процессу кристаллизации. Температура системы остаётся постоянной,
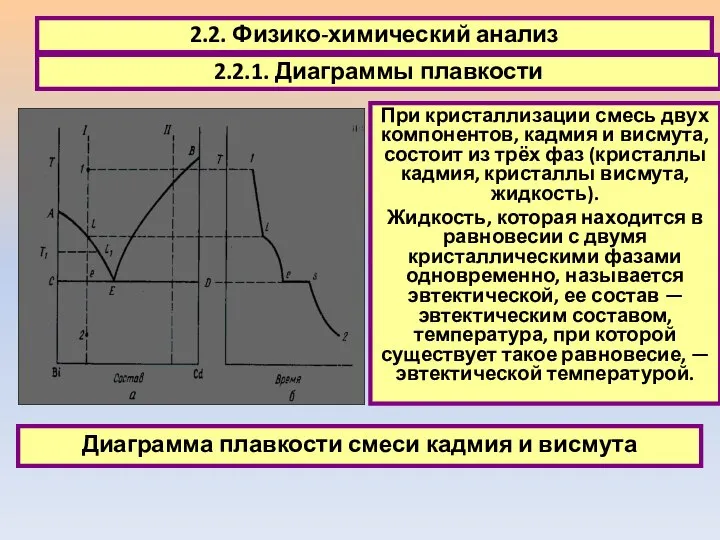
- 19. 2.2. Физико-химический анализ 2.2.1. Диаграммы плавкости При кристаллизации смесь двух компонентов, кадмия и висмута, состоит из
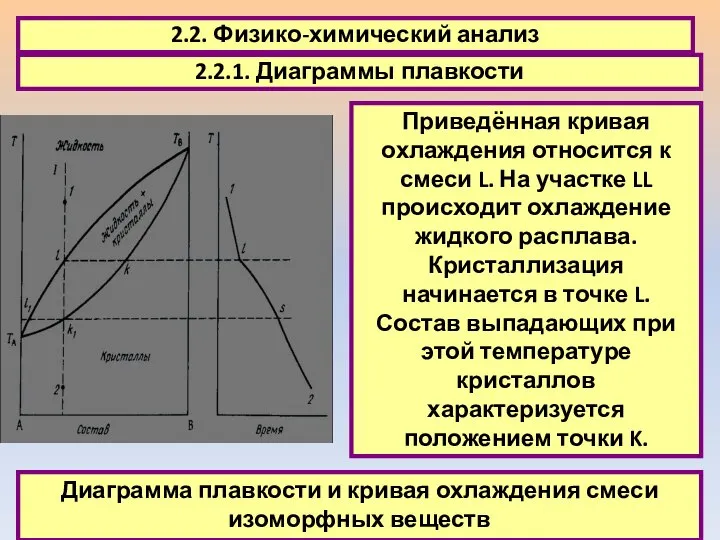
- 20. 2.2. Физико-химический анализ 2.2.1. Диаграммы плавкости Приведённая кривая охлаждения относится к смеси L. На участке LL
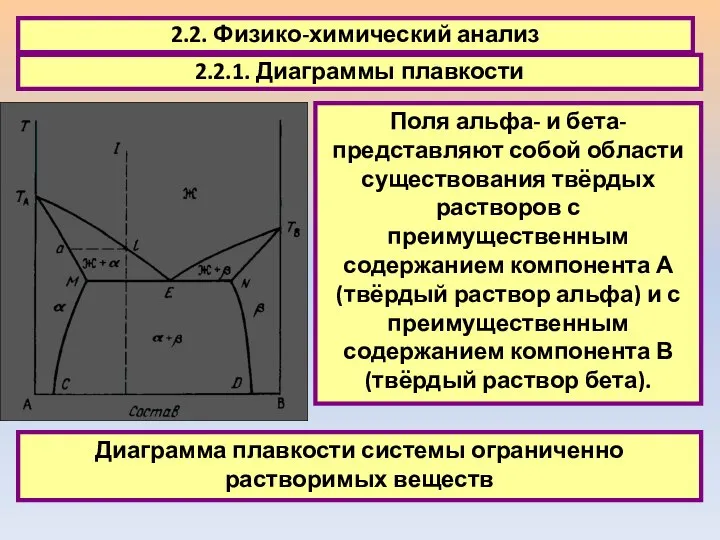
- 21. 2.2. Физико-химический анализ 2.2.1. Диаграммы плавкости Поля альфа- и бета- представляют собой области существования твёрдых растворов
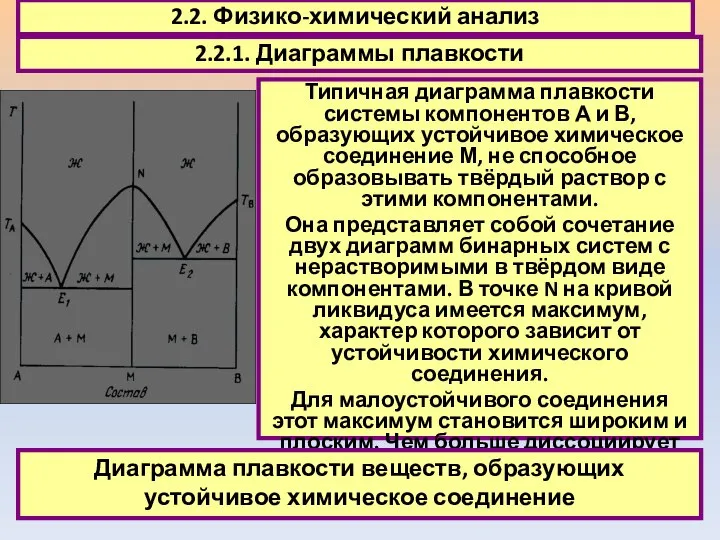
- 22. 2.2. Физико-химический анализ 2.2.1. Диаграммы плавкости Типичная диаграмма плавкости системы компонентов А и В, образующих устойчивое
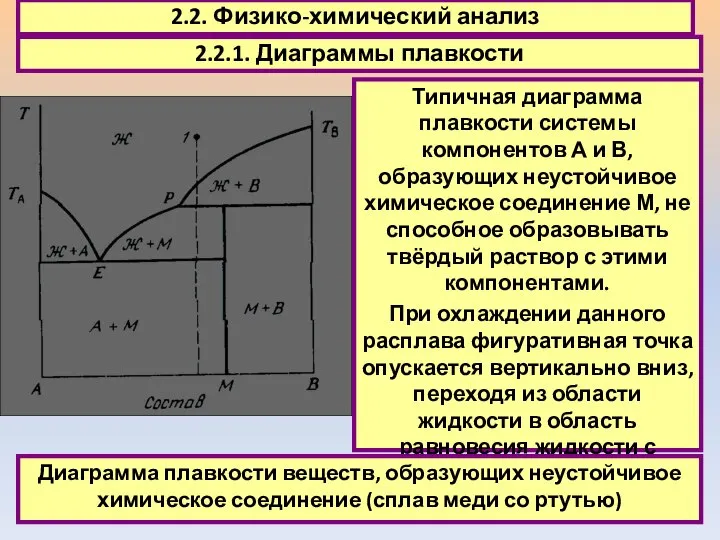
- 23. 2.2. Физико-химический анализ 2.2.1. Диаграммы плавкости Типичная диаграмма плавкости системы компонентов А и В, образующих неустойчивое
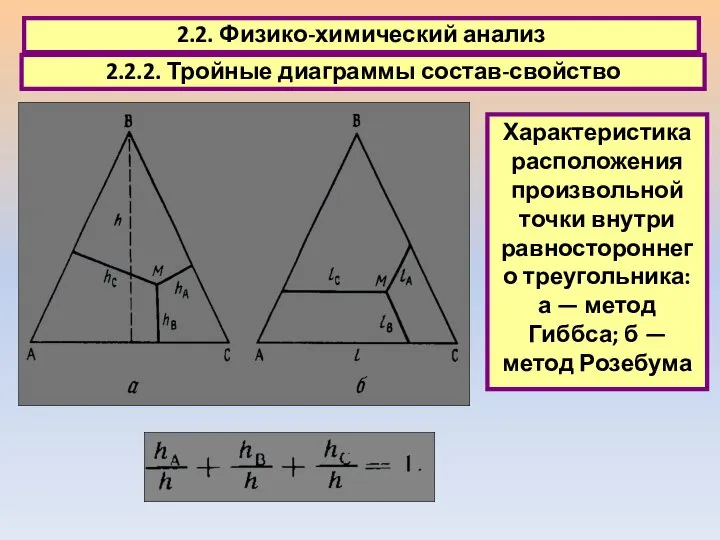
- 24. 2.2. Физико-химический анализ 2.2.2. Тройные диаграммы состав-свойство Характеристика расположения произвольной точки внутри равностороннего треугольника: а —
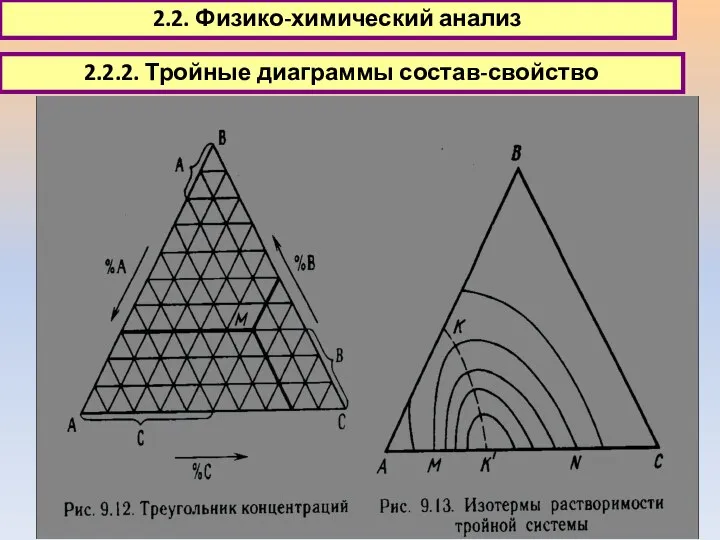
- 25. 2.2. Физико-химический анализ 2.2.2. Тройные диаграммы состав-свойство
- 26. 3. Поверхностные явления 3.1. Типы поверхностных явлений Поверхностное натяжение Поверхностные плёнки Расклинивающее давление (Дерябин) Смачивание поверхности,
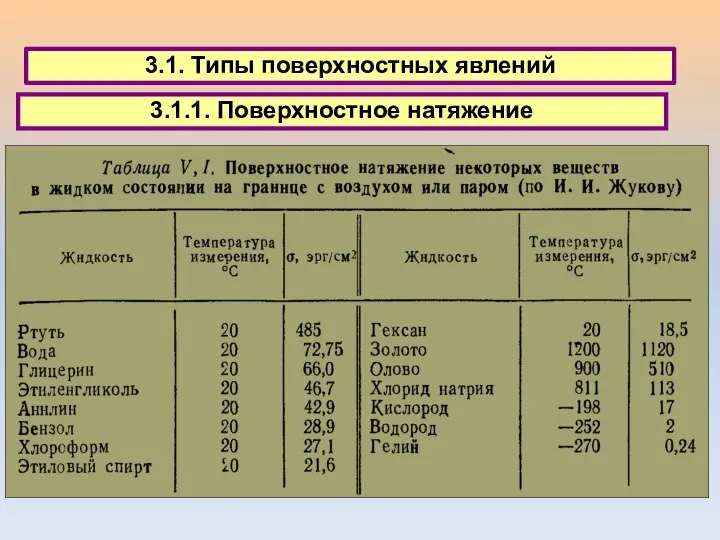
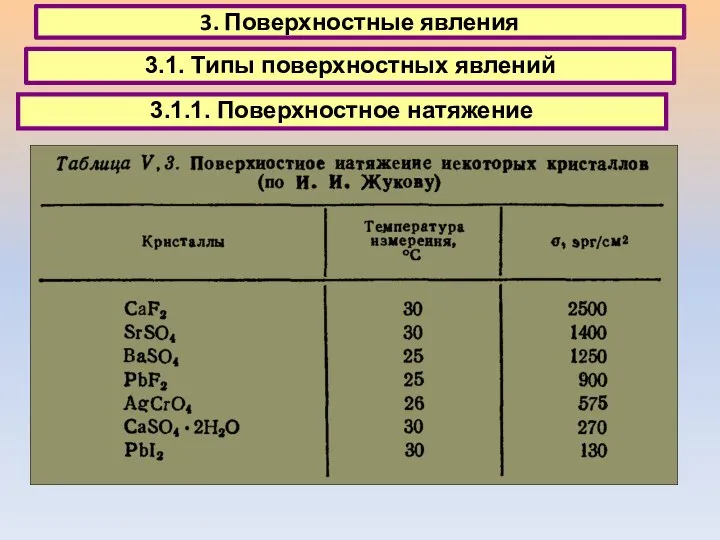
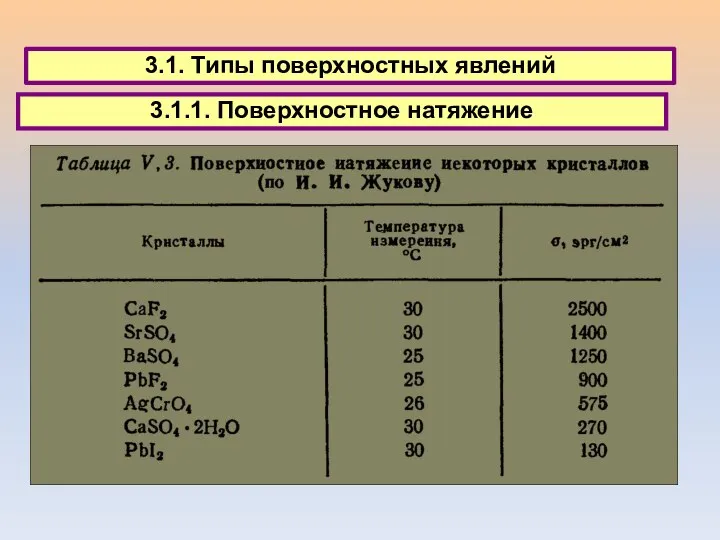
- 27. 3.1. Типы поверхностных явлений 3.1.1. Поверхностное натяжение
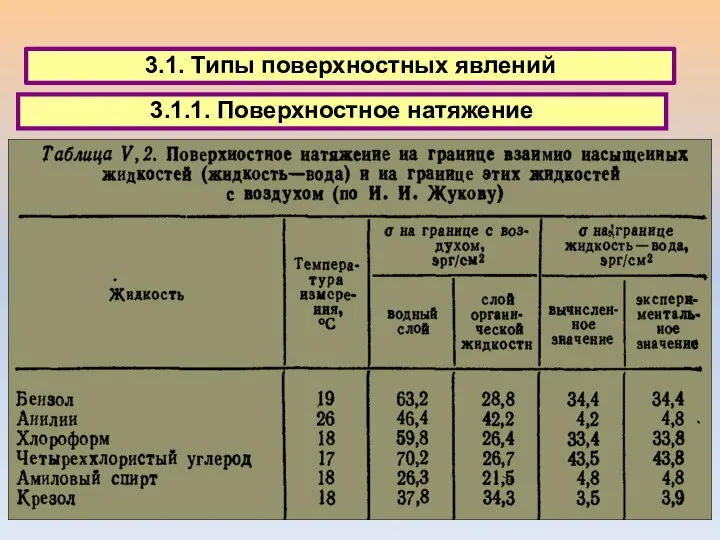
- 28. 3.1. Типы поверхностных явлений 3.1.1. Поверхностное натяжение
- 29. 3.1. Типы поверхностных явлений 3.1.1. Поверхностное натяжение
- 30. 3. Поверхностные явления 3.1. Типы поверхностных явлений 3.1.1. Поверхностное натяжение
- 31. 3.1. Типы поверхностных явлений 3.1.1. Поверхностное натяжение
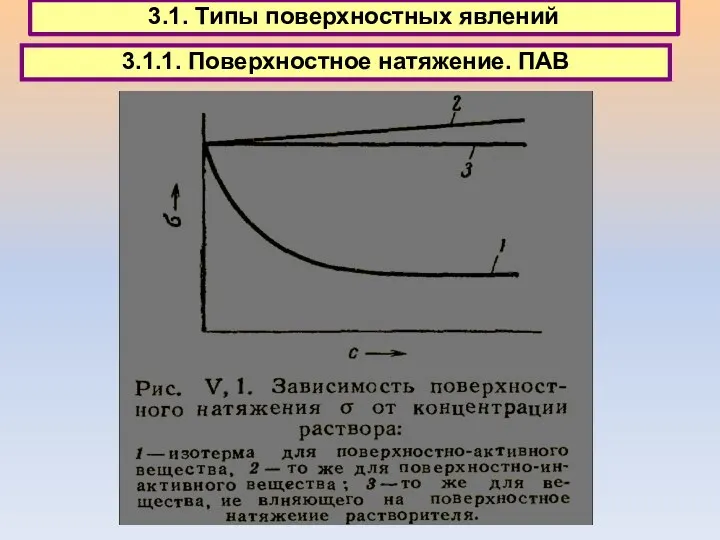
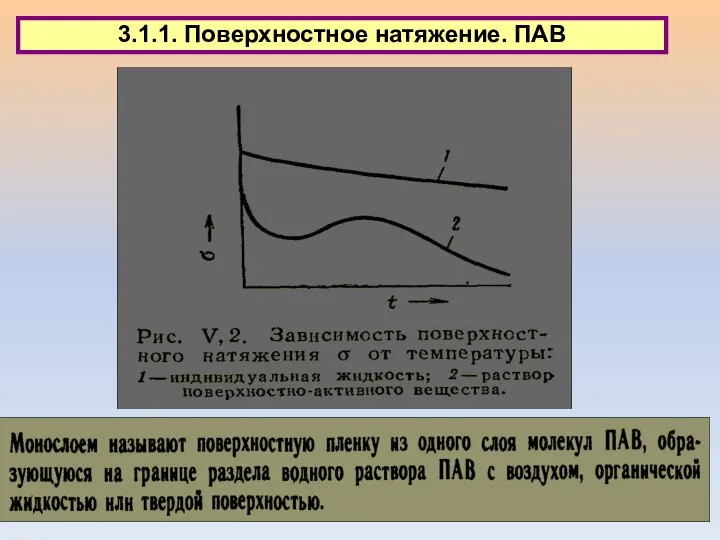
- 32. 3.1. Типы поверхностных явлений 3.1.1. Поверхностное натяжение. ПАВ
- 33. 3.1. Типы поверхностных явлений 3.1.1. Поверхностное натяжение. ПАВ
- 34. 3.1.1. Поверхностное натяжение. ПАВ
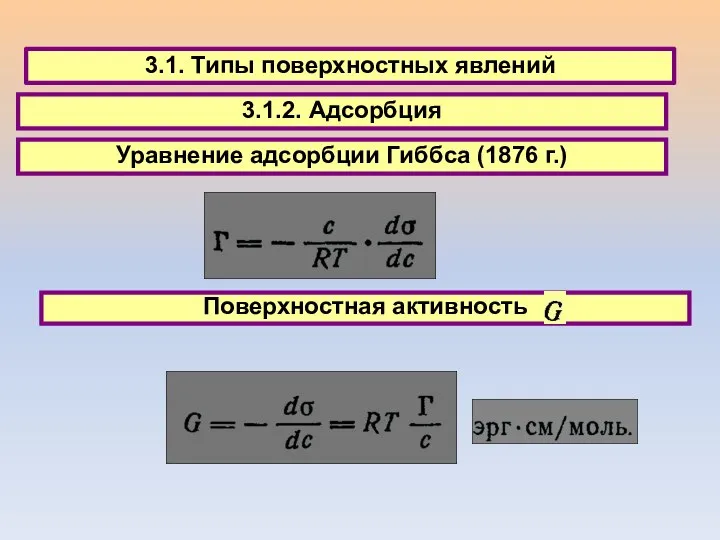
- 35. 3.1. Типы поверхностных явлений 3.1.2. Адсорбция Уравнение адсорбции Гиббса (1876 г.) Поверхностная активность
- 36. 3.1. Типы поверхностных явлений 3.1.2. Адсорбция Уравнение адсорбции Шишковского (1908 г.) Уравнение адсорбции Ленгмюра (1917 г.)
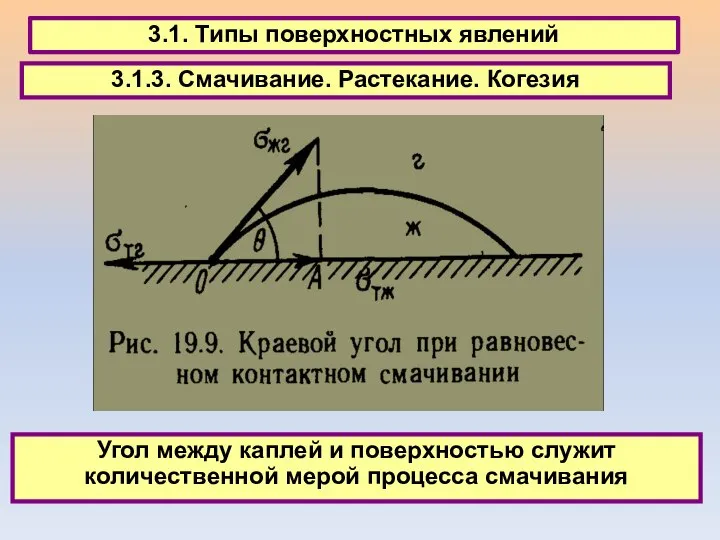
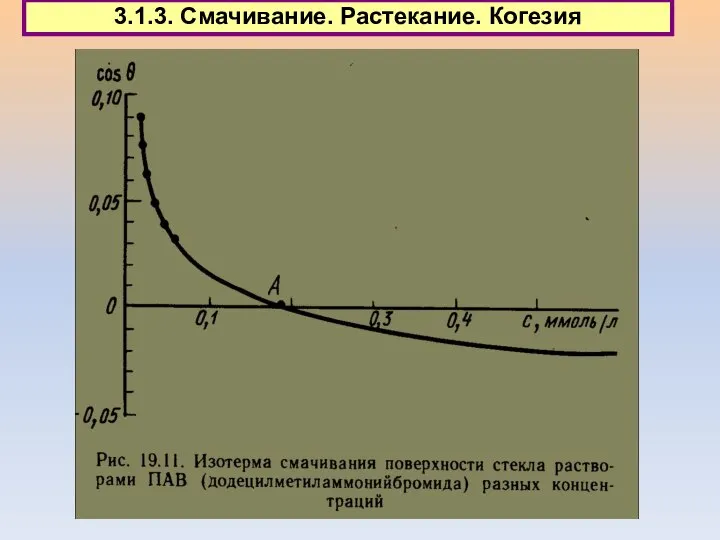
- 37. 3.1. Типы поверхностных явлений 3.1.3. Смачивание. Растекание. Когезия Угол между каплей и поверхностью служит количественной мерой
- 38. 3.1. Типы поверхностных явлений 3.1.3. Смачивание. Растекание. Когезия Угол между каплей и поверхностью служит количественной мерой
- 39. 3.1. Типы поверхностных явлений 3.1.3. Смачивание. Растекание. Когезия Уравнение Юнга (м – масло, в – вода)
- 40. 3.1.3. Смачивание. Растекание. Когезия
- 41. 3. Поверхностные явления 3.1.3. Смачивание. Растекание. Когезия
- 43. Скачать презентацию





















 Химия және медицина
Химия және медицина Colloid chemistry
Colloid chemistry Показатель активности водородных ионов. Лабораторная работа №4
Показатель активности водородных ионов. Лабораторная работа №4 Растворы. Теория электролитической диссоциации
Растворы. Теория электролитической диссоциации Пищевые жиры
Пищевые жиры  Биохимия витаминов. Водорастворимые витамины. (Лекция 21)
Биохимия витаминов. Водорастворимые витамины. (Лекция 21) Презентация к уроку химии в 8 классе « Вещество» Учитель химии МКОУ СОШ с.Айлино Савельева Н.А.
Презентация к уроку химии в 8 классе « Вещество» Учитель химии МКОУ СОШ с.Айлино Савельева Н.А. Нанотехнологии в химии
Нанотехнологии в химии  Шкала рН. Лекция 03-1
Шкала рН. Лекция 03-1 Исследовательская работа на тему: Лед и соль
Исследовательская работа на тему: Лед и соль Магний. Магний алудың электролиттік жолы. Магний алудың термиялық жолдары
Магний. Магний алудың электролиттік жолы. Магний алудың термиялық жолдары Физические свойства
Физические свойства Аминокислоты
Аминокислоты Счастливы вместе с химией
Счастливы вместе с химией Строение электронных оболочек атомов
Строение электронных оболочек атомов Производные изохинолина
Производные изохинолина Математический аппарат квантовой механики
Математический аппарат квантовой механики Реологические методы исследования пищевых продуктов
Реологические методы исследования пищевых продуктов Основные свойства материалов
Основные свойства материалов Карбоновые кислоты
Карбоновые кислоты Алкины. Физические и химические свойства
Алкины. Физические и химические свойства Функціональні матеріали для високоенергетичної електроніки. (Лекція 1)
Функціональні матеріали для високоенергетичної електроніки. (Лекція 1) Презентация по Химии "Жиры животных" - скачать смотреть
Презентация по Химии "Жиры животных" - скачать смотреть  Состав и свойства нефти
Состав и свойства нефти Олигонуклеотидный синтез
Олигонуклеотидный синтез Полусинтетическое масло
Полусинтетическое масло Крахмал (C6H10O5)n
Крахмал (C6H10O5)n  Аминокислоты
Аминокислоты