Содержание
- 2. … ЭТО ОСОБЫЙ ХИМИЧЕСКИЙ ЭЛЕМЕНТ : ОН ОСНОВА МНОГООБРАЗИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ, ИЗ КОТОРЫХ ПОСТРОЕНЫ ВСЕ ЖИВЫЕ
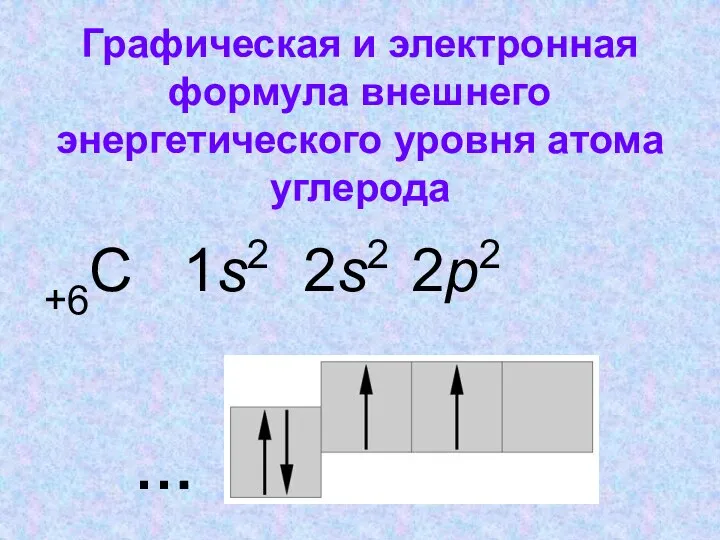
- 3. Графическая и электронная формула внешнего энергетического уровня атома углерода +6С 1s2 2s2 2p2 ……
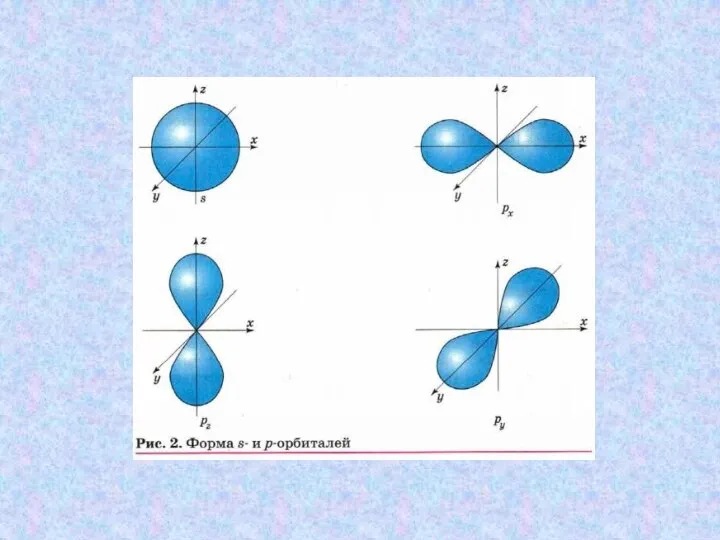
- 4. Орбитали в атоме углерода Атом углерода имеет два вида орбиталей: s-орбитали сферической формы и р-орбитали в
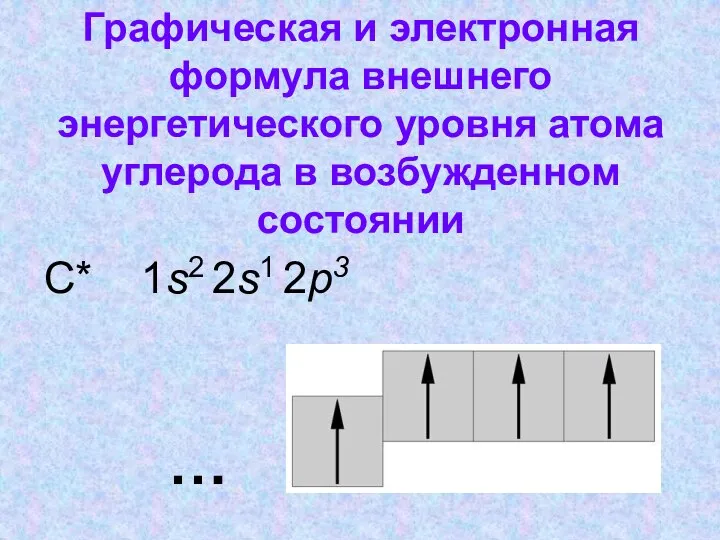
- 6. Возбужденное состояние атома углерода Валентность химического элемента чаще всего определяется числом неспаренных электронов. Атом углерода, как
- 7. Графическая и электронная формула внешнего энергетического уровня атома углерода в возбужденном состоянии С* 1s2 2s1 2p3
- 8. ВАЛЕНТНЫЕ СОСТОЯНИЯ АТОМА УГЛЕРОДА Атомы углерода, входящие в состав органических соединений, могут находиться в трёх валентных
- 9. Гибридизация – взаимное выравнивание электронных облаков в атоме углерода (Лайнус Полинг, 30-е годы XX века)
- 10. Типы гибридизации: sp3-гибридизация sp2-гибридизация sp-гибридизация
- 11. Первое валентное состояние 4 гибридных облака Н │ Н – С – Н │ Н
- 12. Второе валентное состояние 3 гибридных облака σ π Н2С = СН2
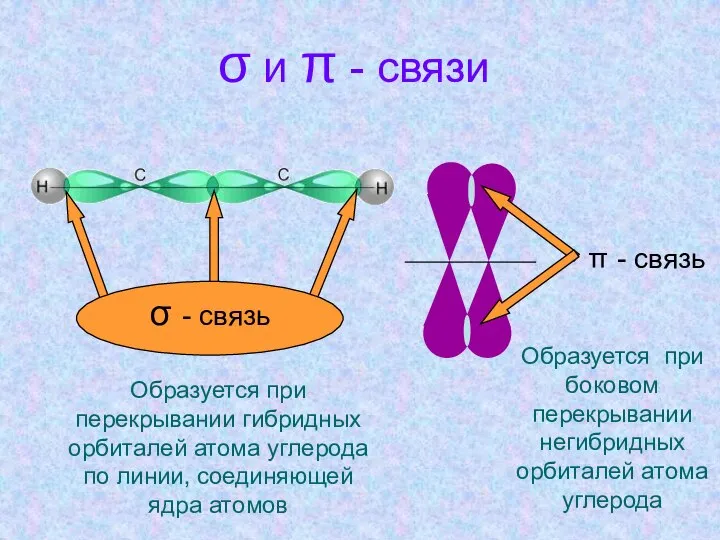
- 13. σ и π - связи Образуется при перекрывании гибридных орбиталей атома углерода по линии, соединяющей ядра
- 15. Скачать презентацию








 Геохимия урана и тория в магматическом процессе
Геохимия урана и тория в магматическом процессе Адсорбционные взаимодействия
Адсорбционные взаимодействия Карбоновые кислоты. Модели молекул
Карбоновые кислоты. Модели молекул Аэробное окисление углеводов. (Часть 1)
Аэробное окисление углеводов. (Часть 1) Количественные измерения в химии. Количество вещества. Моль
Количественные измерения в химии. Количество вещества. Моль Новые вещества и материалы Презентация по химии Ученицы 11 класса Закатаевой Тани_
Новые вещества и материалы Презентация по химии Ученицы 11 класса Закатаевой Тани_ Катарометрический метод контроля
Катарометрический метод контроля Моющие и чистящие средства
Моющие и чистящие средства Органічні сполуки в побуті
Органічні сполуки в побуті  Средства защиты растений от болезней. (Лекция 7)
Средства защиты растений от болезней. (Лекция 7) Подготовка к ГИА. Тренажер по химии
Подготовка к ГИА. Тренажер по химии Введение в органическую химию
Введение в органическую химию Пластмассы, резины и композиционные материалы
Пластмассы, резины и композиционные материалы Распространенные названия некоторых неорганических веществ
Распространенные названия некоторых неорганических веществ Дидактические игры на уроках химии и биологии
Дидактические игры на уроках химии и биологии Значення хімії в повсякденному житті
Значення хімії в повсякденному житті  Полифункциональные соединения. Гетерофункциональные соединения. Структура и функции биолекул
Полифункциональные соединения. Гетерофункциональные соединения. Структура и функции биолекул "We know it only takes one critically short telomere to make a cell die, so it's clear that the more really short telomeres a person has the faster problems will develop.“ Carol Greider Образ жизни и длина теломер
"We know it only takes one critically short telomere to make a cell die, so it's clear that the more really short telomeres a person has the faster problems will develop.“ Carol Greider Образ жизни и длина теломер Презентация по Химии "«Алкены»" - скачать смотреть
Презентация по Химии "«Алкены»" - скачать смотреть  Химические свойства металлов
Химические свойства металлов Органические производные трехвалентного фосфора
Органические производные трехвалентного фосфора Создание косметических средств
Создание косметических средств Анализ карбоновых кислот и их производных
Анализ карбоновых кислот и их производных Витамины. Общая характеристика витаминов
Витамины. Общая характеристика витаминов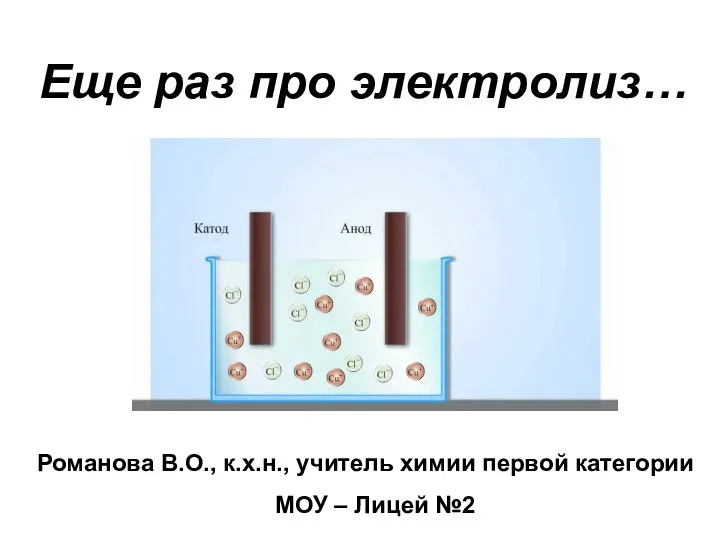 Еще раз про электролиз…
Еще раз про электролиз… 8 класс
8 класс  Анализ воды природных источников посёлков Фруктовая и Красная Пойма городского округа Луховицы
Анализ воды природных источников посёлков Фруктовая и Красная Пойма городского округа Луховицы Алкогольді мастықты талдаудың физико-химиялық әдістері
Алкогольді мастықты талдаудың физико-химиялық әдістері