Содержание
- 2. Набухание – увеличение объема и массы полимера при контакте с растворителем. Количественной мерой является степень набухания
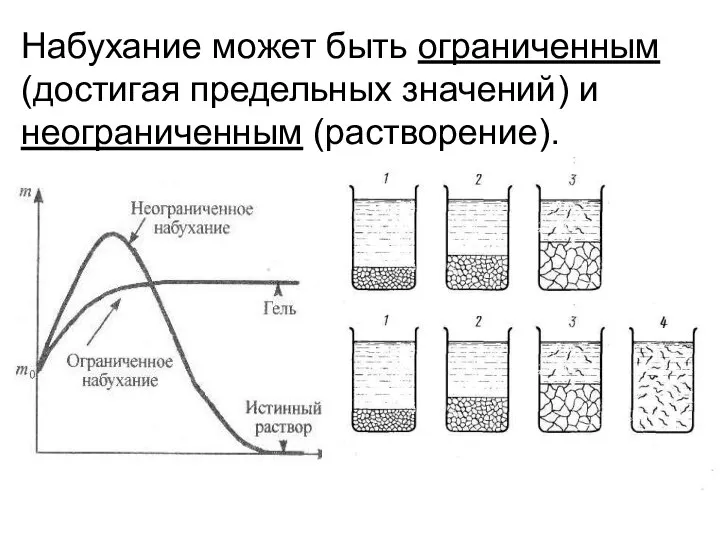
- 3. Набухание может быть ограниченным (достигая предельных значений) и неограниченным (растворение).
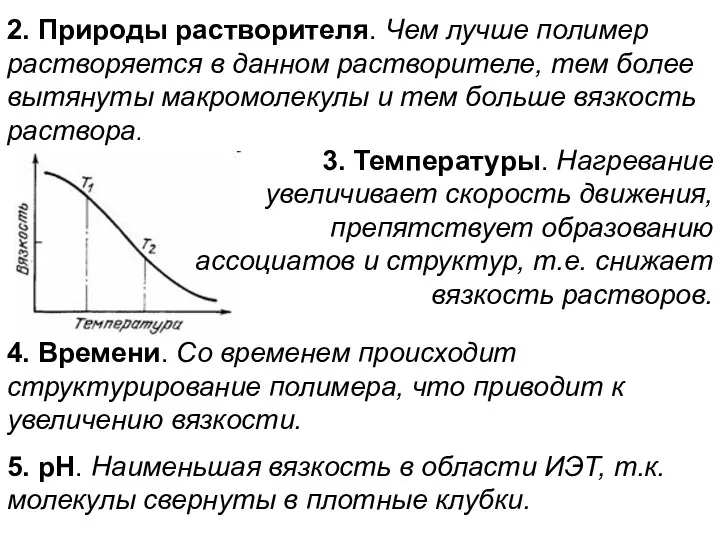
- 4. 2. Набухание зависит от температуры и степени измельченности - прямопропорционально. Факторы, влияющие на набухание Природа полимера
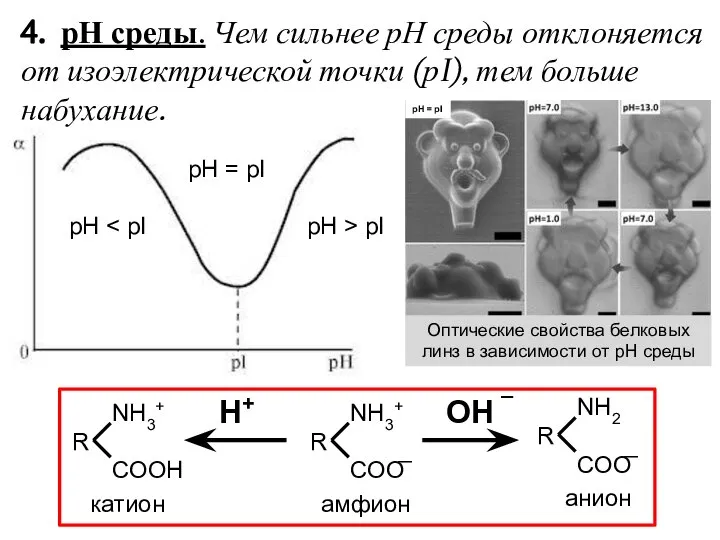
- 5. 4. рН среды. Чем сильнее рН среды отклоняется от изоэлектрической точки (рI), тем больше набухание. рН
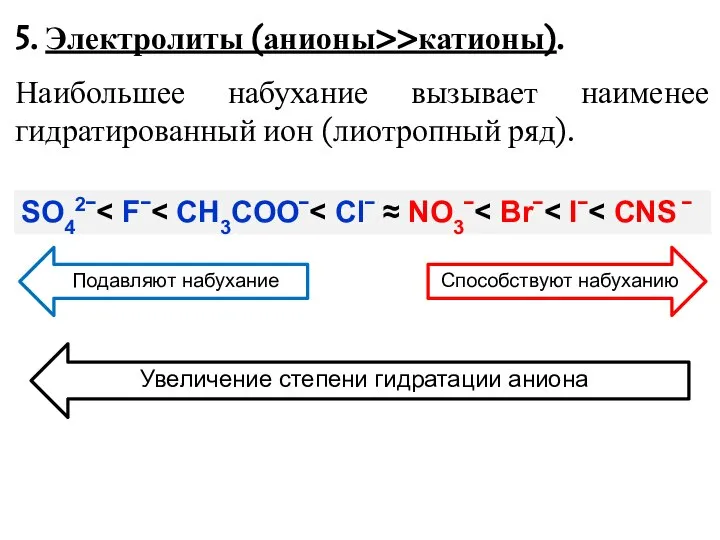
- 6. 5. Электролиты (анионы>>катионы). Наибольшее набухание вызывает наименее гидратированный ион (лиотропный ряд). SO42ˉ
- 7. в период утробной жизни младенца и у детей младшего возраста обеспечивает интенсивный обмен веществ; прорастание семян,
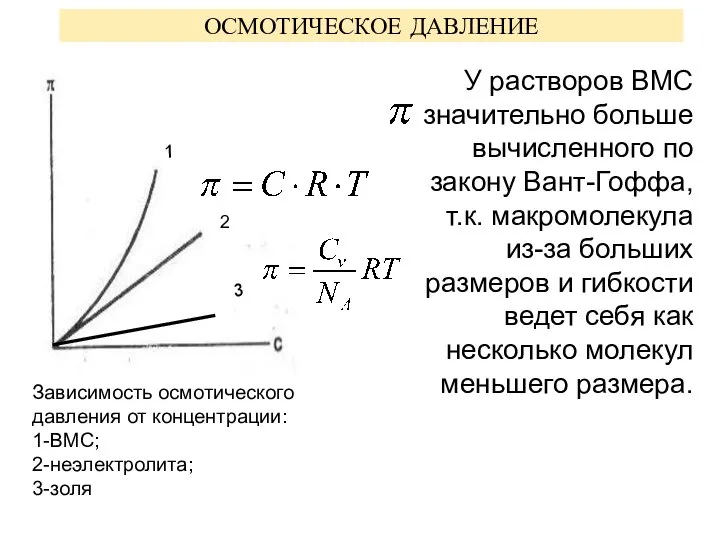
- 8. ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ У растворов ВМС значительно больше вычисленного по закону Вант-Гоффа, т.к. макромолекула из-за больших размеров
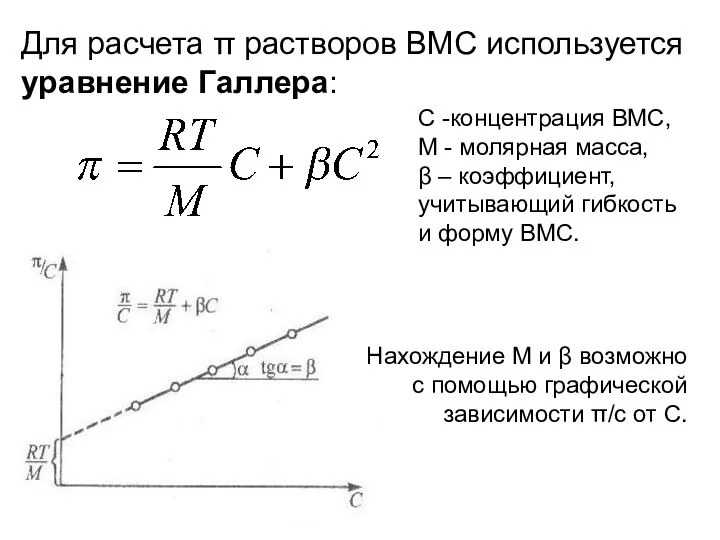
- 9. Для расчета π растворов ВМС используется уравнение Галлера: С -концентрация ВМС, М - молярная масса, β
- 10. ОНКОТИЧЕСКОЕ ДАВЛЕНИЕ В крови, содержащей неэлектролиты, электролиты и белки, каждый компонент вносить свой вклад в суммарное
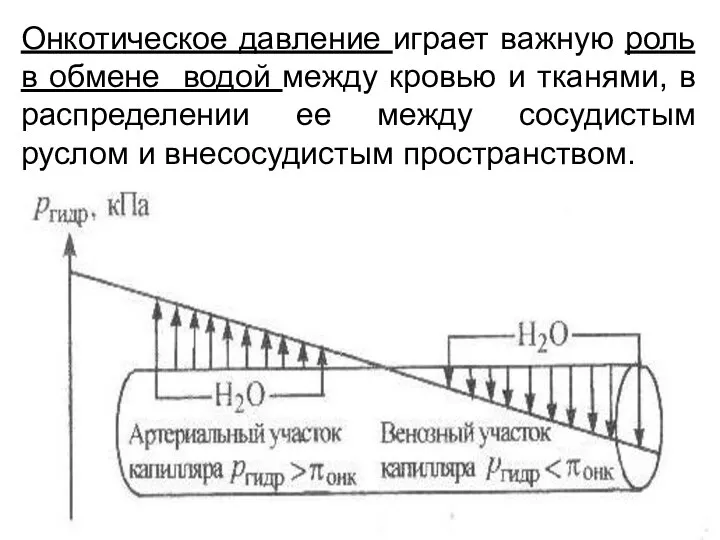
- 11. Онкотическое давление играет важную роль в обмене водой между кровью и тканями, в распределении ее между
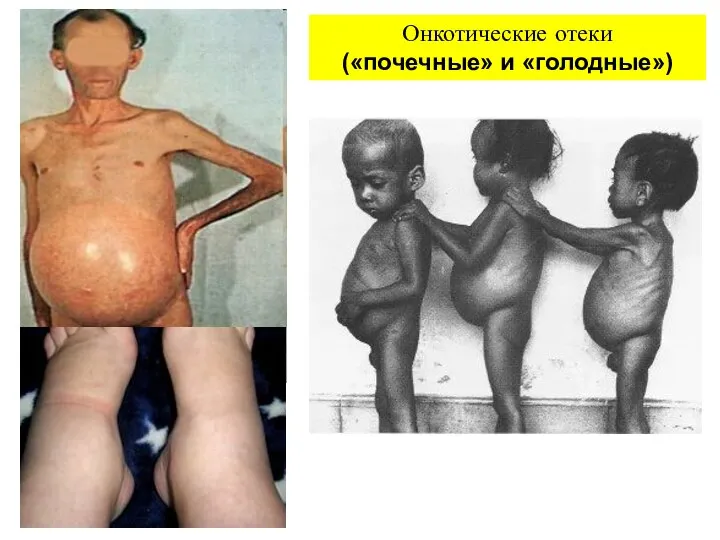
- 12. Онкотические отеки («почечные» и «голодные»)
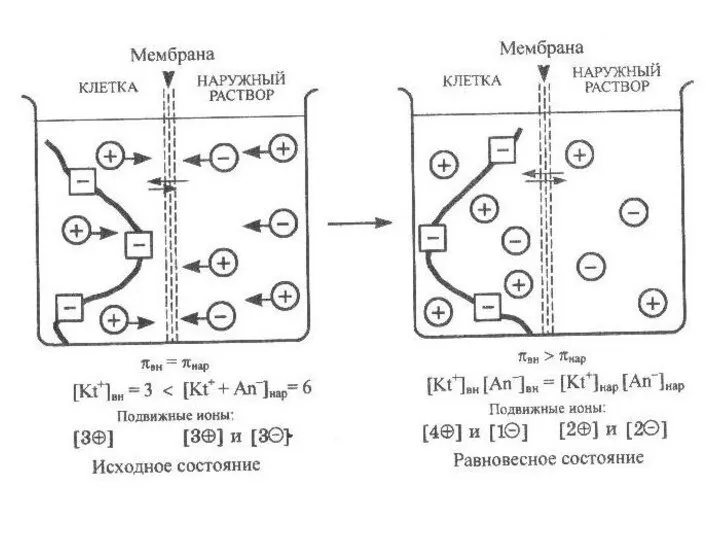
- 13. Наличие в клетке ионов, белков приводит к установлению мембранного равновесия Доннана - равновесия, устанавливающегося в системе
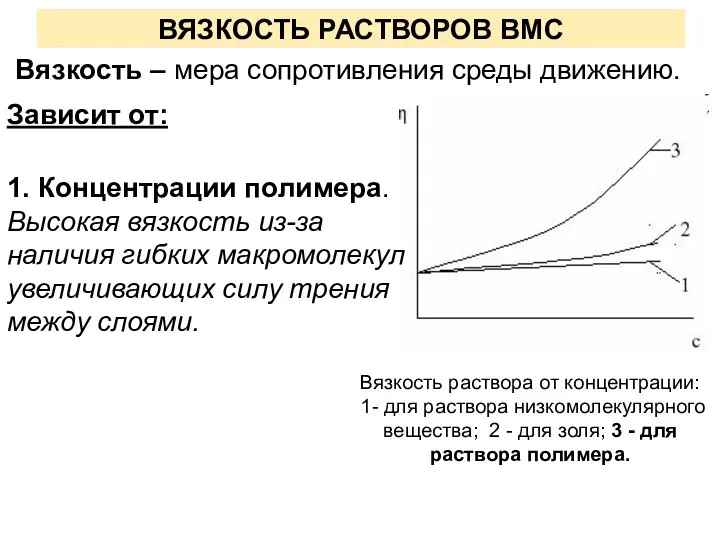
- 15. ВЯЗКОСТЬ РАСТВОРОВ ВМС Зависит от: 1. Концентрации полимера. Высокая вязкость из-за наличия гибких макромолекул увеличивающих силу
- 16. Для расчета вязкости очень разбавленных растворов ВМС, в которых макромолекулы не взаимодействуют друг с другом применяют
- 17. 2. Природы растворителя. Чем лучше полимер растворяется в данном растворителе, тем более вытянуты макромолекулы и тем
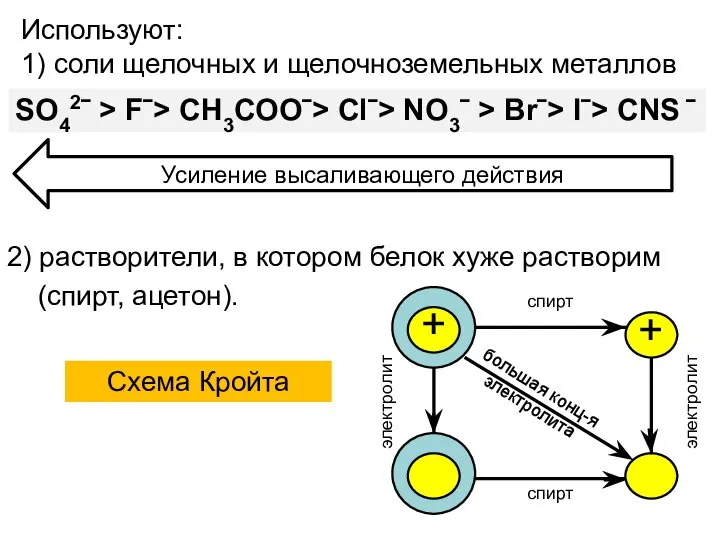
- 18. Нарушение устойчивости Устойчивость водного раствора белка определяется двумя факторами: - наличием заряда белковой молекулы; - -
- 19. 2) растворители, в котором белок хуже растворим (спирт, ацетон). Схема Кройта SO42ˉ > Fˉ> CH3COOˉ> Clˉ>
- 20. Необратимое осаждение – полное разрушение пространственной структуры белка, приводящие к потере ими нативных свойств (растворимости, биологической
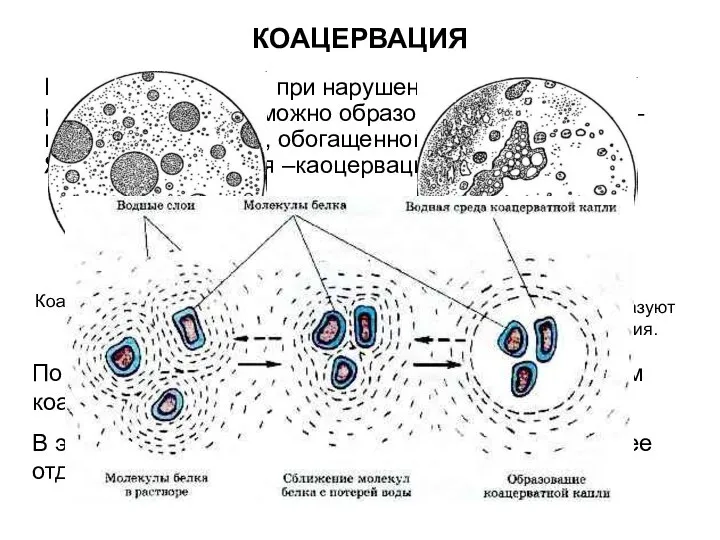
- 21. КОАЦЕРВАЦИЯ Кроме высаливания при нарушении устойчивости раствора белка возможно образование каоцервата – новой жидкой фазы, обогащенной
- 22. Структурообразование в растворах ВМС
- 23. К явлениям нарушения устойчивости коллоидов и полимеров относят и протекающие в них процессы структурообразования. Для наименования
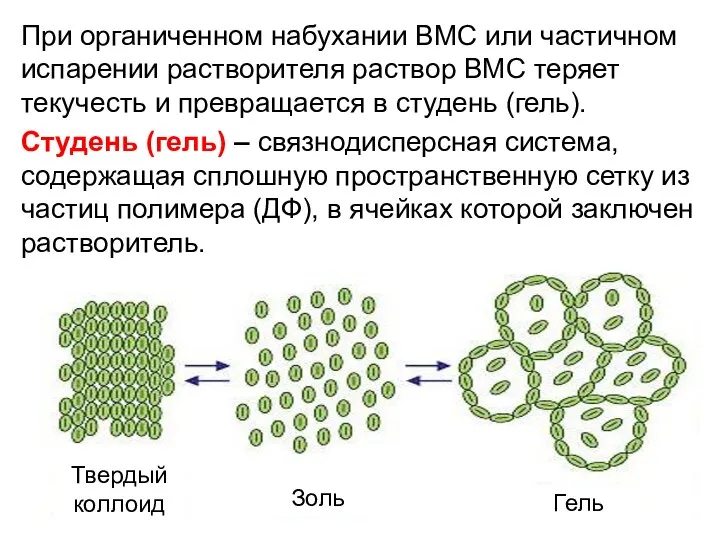
- 24. При органиченном набухании ВМС или частичном испарении растворителя раствор ВМС теряет текучесть и превращается в студень
- 25. Студнеобразование напоминает процесс коагуляции, но при коагуляции ДСи разделяется на две фазы – ДС и ДФ.
- 26. СВОЙСТВА ГЕЛЕЙ Студни (гели) под влиянием механических воздействий могут разжижаться и самопроизвольно восстанавливать свои свойства в
- 28. Скачать презентацию












 Структурная механика композитов. Слоистый композит
Структурная механика композитов. Слоистый композит Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Изотермический процесс в реакционном объеме. (Тема 6.2)
Изотермический процесс в реакционном объеме. (Тема 6.2) Способы выражения концентрации в титриметрическом анализе
Способы выражения концентрации в титриметрическом анализе Кислород. Характеристика и применение
Кислород. Характеристика и применение Химическая связь
Химическая связь Электроны в кристаллах. Квантовая теория свободных электронов в металлах
Электроны в кристаллах. Квантовая теория свободных электронов в металлах Нахождение металлов в природе
Нахождение металлов в природе  Яковлева Татьяна Алексеевна Ярославль, 2009 г.
Яковлева Татьяна Алексеевна Ярославль, 2009 г.  Строение атома Автор презентации: учитель МОУ СОШ пгт. Новокручининский Забайкальского края Журова О. В.
Строение атома Автор презентации: учитель МОУ СОШ пгт. Новокручининский Забайкальского края Журова О. В. Химическая кинетика. (Лекция 11)
Химическая кинетика. (Лекция 11) Соли и реакции ионного обмена
Соли и реакции ионного обмена Фенол. Физические и химические свойства фенола
Фенол. Физические и химические свойства фенола Факторы, влияющие на смещение химического равновесия (концентрация реагентов, температура, давление )
Факторы, влияющие на смещение химического равновесия (концентрация реагентов, температура, давление ) Карбонат калия K2CO3
Карбонат калия K2CO3 Алюминий и его соединения
Алюминий и его соединения Метасоматический процесс
Метасоматический процесс Презентация по Химии "Природные источники углеводородов" - скачать смотреть бесплатно
Презентация по Химии "Природные источники углеводородов" - скачать смотреть бесплатно Методика изучения современной теории строения органических веществ
Методика изучения современной теории строения органических веществ Презентация по Химии "Скорость протекания коррозии и способы защиты от неё" - скачать смотреть
Презентация по Химии "Скорость протекания коррозии и способы защиты от неё" - скачать смотреть  Выделение физической химии в самостоятельную отрасль науки
Выделение физической химии в самостоятельную отрасль науки Презентация по Химии "Молоко" - скачать смотреть бесплатно
Презентация по Химии "Молоко" - скачать смотреть бесплатно Роль кварца в процессах зарождения и эволюция жизни
Роль кварца в процессах зарождения и эволюция жизни Металічні елементи
Металічні елементи Химические знаки и химические формулы Задачи урока: Познакомиться с химическими знаками химических элементов. Рассмотреть стру
Химические знаки и химические формулы Задачи урока: Познакомиться с химическими знаками химических элементов. Рассмотреть стру Общая и неорганическая химия. Введение
Общая и неорганическая химия. Введение Строение вещества. Строение атома и периодическая система элементов
Строение вещества. Строение атома и периодическая система элементов Химия. Атомы, молекулы и ионы
Химия. Атомы, молекулы и ионы