Содержание
- 2. Согласно проекту КИМ 2014 года в содержание и структуру ЕГЭ по химии могут быть внесены следующие
- 3. rischat.g@yandex.ru
- 4. Характерные получения и химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (А13,14,17, В1,6, С3,5)
- 5. АЛКАНЫ СnH2n+2 -ан
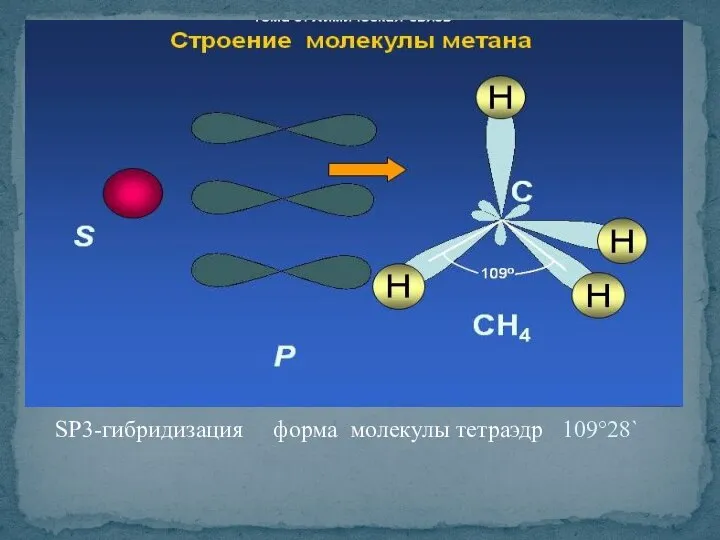
- 6. SP3-гибридизация форма молекулы тетраэдр 109°28`
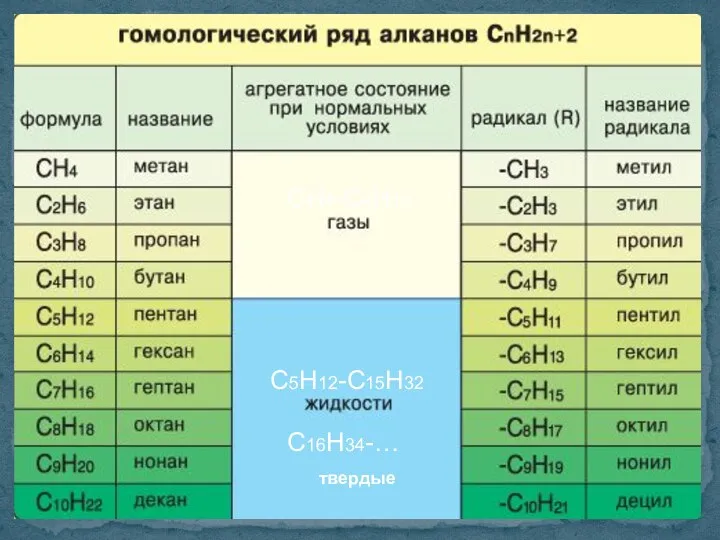
- 7. СН4-С4Н10 С5Н12-С15Н32 С16Н34-… твердые
- 8. АЛКАНЫ (ПАРАФИНЫ)
- 9. Химические свойства
- 10. Химические свойства
- 11. Химические свойства
- 12. ЦИКЛОАЛКАНЫ CnH2n цикло-
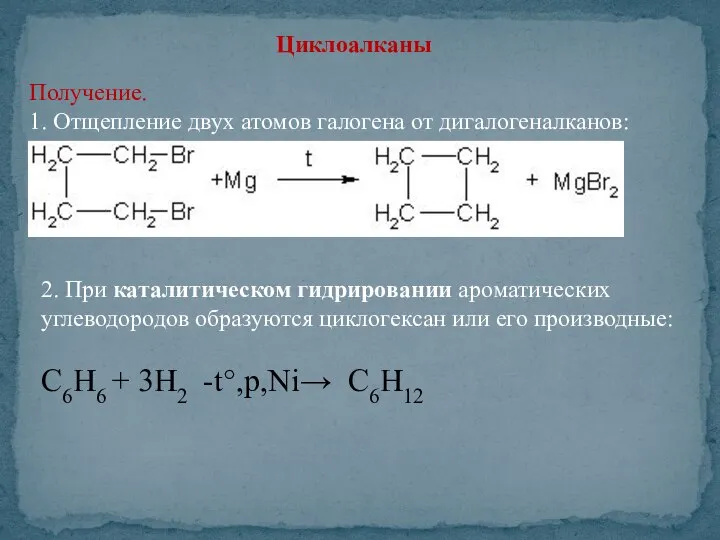
- 13. Циклоалканы Получение. 1. Отщепление двух атомов галогена от дигалогеналканов: 2. При каталитическом гидрировании ароматических углеводородов образуются
- 14. Химические свойства 1) Гидрирование. При каталитическом гидрировании разрываются с образованием алканов. С3Н6+ H2 -120ºC,Ni? CH3–CH2–CH3 2)
- 15. 5) Галогенирование: циклопентан реагируют с галогенами на свету, вступая в реакцию замещения С5Н10 + С12-(свет)? С5Н10+НС1
- 16. АЛКЕНЫ CnH2n
- 18. Алкены
- 20. Химические свойства
- 23. АЛКАДИЕНЫ CnH2n-2 -диен
- 24. АЛКАДИЕНЫ
- 26. ХИМИЧЕСКИЕ СВОЙСТВА
- 29. АЛКИНЫ CnH2n-2 -ин
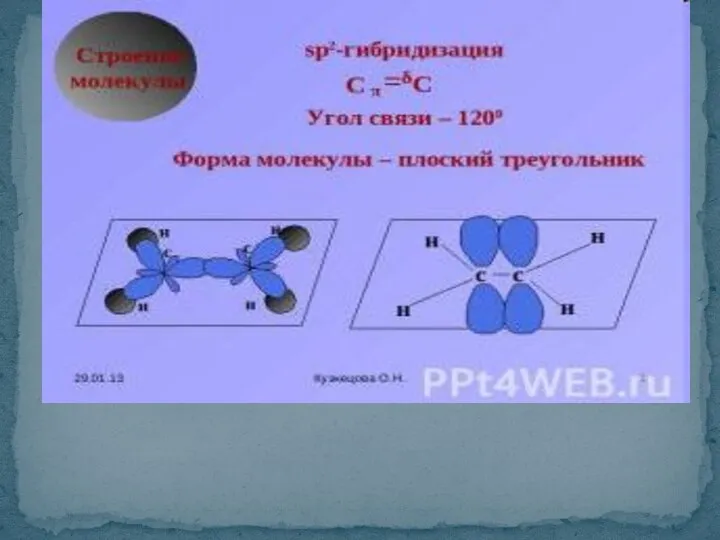
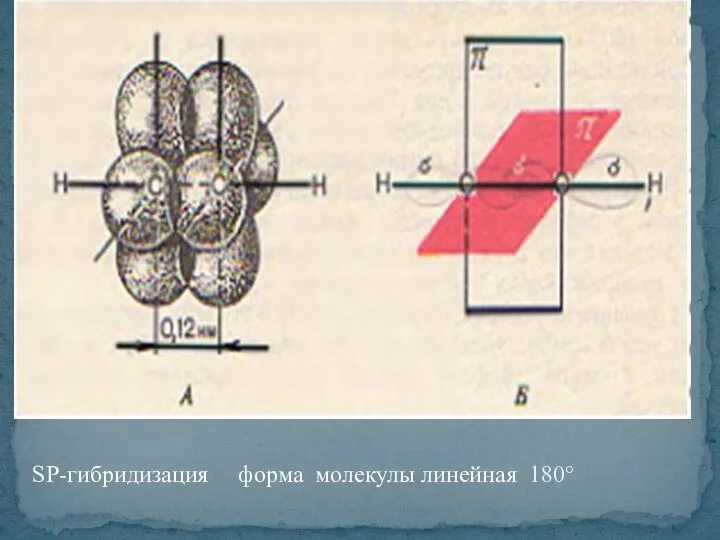
- 30. SP-гибридизация форма молекулы линейная 180°
- 31. АЛКИНЫ
- 33. 1. Реакции присоединения. А. Гидрирование: В присутствии металлических катализаторов (Pt, Ni) алкины присоединяют водород с образованием
- 34. В. Гидрогалогенирование. Присоединение галогеноводородов также идет по электрофильному механизму. Продукты присоединения к несимметричным алкинам определяются правилом
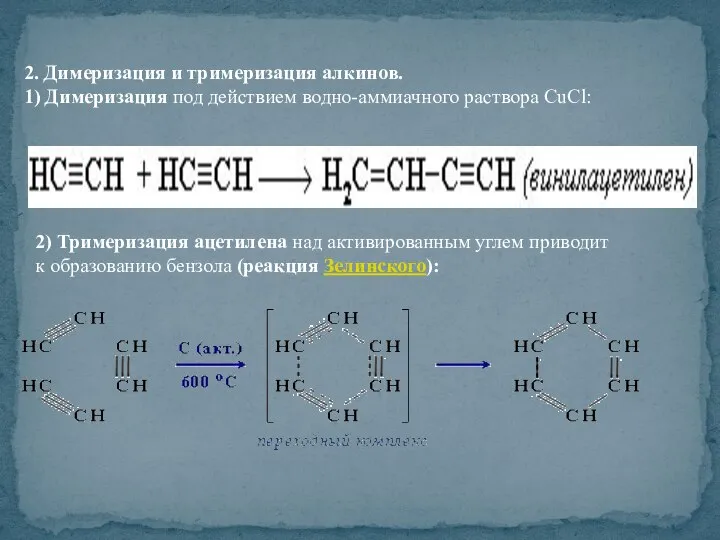
- 35. 2. Димеризация и тримеризация алкинов. 1) Димеризация под действием водно-аммиачного раствора CuCl: 2) Тримеризация ацетилена над
- 36. 3. Кислотные свойства алкинов с концевой тройной связью. Образование солей: концевые атомы водорода у ацетилена и
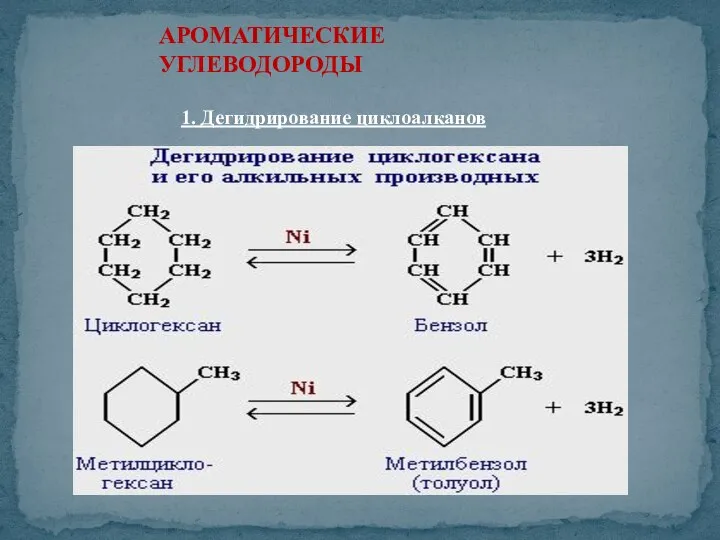
- 37. АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ 1. Дегидрирование циклоалканов
- 38. АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ CnH2n-6
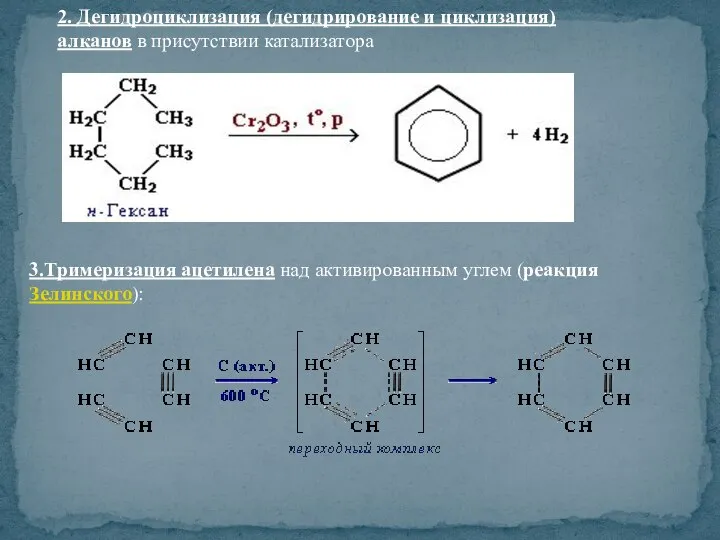
- 39. 2. Дегидроциклизация (дегидрирование и циклизация) алканов в присутствии катализатора 3.Тримеризация ацетилена над активированным углем (реакция Зелинского):
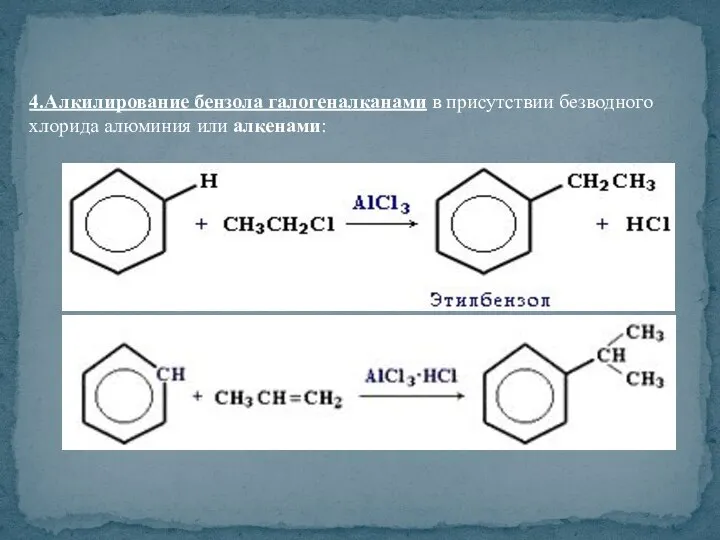
- 40. 4.Алкилирование бензола галогеналканами в присутствии безводного хлорида алюминия или алкенами:
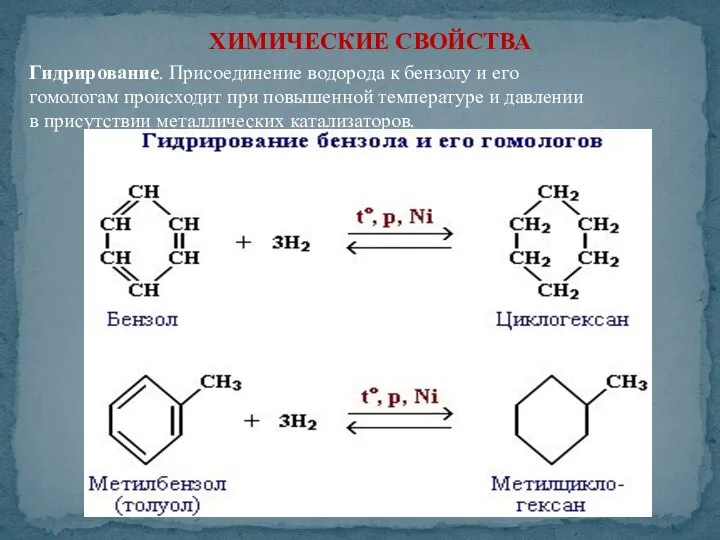
- 41. ХИМИЧЕСКИЕ СВОЙСТВА Гидрирование. Присоединение водорода к бензолу и его гомологам происходит при повышенной температуре и давлении
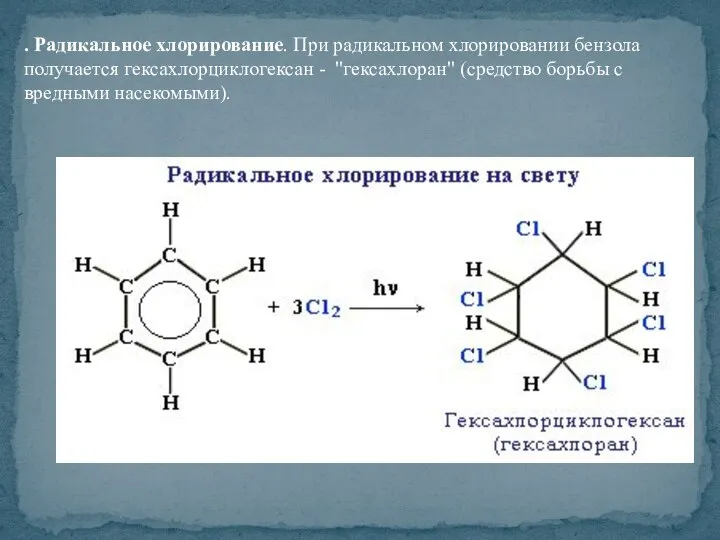
- 42. . Радикальное хлорирование. При радикальном хлорировании бензола получается гексахлорциклогексан - "гексахлоран" (средство борьбы с вредными насекомыми).
- 43. Галогенирование Замещение атома водорода в бензольном кольце на галоген происходит в присутствии катализаторов AlCl3, AlBr3, FeCl3
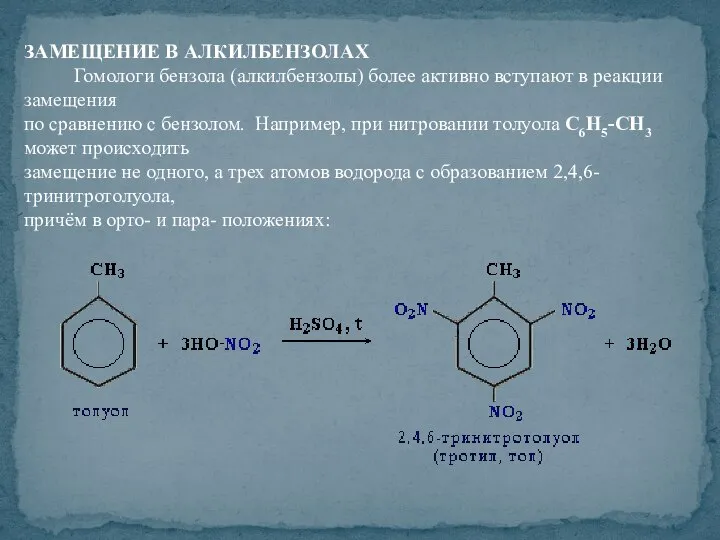
- 44. ЗАМЕЩЕНИЕ В АЛКИЛБЕНЗОЛАХ Гомологи бензола (алкилбензолы) более активно вступают в реакции замещения по сравнению с бензолом.
- 45. А13. Бутен-1 является структурным изомером 1)бутана 3)бутина 2)циклобутана 4) бутадиена
- 46. А17. Бутанол-1 образуется в результате взаимодействия бутана с гидроксидом натрия бутена-1 с водородом бутаналя с водородом
- 47. А14. В соответствии с правилом Марковникова присоединение бромоводорода к 2-метилпропену приводит к образованию 2-метил-1-бромпропена 2-метил-1-бромпропана 2-метил-2-бромпропана
- 48. В1. Установите соответствие между названием соединения и общей формулой гомологического ряда, к которому оно принадлежит. НАЗВАНИЕ
- 49. В6 С этином могут взаимодействовать 1)иодоводород 4) этилацетат 2)метан 5) натрий 3)вода 6) азот Ответ:
- 51. Скачать презентацию




































 Обзор свойств неметаллов.. Окислительно-восстановительные свойства типичных неметаллов
Обзор свойств неметаллов.. Окислительно-восстановительные свойства типичных неметаллов Яковлева Татьяна Алексеевна Ярославль, 2009 г.
Яковлева Татьяна Алексеевна Ярославль, 2009 г.  Природный газ
Природный газ Роль йода в организме
Роль йода в организме Спиртовое, масляное и кисломолочное брожение
Спиртовое, масляное и кисломолочное брожение Вермикулит. Технические характеристики
Вермикулит. Технические характеристики Правила безпечного використання засобів побутової хімії.
Правила безпечного використання засобів побутової хімії.  Кислород
Кислород Фосфорорганические соединения
Фосфорорганические соединения Алкадиены. Состав и строение
Алкадиены. Состав и строение Активна реакція водних розчинів
Активна реакція водних розчинів Система приготовления и подачи реагентов KPJ
Система приготовления и подачи реагентов KPJ Презентация по химии Количественный анализ Химические методы анализа
Презентация по химии Количественный анализ Химические методы анализа  Скорость реакции и температура. (Лекция 10)
Скорость реакции и температура. (Лекция 10) Кислотность и основность органических соединений. Реакционная способность спиртов, фенолов, тиолов и аминов
Кислотность и основность органических соединений. Реакционная способность спиртов, фенолов, тиолов и аминов Бор и его соединения
Бор и его соединения Сероводород. Сернистый водород, сульфид водорода, дигидросульфид
Сероводород. Сернистый водород, сульфид водорода, дигидросульфид Презентация по Химии "Дисперсные системы" - скачать смотреть
Презентация по Химии "Дисперсные системы" - скачать смотреть  Atomic structure. Introduction
Atomic structure. Introduction Нафта та її переробка
Нафта та її переробка  Особенности сжигания твердого, жидкого и газообразного топлива
Особенности сжигания твердого, жидкого и газообразного топлива Аттестационная работа. Развитие творческих возможностей учащихся через организацию исследовательской работы по химии
Аттестационная работа. Развитие творческих возможностей учащихся через организацию исследовательской работы по химии Презентация Типы изомерий 10 класс
Презентация Типы изомерий 10 класс Кремний
Кремний Хроматографія. Мікрогетерогенні дисперсні системи
Хроматографія. Мікрогетерогенні дисперсні системи Третья группа ПС
Третья группа ПС Презентацию подготовила: Учитель химии высшей категории Отрошко Елена Александровна МОУ СОШ № 6 Ст. Старотитаровской Темрюкс
Презентацию подготовила: Учитель химии высшей категории Отрошко Елена Александровна МОУ СОШ № 6 Ст. Старотитаровской Темрюкс Липиды молока и молочных продуктов. Группы липидов
Липиды молока и молочных продуктов. Группы липидов