Содержание
- 2. Строение атома углерода Охарактеризуйте положение атома углерода в ПСХЭ. Каков состав атома углерода? Каково строение электронной
- 3. Электронное облако Электрон обладает одновременно свойствами и частицы и волны, поэтому можно определить только его верояность
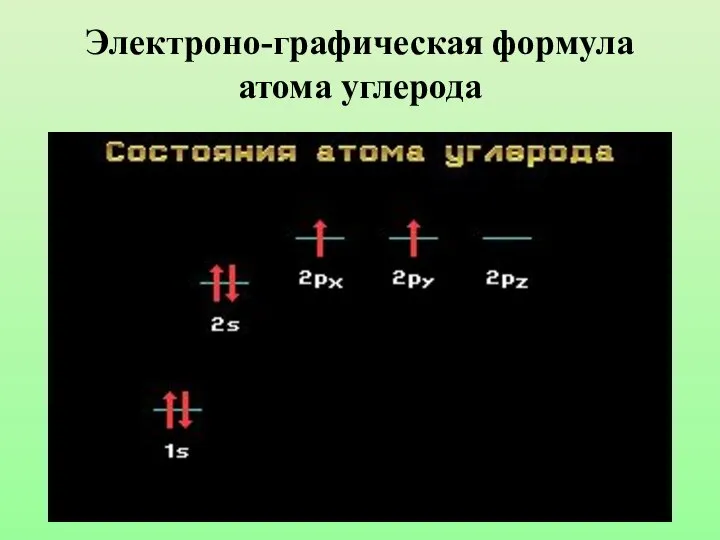
- 4. Составьте электронно-графическую формулу атома углерода. Какие виды атомных орбиталей имеет в своем составе атом углерода?
- 6. Электроно-графическая формула атома углерода
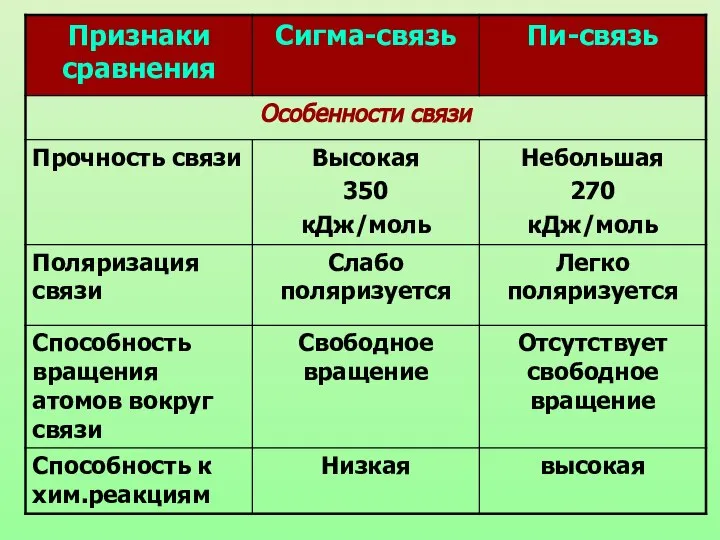
- 7. Валентность элемента чаще всего определяется числом неспаренных электронов в атоме или числом ковалентных связей в молекуле.
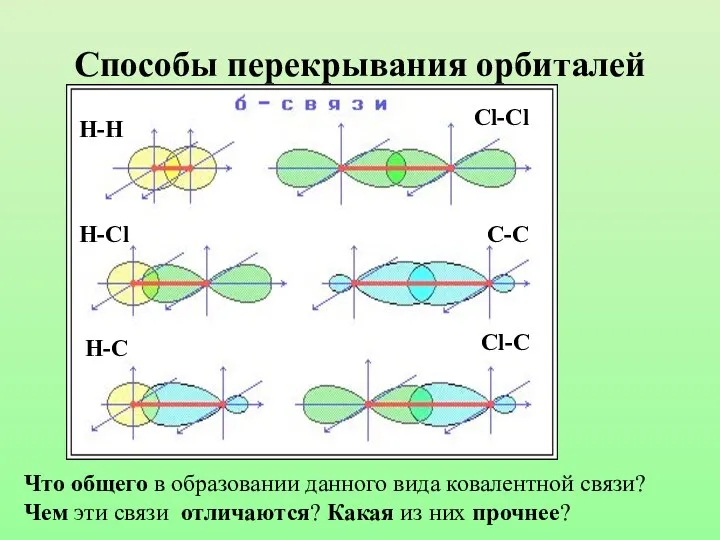
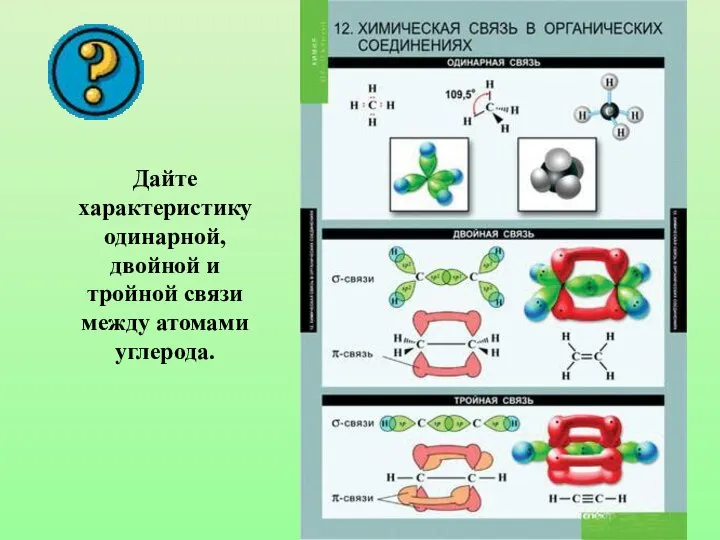
- 8. Способы перекрывания орбиталей Н-Н Cl-Cl H-Cl H-C C-C Cl-C Что общего в образовании данного вида ковалентной
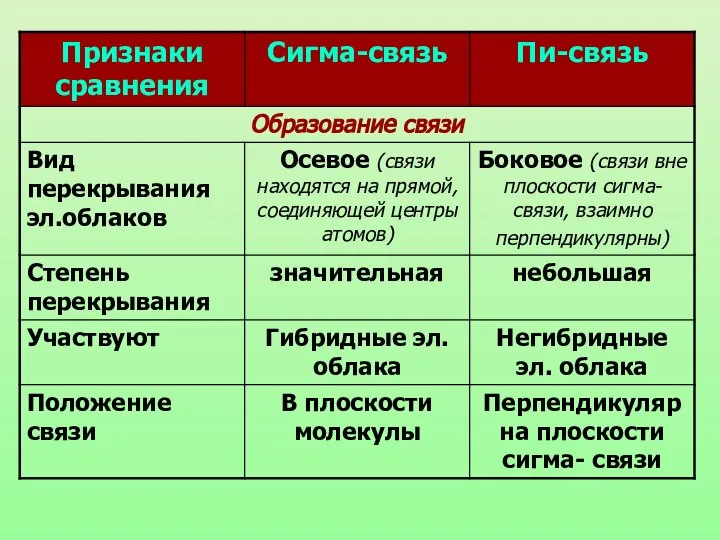
- 9. Химическая связь, образующаяся в результате перекрывания электронных орбиталей вдоль линии связи, называются б-связями (сигма-связями).
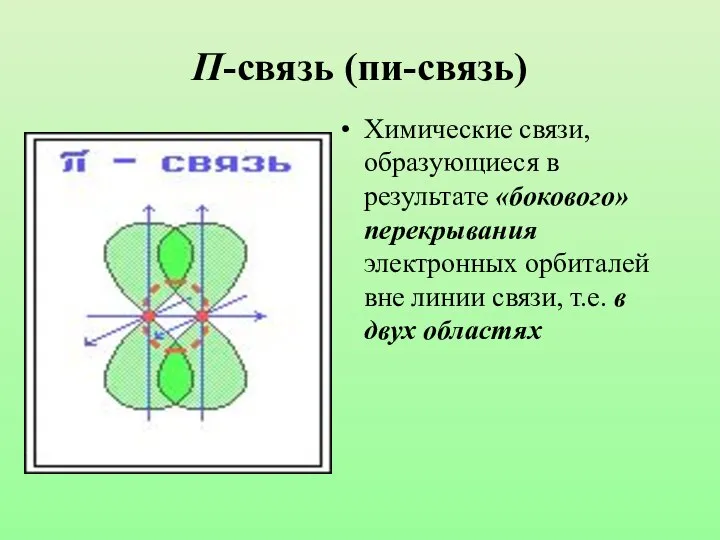
- 10. П-связь (пи-связь) Химические связи, образующиеся в результате «бокового» перекрывания электронных орбиталей вне линии связи, т.е. в
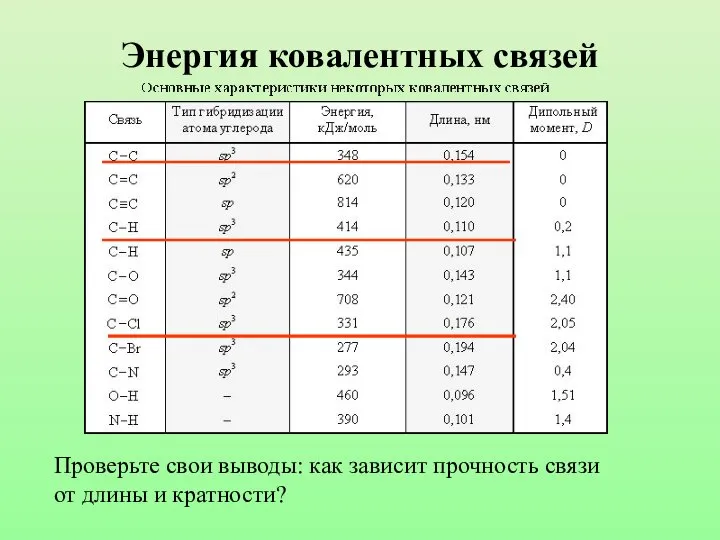
- 13. Энергия ковалентных связей Проверьте свои выводы: как зависит прочность связи от длины и кратности?
- 14. Запомни! Атомы углерода в органических соединениях всегда четырехвалентны. Атомы углерода могут находиться в трех валентных состояниях.
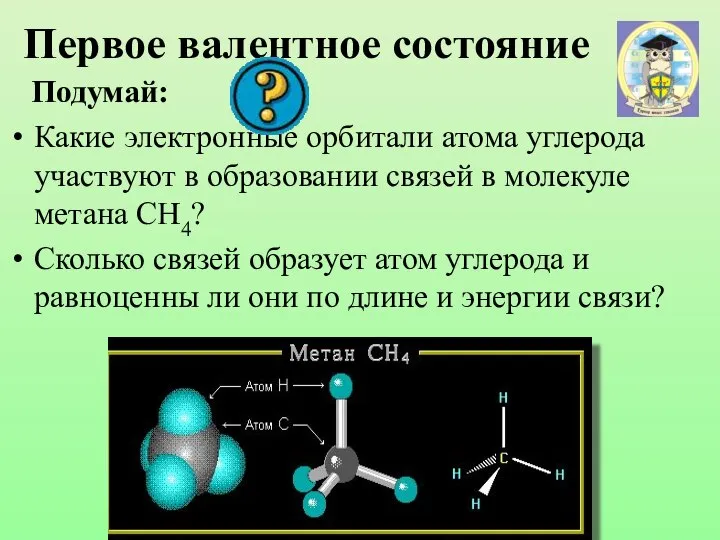
- 15. Первое валентное состояние Подумай: Какие электронные орбитали атома углерода участвуют в образовании связей в молекуле метана
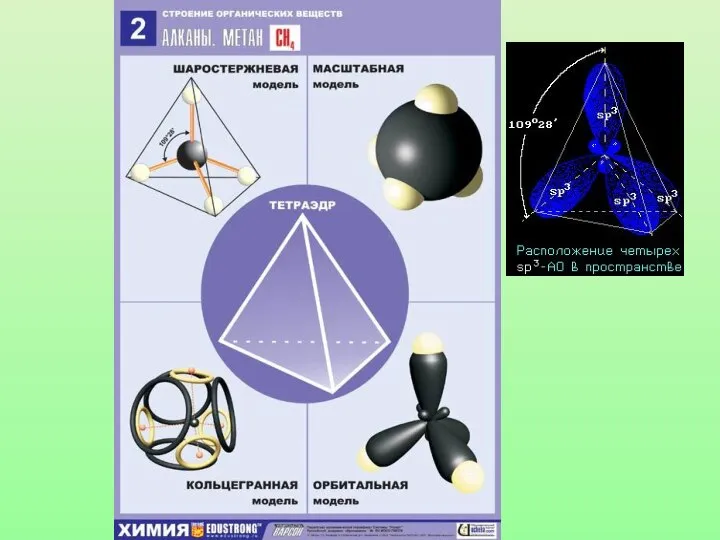
- 16. Модель молекулы метана Электронные орбитали атома углерода в молекуле метана Шаростержневая модель молекулы метана
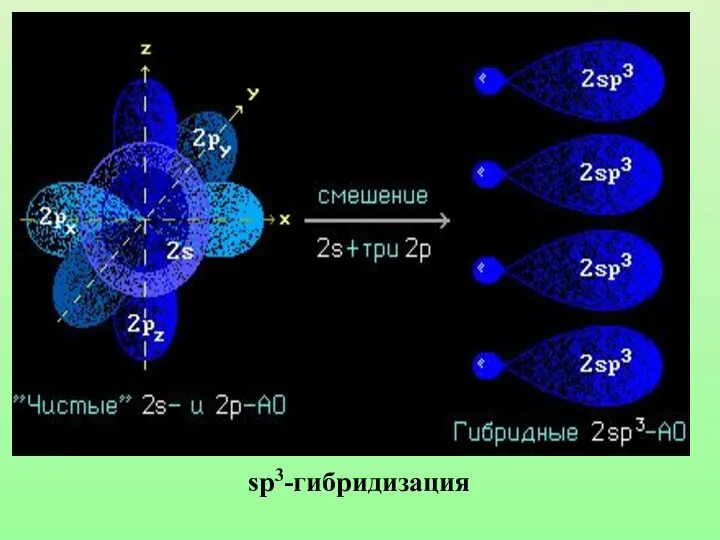
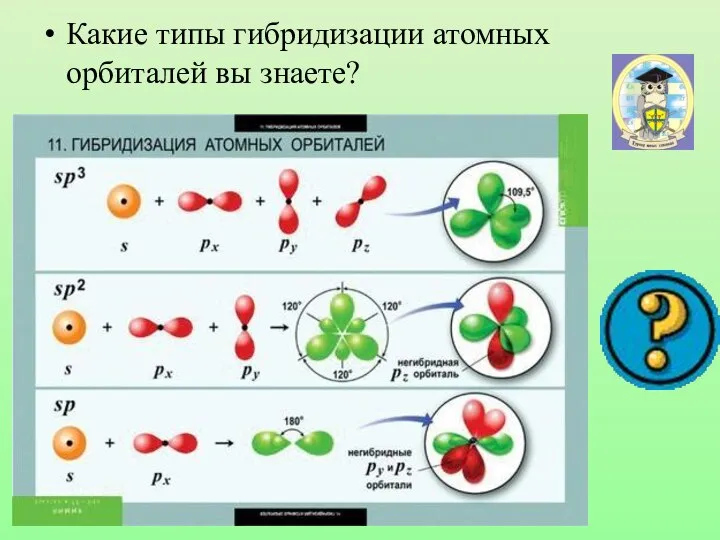
- 17. Гибридизацией орбиталей называется процесс выравнивания их по форме и энергии
- 18. sp3-гибридизация
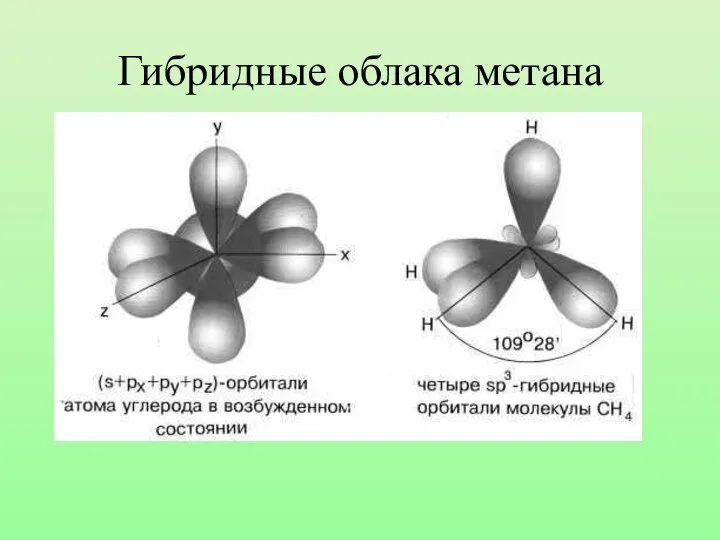
- 19. Гибридные облака метана
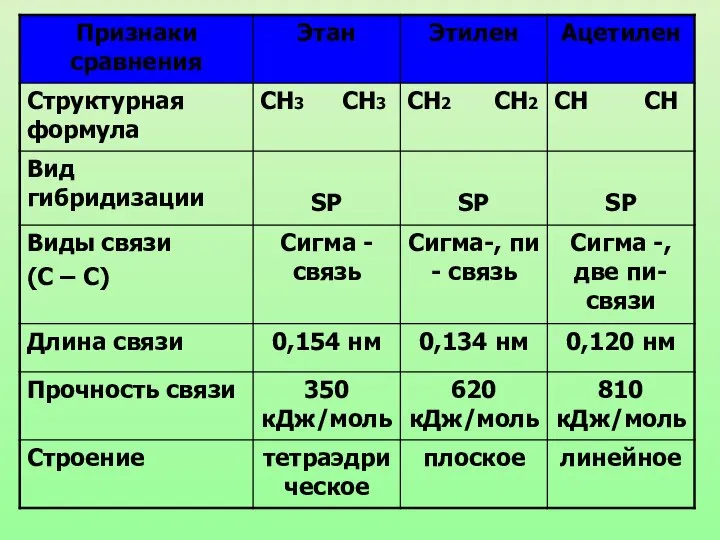
- 21. Запомни! Характеристики sp3-гибридизации: Угол связи 1090 28/ Все связи сигма (б-связи) Все связи одинарные Длина одинарной
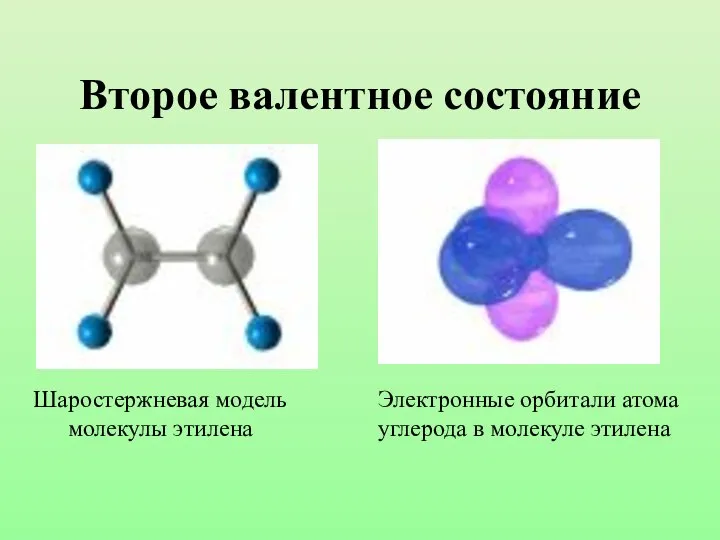
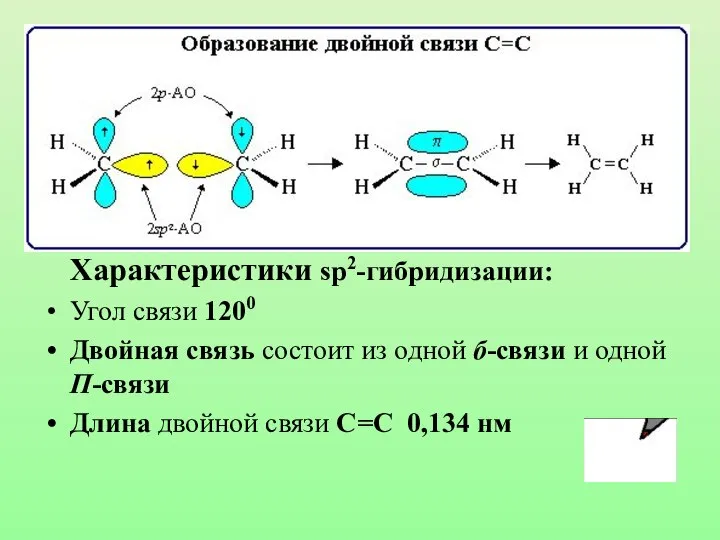
- 22. Второе валентное состояние Шаростержневая модель молекулы этилена Электронные орбитали атома углерода в молекуле этилена
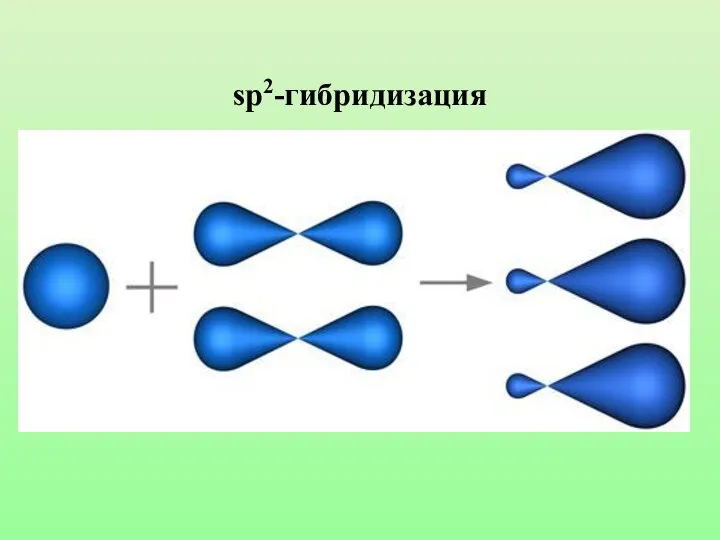
- 23. sp2-гибридизация
- 24. Характеристики sp2-гибридизации: Угол связи 1200 Двойная связь состоит из одной б-связи и одной П-связи Длина двойной
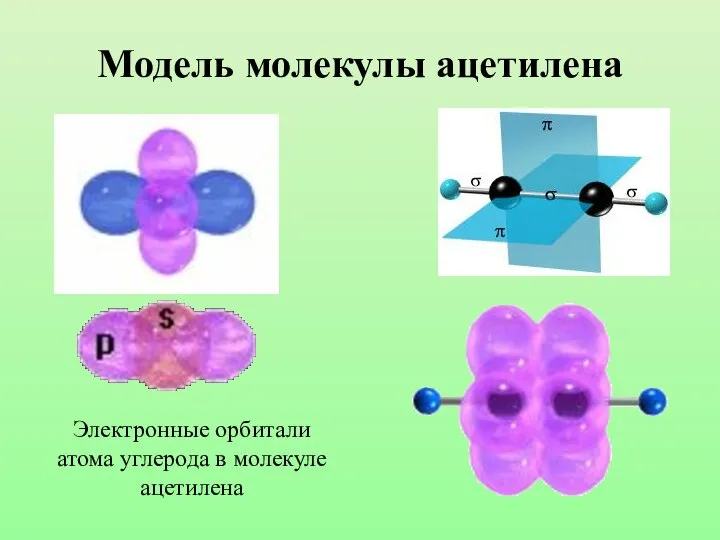
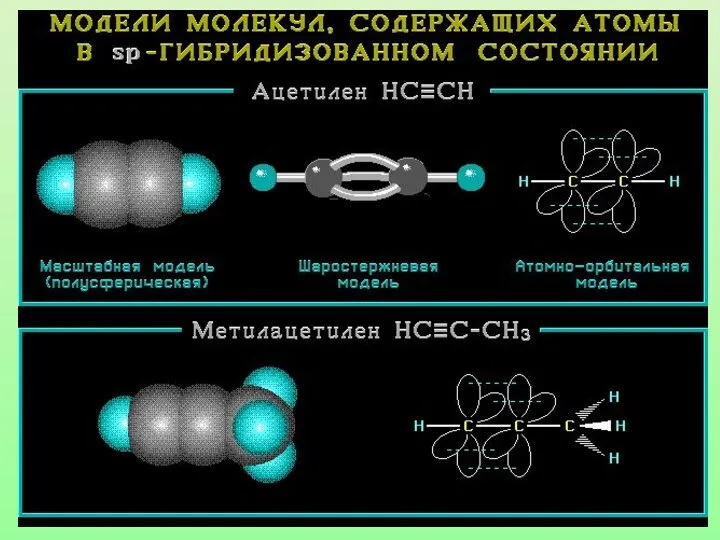
- 26. Модель молекулы ацетилена Электронные орбитали атома углерода в молекуле ацетилена
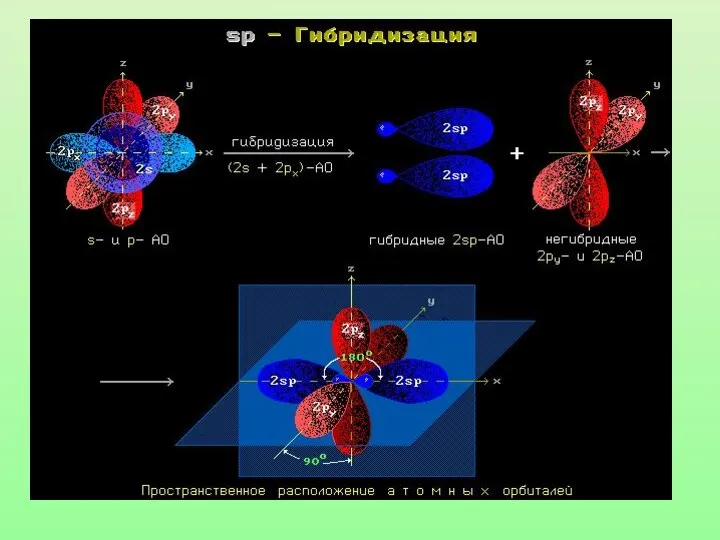
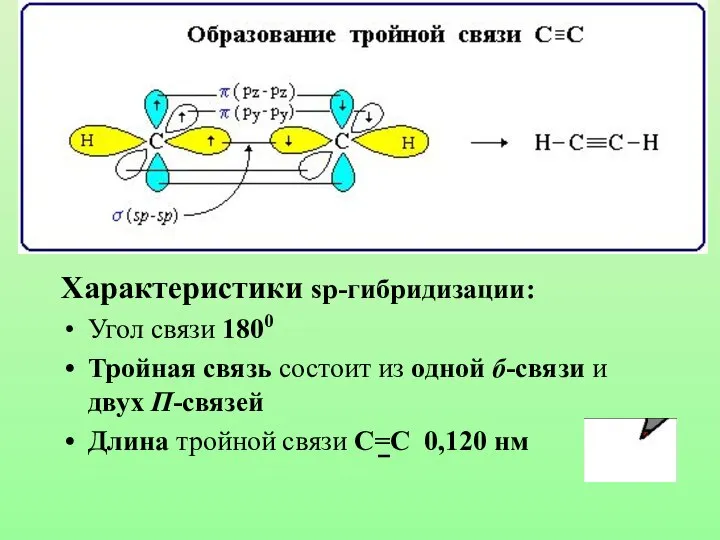
- 27. Характеристики sp-гибридизации: Угол связи 1800 Тройная связь состоит из одной б-связи и двух П-связей Длина тройной
- 30. Какие типы гибридизации атомных орбиталей вы знаете?
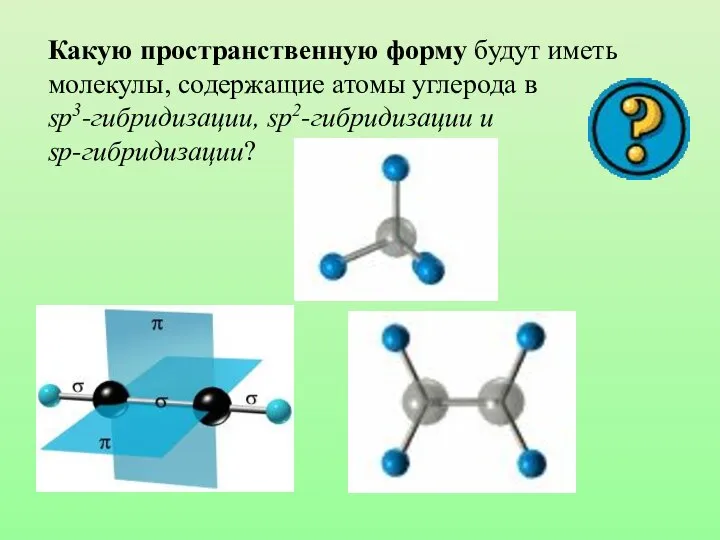
- 31. Какую пространственную форму будут иметь молекулы, содержащие атомы углерода в sp3-гибридизации, sp2-гибридизации и sp-гибридизации?
- 32. Дайте характеристику одинарной, двойной и тройной связи между атомами углерода.
- 33. Домашнее задание Параграф 3, вопросы 1-5 Параграф 4, вопросы 1-4 Выучить характеристики валентных состояний атома углерода
- 35. Сигма связи
- 37. Скачать презентацию












 Фенилхромановые соединения. Флавоноиды
Фенилхромановые соединения. Флавоноиды Соединения галогенов
Соединения галогенов Реакции замещения
Реакции замещения Презентация по Химии "Презентация Ионы и ионная химическая связь" - скачать смотреть
Презентация по Химии "Презентация Ионы и ионная химическая связь" - скачать смотреть  Фенолфармальдегидные смолы
Фенолфармальдегидные смолы Использование газовой хроматографии в скрининг-анализе летучих ядов
Использование газовой хроматографии в скрининг-анализе летучих ядов Основные свойства адсорбентов. Определение их параметров
Основные свойства адсорбентов. Определение их параметров Щелочно-земельные металлы
Щелочно-земельные металлы Биохимия почек и мочи. (Лекция 10)
Биохимия почек и мочи. (Лекция 10) Термодинамика. Химическое равновесие. Кинетика
Термодинамика. Химическое равновесие. Кинетика Амины
Амины Аминокислоты Модели молекул
Аминокислоты Модели молекул  О проекте концепции преподавания химии в РФ
О проекте концепции преподавания химии в РФ Витамины гетероциклического строения. (Тема 2)
Витамины гетероциклического строения. (Тема 2) Природні джерела вуглеводнів
Природні джерела вуглеводнів Растворы электролитов
Растворы электролитов Окислительно-восстановительные реакции. Классификация ОВР
Окислительно-восстановительные реакции. Классификация ОВР Презентация по Химии "Белки" - скачать смотреть бесплатно_
Презентация по Химии "Белки" - скачать смотреть бесплатно_ Химия элементов семейства Fe Co Ni
Химия элементов семейства Fe Co Ni Кристаллические и аморфные тела
Кристаллические и аморфные тела Решение задач. Способы выражения состава раствора
Решение задач. Способы выражения состава раствора Органическая химия. Подготовка к контрольной работе № 2
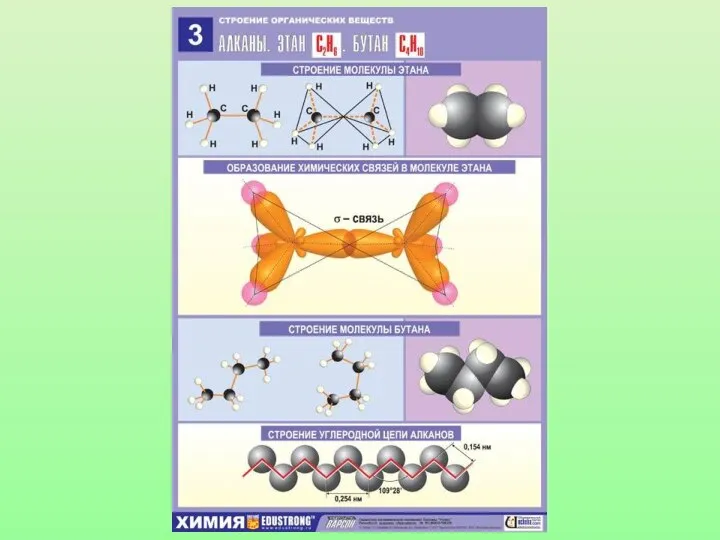
Органическая химия. Подготовка к контрольной работе № 2 Алканы: состав, строение, изомерия, номенклатура, получение. МОУ «СОШ» пгт.Кожва Республика Коми, Печорский район Савчук Оксана В
Алканы: состав, строение, изомерия, номенклатура, получение. МОУ «СОШ» пгт.Кожва Республика Коми, Печорский район Савчук Оксана В МОУ СОШ №5 ст. Бриньковской Понятие об ЭДС Электролиты и неэлектролиты электролитическая диссоциация Учитель химии Беба Е.А.
МОУ СОШ №5 ст. Бриньковской Понятие об ЭДС Электролиты и неэлектролиты электролитическая диссоциация Учитель химии Беба Е.А. Карбонильные соединения (оксосоединения)
Карбонильные соединения (оксосоединения) Кристаллы необычной красоты
Кристаллы необычной красоты Взаимодействие атомов элементов-неметаллов между собой. Ковалентная неполярная химическая связь. (Тема 11)
Взаимодействие атомов элементов-неметаллов между собой. Ковалентная неполярная химическая связь. (Тема 11) Натрий. Роль натрия в организме
Натрий. Роль натрия в организме