Содержание
- 2. Лайфхак В каждой задаче подчеркивайте себе ключевые моменты (с чем реагировало вещество, какую порцию отобрали, какая
- 3. #стольник №34. Какую массу оксида серы (VI) следует добавить к 400 г 15 %-ного раствора серной
- 4. Написать все реакции, о которых идёт речь в задаче (после каждой реакции оставить немного места, чтобы
- 5. Шаг 2 Посчитать кол-во вещества тех веществ, у которых даны масса/объём и тд m1 (H2SO4)= =m1
- 6. 3. Внимательно посмотреть и подумать !!Замечание: если вводите неизвестные (х,y и тд), обязательно пишите что есть
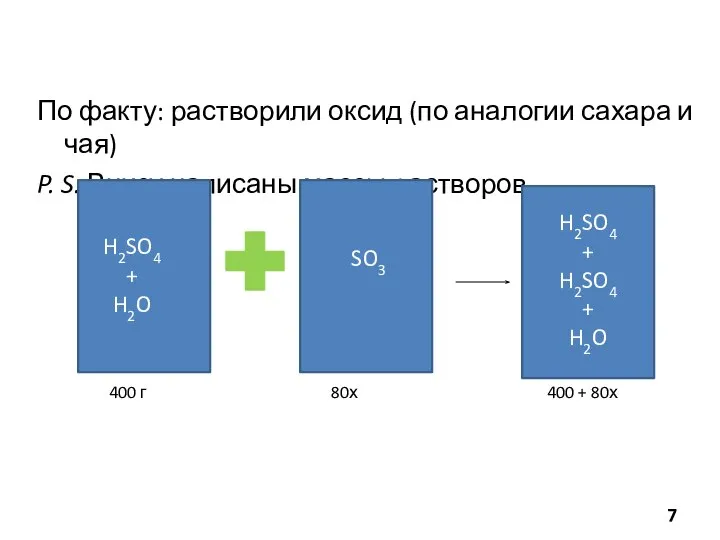
- 7. По факту: растворили оксид (по аналогии сахара и чая) P. S. Внизу написаны массы растворов SO3
- 8. 4. Составить уравнение w2 (H2SO4)= m2 (H2SO4)/m2 (p-pa H2SO4) = = 0,25 х=20/39=0,513= n (SO3) m
- 9. #стольник №35. При сгорании 4,68 г органического вещества получили 4,48 л углекислого газа (н. у.), 448
- 10. Алгоритм (обобщённый) 0. Перевести в СИ (г, л{газы} и тд) !!! Помним, что 1 л=1000 мл
- 11. t 0 2. Написать реакцию горения СхНуОzNt+aO₂ xCO₂+(y/2) H2O+(t/2)N₂
- 12. 3. Посчитать кол-ва веществ n(CO₂)=V(CO₂)/Vm=4,48 л/22,4 (л/моль)=0,2 моль = n(C в A) m(C)= n(C)*М(С)=0,2 моль*12 (г/моль)=2,4
- 13. ОБЯЗАТЕЛЬНАЯ ПРОВЕРКА m(O)=m(СхНуОzNt) - m(N) - m(C) - m(H)= 4,68 г - 0,44 г - 0,56
- 14. 4. Найти брутто-формулу В веществе СхНуОzNt : x:y:z:t= n(C): n(H): n(O): n(N)=0,2:0,44:0,08:0,04=5:11:2:1, то есть С5Н11О2N Один
- 15. 5. Нарисовать структурную формулу «При нагревании с соляной кислотой данное вещество подвергается гидролизу….» Гидролизуются только сложные
- 16. #массовая Задание 4. Электролиз 372,5 г 12%-го раствора KCl прекратили, когда на катоде выделилось 4,48 л
- 17. Алгоритм Шаг 1. Написать все уравнения реакций (катодно-анодные процессы обязательно расписывать!) К(-): 2Н2О +2е=2ОН(1-)+Н2 А(+): 2Сl(1-)-2e=Cl2
- 18. Шаг 2. Посчитать кол-ва веществ n(H2)= V(Н2)/ Vm= 4,48 л /22,4 (л/моль)=0,2 моль => По уравнению
- 19. #долюшка Задание 5. Для полного растворения смеси железа и оксида железа (II) потребовалось 511 г 5
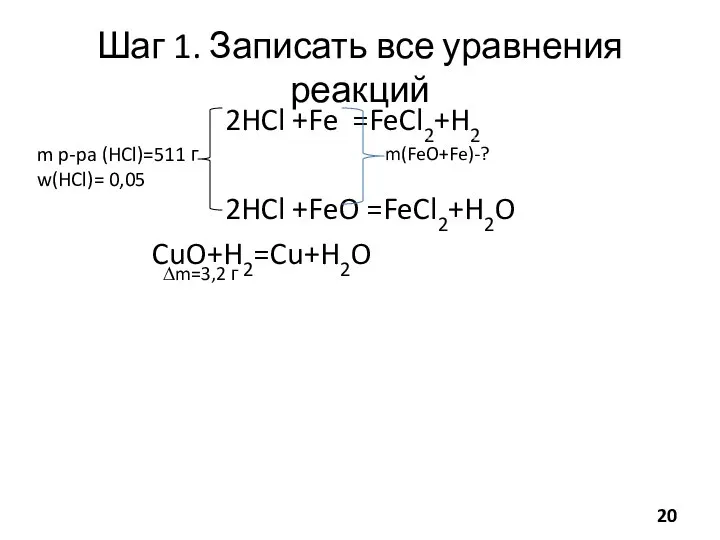
- 20. Шаг 1. Записать все уравнения реакций 2HCl +Fe =FeCl2+H2 2HCl +FeO =FeCl2+H2O CuO+H2=Cu+H2O m p-pa (HCl)=511
- 21. Шаг 2. Считать кол-ва веществ nобщ (HCl)=mобщ (HCI)/M(HCl) mобщ (HCl)= mобщ р-ра (HCI)*w(HCl)= =511г*0,05=25,55 г nобщ
- 22. CuO+H2=Cu+H2O Закон сохранения массы: m(CuO)+m(H2)=m(Cu)+m(H2O) H2 и H2O - ГАЗЫ, CuO и Cu - тв., то
- 23. Шаг 3. Внимательно посмотреть и подумать n(CuO)=n(H2)= 0,2 моль Водород был из реакции: 2HCl +Fe=FeCl2+H2 По
- 24. 2HCl +FeO=FeCl2+H2O По уравнению реакции: n(FeO)= n c FeО (HCl)/2= 0,15 моль m(FeO)= 0,15 моль*72 (г/моль)=10,8
- 25. #долюшка Задание 5. Электролиз 320 г 17%-го раствора хлорида цинка прекратили, когда на аноде выделилось 4,48
- 26. Напишем реакции: Цинк- металл средней активности, поэтому будет восстанавливаться металл и вода на катоде: К(-): 2Н2О
- 27. Немного подумаем… n(Cl₂)=V(Cl₂)/Vm=4,48 л/22,4 (л/моль)=0,2 моль По уравнению реакции: nпрор. (ZnCl2)= n(Cl₂)= 0,2 моль По условию:
- 28. mр-ра (после эл-за)=m р-ра(ZnСl2)-m(Н2)-m(Cl2)-m(Zn(ОН)2)-m(Zn) По уравнению реакции: n (Zn)= n(Zn(ОН)2)= n(Н2)= n(Cl₂)/2= 0,1 моль m(Zn)=65 (г/моль)
- 30. Скачать презентацию

























 Исследовательская работа Химические средства в быту
Исследовательская работа Химические средства в быту Серосодержащие макрогетероциклы (тиакраун-соединения)
Серосодержащие макрогетероциклы (тиакраун-соединения) Углерод
Углерод ПРЕЗЕНТАЦИЯ ПО ХИМИИ НА ТЕМУ:”Химия вокруг нас “ Выполнила ученица 9 класса « Г» Ларченко Дарья
ПРЕЗЕНТАЦИЯ ПО ХИМИИ НА ТЕМУ:”Химия вокруг нас “ Выполнила ученица 9 класса « Г» Ларченко Дарья Биологически активные гетероциклические соединения. Нуклеиновые кислоты
Биологически активные гетероциклические соединения. Нуклеиновые кислоты Кислоты
Кислоты Лиофильные и лиофобные дисперсные системы
Лиофильные и лиофобные дисперсные системы Алюміній: будова атома, поширення в природі. Фізичні і хімічні властивості алюмінію. Застосування алюмінію Підготував
Алюміній: будова атома, поширення в природі. Фізичні і хімічні властивості алюмінію. Застосування алюмінію Підготував  Познавательная игра. Химия!
Познавательная игра. Химия! Атомна одиниця маси. Відносна атомна маса хімічних елементів.
Атомна одиниця маси. Відносна атомна маса хімічних елементів.  Виробництво цукру Підготував: Учень 9 класу Лаврук Ігор
Виробництво цукру Підготував: Учень 9 класу Лаврук Ігор  Сложные эфиры
Сложные эфиры Особенности строения твердых тел
Особенности строения твердых тел Системы эвтектического типа
Системы эвтектического типа Предельные углеводороды. Насыщенные алифатические углеводороды. Алканы или Парафины
Предельные углеводороды. Насыщенные алифатические углеводороды. Алканы или Парафины Кремний
Кремний Каменный уголь Работа: Заривной Виктории 11 – Л класс
Каменный уголь Работа: Заривной Виктории 11 – Л класс  Проверка знаний по теме «Химическая организация клетки. Неорганические вещества»
Проверка знаний по теме «Химическая организация клетки. Неорганические вещества» Кислоты
Кислоты Студент − это не сосуд, который надо наполнить, а факел, который надо зажечь Л. Арцимович
Студент − это не сосуд, который надо наполнить, а факел, который надо зажечь Л. Арцимович  Великие химики России
Великие химики России Методы экстрагирования ЛРС и оборудование
Методы экстрагирования ЛРС и оборудование Карбоновые кислоты
Карбоновые кислоты Уреидтер және оның маңызы
Уреидтер және оның маңызы Чистые вещества и смеси. Способы разделения смесей. Загадка
Чистые вещества и смеси. Способы разделения смесей. Загадка Презентация Фенолы
Презентация Фенолы Презентация по Химии "d — элементы" - скачать смотреть
Презентация по Химии "d — элементы" - скачать смотреть  Работа студентки II курса Козловой Екатерины
Работа студентки II курса Козловой Екатерины