Содержание
- 2. Хим. активность металлов определяется их восстановительной способностью: М(к) Мn+(р) Т.е. способностью терять е- и переходить из
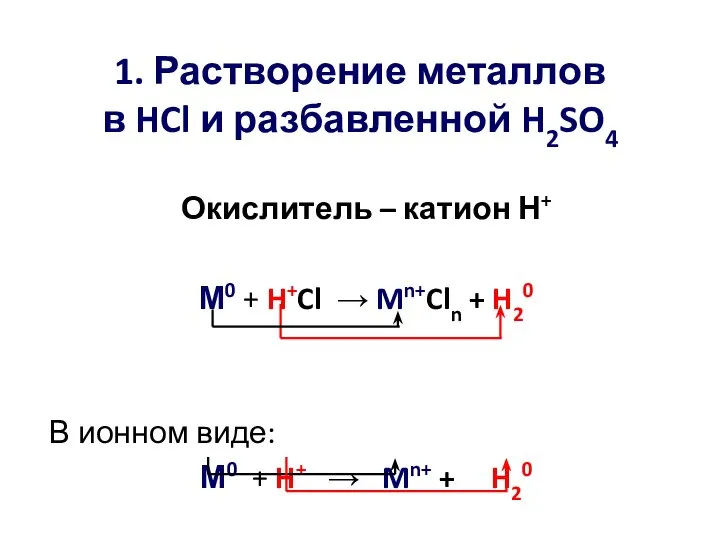
- 3. 1. Растворение металлов в HCl и разбавленной H2SO4 Окислитель – катион Н+ М0 + H+Cl →
- 4. Mn+Cln – условная запись аквакомплекса [M(OH2)6]n+Cln
- 5. Обоснование: 1 Cu2+ + 2e- = Cu ϕ0 = 0,34 B 1 2H+ + 2e- =
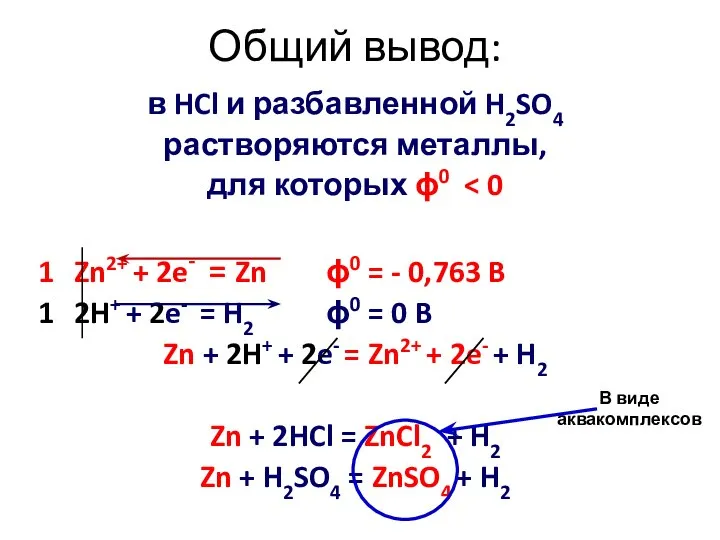
- 6. Общий вывод: в HCl и разбавленной H2SO4 растворяются металлы, для которых ϕ0 1 Zn2+ + 2e-
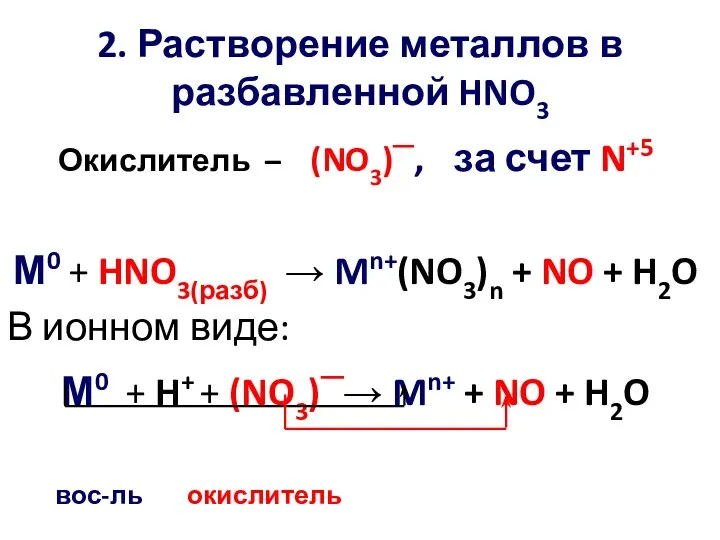
- 7. 2. Растворение металлов в разбавленной HNO3 Окислитель – (NO3)─, за счет N+5 М0 + HNO3(разб) →
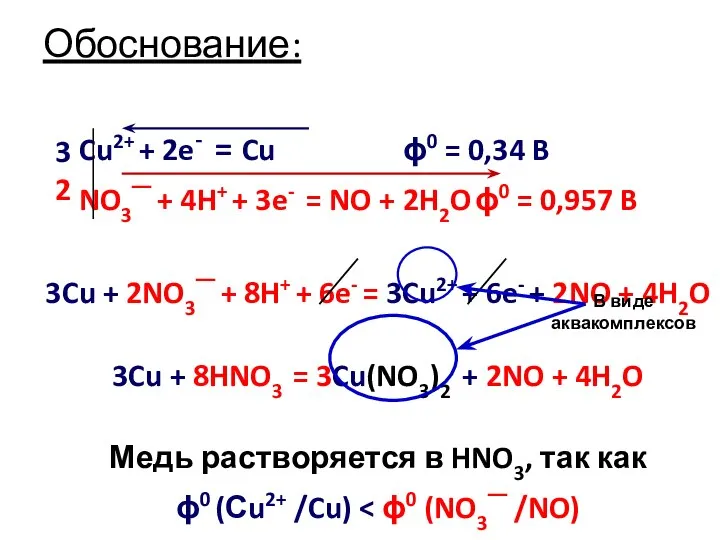
- 8. Обоснование: Cu2+ + 2e- = Cu ϕ0 = 0,34 B NO3─ + 4H+ + 3e- =
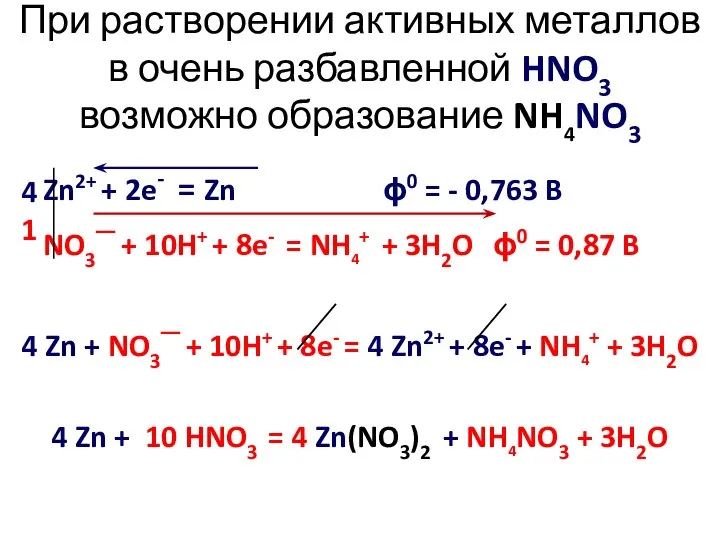
- 9. При растворении активных металлов в очень разбавленной HNO3 возможно образование NH4NO3 Zn2+ + 2e- = Zn
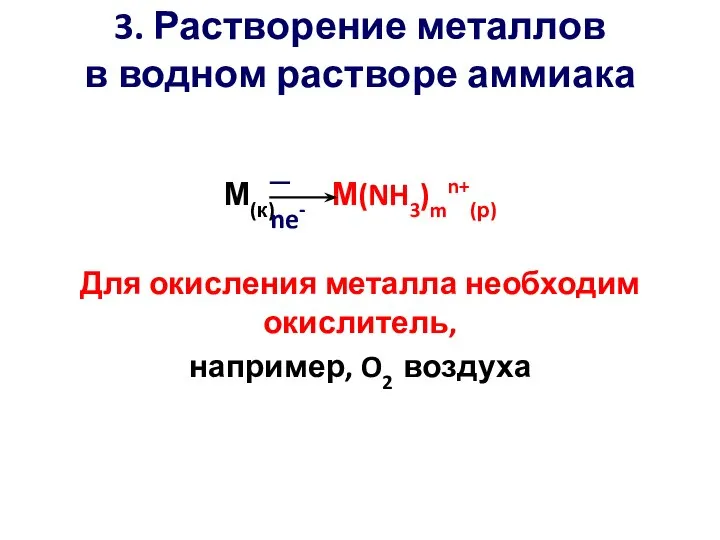
- 10. 3. Растворение металлов в водном растворе аммиака М(к) М(NH3)mn+(р) Для окисления металла необходим окислитель, например, O2
- 11. Cu(NH3)42+ + 2e- = Cu + 4 NH3 ϕ0 = -0,07 B O2 + 2H2O +
- 12. Cравнение растворимости в растворе NH3 Сu и Ag Cu(NH3)42+ + 2e- = Cu + 4 NH3
- 13. 4. Растворение металлов в растворах, содержащих цианид-ионы М(к) М(CN)mn─(р) ─ ne- Для окисления металла необходим окислитель
- 14. Au(CN)2─ + e- = Au + 2 CN─ ϕ0 = -0,43 B O2 + 2H2O +
- 15. 4 Au + 8 KCN + O2 + 2H2O = 4 K[Au(CN)2] + 4 KОH Cпособ
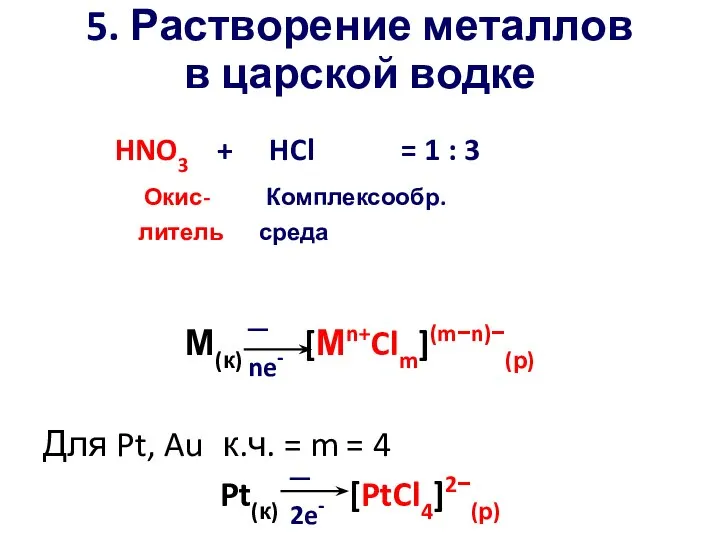
- 16. 5. Растворение металлов в царской водке HNO3 + HCl = 1 : 3 Окис- Комплексообр. литель
- 17. Pt(к) [PtCl4]2-(р) PtCl42- + 2e- = Pt + 4 Cl─ ϕ0 = 0,73 B NO3─ +
- 18. Выводы I. При составлении уравнений растворения металлов в различных средах нужно: Определить вещество-окислитель и вещество-комплексообразователь Составить
- 19. Выводы II. d-металлы элементов IV периода (кроме Cu) растворяются в HCl и разбавленной H2SO4 с образованием
- 20. III. d-металлы элементов V и VI периодов в HCl и разбавленной H2SO4, обычно не растворяются. Они
- 22. Скачать презентацию

![Mn+Cln – условная запись аквакомплекса [M(OH2)6]n+Cln](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/719582/slide-3.jpg)






![Pt(к) [PtCl4]2-(р) PtCl42- + 2e- = Pt + 4 Cl─ ϕ0](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/719582/slide-16.jpg)



 Ди- және полисахаридтер
Ди- және полисахаридтер Элементы химической кинетики
Элементы химической кинетики Круговорот азота в природе
Круговорот азота в природе Биогеохимические функции и принципы живого вещества
Биогеохимические функции и принципы живого вещества Гетероциклические соединения
Гетероциклические соединения Фотолабораторный процесс. Основные этапы фото обработки. Рентгеновского изображения
Фотолабораторный процесс. Основные этапы фото обработки. Рентгеновского изображения Презентация по Химии "Презентация по химии Галогены" - скачать смотреть
Презентация по Химии "Презентация по химии Галогены" - скачать смотреть  Химические свойства насыщенных углеводородов
Химические свойства насыщенных углеводородов Валентность связи и локальный баланс валентности
Валентность связи и локальный баланс валентности Химиялық элементтердің тірі және өлі табиғатта таралуы
Химиялық элементтердің тірі және өлі табиғатта таралуы Процессы коксования
Процессы коксования Алканы
Алканы Основные химические понятия
Основные химические понятия Спирты, они же – алкоголи. В средние века люди считали этиловый спирт одним из сильнейших лекарственных средств и поэтому назвали
Спирты, они же – алкоголи. В средние века люди считали этиловый спирт одним из сильнейших лекарственных средств и поэтому назвали  Стекло. История стекла. Свойства стекла
Стекло. История стекла. Свойства стекла Термодинамические функции газовых смесей. Идеальные растворы. Закон Рауля
Термодинамические функции газовых смесей. Идеальные растворы. Закон Рауля Гетероциклы. Гетероциклические соединения
Гетероциклы. Гетероциклические соединения Презентация КРИСТАЛЛЫ
Презентация КРИСТАЛЛЫ  Аттестационная работа. Образовательная программа элективного курса по химии
Аттестационная работа. Образовательная программа элективного курса по химии Коллоидная химия
Коллоидная химия Полисахаридтер – жоғары молекулалық көмірсулар
Полисахаридтер – жоғары молекулалық көмірсулар Мінеральні добрива
Мінеральні добрива  Материаловедение. Теория сплавов
Материаловедение. Теория сплавов Презентация по химии Органические вещества
Презентация по химии Органические вещества  Этанол. Одноатомный спирт
Этанол. Одноатомный спирт Актуальні питання і перспективи створення вікових ліків в Україні
Актуальні питання і перспективи створення вікових ліків в Україні Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Procesul zaharului
Procesul zaharului