Содержание
- 2. История открытия Антуан Лавуазье (1743-1794) французский химик, один из создателей современной химии В 1783-1784 совместно с
- 3. Л. Гитон де Морво (1737—1816) барон, французский химик. В 1787г. дал современное название водороду. Он предложил
- 4. Тема урока «Водород, нахождение в природе. Получение водорода и его физические свойства».
- 5. План урока Общая характеристика водорода Нахождение водорода в природе Получение водорода Физические свойства водорода
- 6. Задание: I общая характеристика водорода. II нахождение водорода в природе.
- 7. Общая характеристика водорода 1. Химический знак - 2. Порядковый номер – 3. Относительная атомная масса Ar
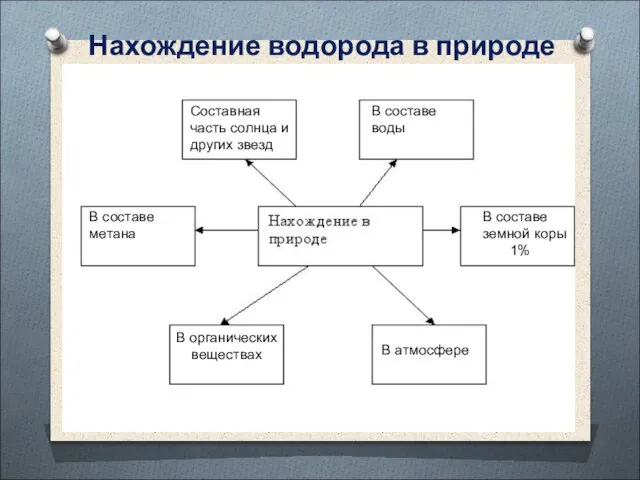
- 8. Нахождение водорода в природе Составная часть солнца и других звезд В составе воды В составе земной
- 9. Получение водорода Если бы перед вами стояла задача: получить большое количество водорода, - какое сырье вы
- 10. Получение в промышленности Электролиз воды 2H2O = 2H2↑ + O2↑ Конверсия метана t CH4 + 2H2O
- 11. Получение в лаборатории 1) взаимодействие металлов с кислотами Zn + 2HCl = ZnCl2 + H2↑ Zn
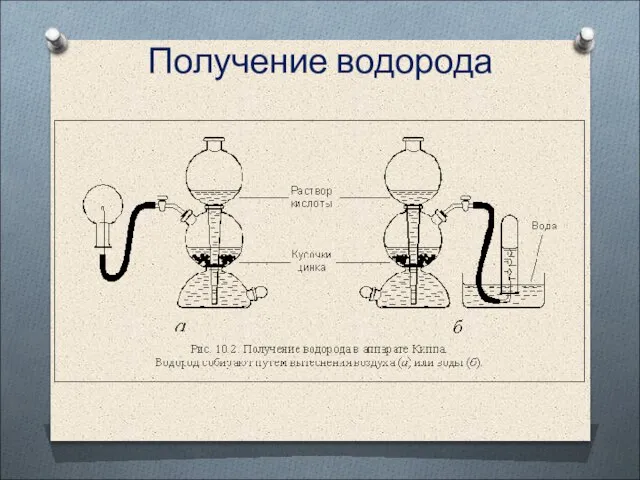
- 12. Получение водорода
- 13. Аппарат Киппа
- 14. Назовите металл и кислоту, которые использовались для получения водорода? Как можно собрать водород? Определите отличие: горящая
- 15. Физические свойства Простое вещество водород – это газ, легче воздуха, без цвета, без запаха, без вкуса,
- 16. Сравнение Кислород Водород
- 17. Способы собирания
- 18. Способы собирания
- 19. Способы собирания
- 20. Физические свойства
- 21. Физические свойства
- 22. Физические свойства
- 23. Способы распознавания
- 24. Способы распознавания
- 25. Способы распознавания
- 26. Задание 1. Мыльные пузыри, наполненные водородом, поднимаются вверх. Объясните это явление.
- 27. Задание 2. Подберите коэффициенты в уравнениях реакций получения водорода: а) Mg + HCl → MgCl2 +
- 28. Задание 3. Вставьте пропущенные формулы в уравнениях реакций: а) … + 2HCl → FeCl2 + …↑
- 29. Задание 4. Выберите реакции, в результате которых образуется водород: а) Al + H2SO4 → б) Na
- 30. Задание 5. Рассчитайте, какую массу водорода можно получить при растворении 13 г цинка в соляной кислоте.
- 31. Домашнее задание §25 , §26. Ответить на вопросы № 2, 3, 5.
- 32. Подумайте и закончите предложения: – Сегодня на уроке я узнал… – На уроке я понял… –
- 34. Скачать презентацию




























 Гипергенез и почвообразование
Гипергенез и почвообразование Трансформация соединений азота
Трансформация соединений азота Харчові добавки Виконала: Учениця 10-Б класу Єфіменко Злата
Харчові добавки Виконала: Учениця 10-Б класу Єфіменко Злата  Коррозия металлов
Коррозия металлов Анализ качества лекарственных средств, производных алифатических и ароматических аминов
Анализ качества лекарственных средств, производных алифатических и ароматических аминов Курсовая работа: синтез n - бензил – n – этилэтанамина (диэтилбензиламина)
Курсовая работа: синтез n - бензил – n – этилэтанамина (диэтилбензиламина) Предельные одноатомные спирты. 10 класс
Предельные одноатомные спирты. 10 класс Исследование химических моделей (11 класс)
Исследование химических моделей (11 класс) Фенолы. Классификация фенолов
Фенолы. Классификация фенолов Разработка и исследование новых высокоэффективных адсорбентов-осушителей на основе оксида алюминия
Разработка и исследование новых высокоэффективных адсорбентов-осушителей на основе оксида алюминия Гидроксид калия KOH
Гидроксид калия KOH Палладий. История открытия химических веществ
Палладий. История открытия химических веществ Химическая термодинамика. Основные понятия
Химическая термодинамика. Основные понятия Презентация по Химии "Полімери" - скачать смотреть бесплатно
Презентация по Химии "Полімери" - скачать смотреть бесплатно Бетаин (триметилглицин)
Бетаин (триметилглицин) Использование ядерных излучений для получения химической информации. (Лекция 10)
Использование ядерных излучений для получения химической информации. (Лекция 10) Характеристика щелочных металлов 9 класс
Характеристика щелочных металлов 9 класс  Силикатная промышленность
Силикатная промышленность Взаимодействие перфторбензоциклобутена и его перфторалкил- и пентафторфенилпроизводных с CO в среде SbF5
Взаимодействие перфторбензоциклобутена и его перфторалкил- и пентафторфенилпроизводных с CO в среде SbF5 Химия – правая рука физики, а математика - ее глаза
Химия – правая рука физики, а математика - ее глаза Системы эвтектического типа
Системы эвтектического типа Природный каучук
Природный каучук Введение в токсикологическую химию. Объекты химико-токсикологического исследования
Введение в токсикологическую химию. Объекты химико-токсикологического исследования Презентация по Химии "Цветная металлургия" - скачать смотреть
Презентация по Химии "Цветная металлургия" - скачать смотреть  Химические реакторы
Химические реакторы Презентация по Химии "исследование состава и свойств минеральной воды" - скачать смотреть
Презентация по Химии "исследование состава и свойств минеральной воды" - скачать смотреть  Производные изоникотиновой кислоты: изониазид
Производные изоникотиновой кислоты: изониазид Презентація з хімії на тему:”Спирт.Загальні відомості про спирт” підготували: учениці 11-А класу Харківської ЗОШ І-ІІІ ступенів №102 Антіпова Марія і Уськіна Ольга
Презентація з хімії на тему:”Спирт.Загальні відомості про спирт” підготували: учениці 11-А класу Харківської ЗОШ І-ІІІ ступенів №102 Антіпова Марія і Уськіна Ольга