Содержание
- 3. Ионная химическая связь
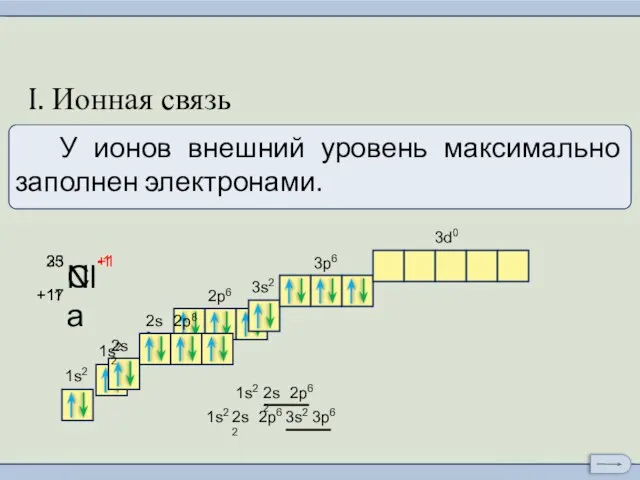
- 4. Ионы и ионная химическая связь. I. Ионная связь
- 5. Ионы и ионная химическая связь. I. Ионная связь 1ē
- 6. Ионы и ионная химическая связь. I. Ионная связь
- 7. Ионы и ионная химическая связь. I. Ионная связь
- 8. Ионы и ионная химическая связь. I. Ионная связь Схема образования молекулы NaCl
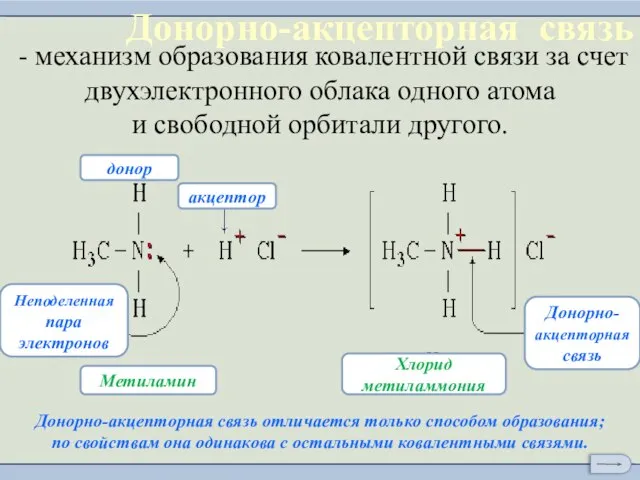
- 9. Донорно-акцепторная связь
- 10. - механизм образования ковалентной связи за счет двухэлектронного облака одного атома и свободной орбитали другого. Донорно-акцeпторная
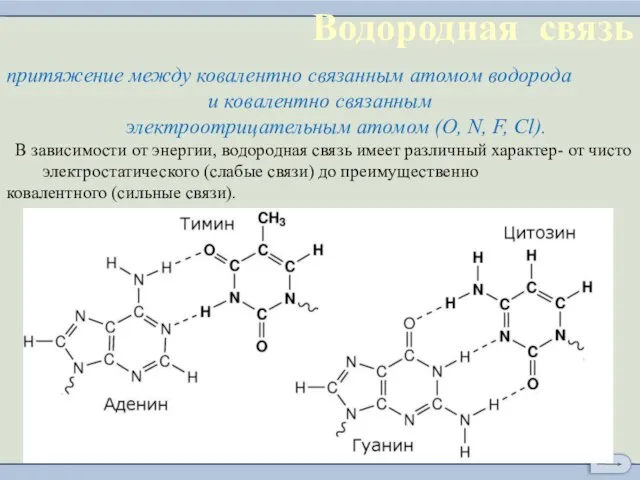
- 11. Водородная связь
- 12. притяжение между ковалентно связанным атомом водорода и ковалентно связанным электроотрицательным атомом (O, N, F, Cl). В
- 14. Скачать презентацию








 Отримання нанопорошків. Класифікація. Фізичні методи отримання нанопорошків. . Хімічні методи отримання наноматеріалів
Отримання нанопорошків. Класифікація. Фізичні методи отримання нанопорошків. . Хімічні методи отримання наноматеріалів Современные методы фармацевтического анализа
Современные методы фармацевтического анализа Коррозия железа и его сплавов в различных средах
Коррозия железа и его сплавов в различных средах Вода и ее свойства
Вода и ее свойства Тотығу-тотықсыздану реакциялары
Тотығу-тотықсыздану реакциялары Строение и свойства неорганических веществ. Кислоты и основания
Строение и свойства неорганических веществ. Кислоты и основания Презентация по Химии "Металлы Общие свойства и получение" - скачать смотреть
Презентация по Химии "Металлы Общие свойства и получение" - скачать смотреть  Современные химические технологии
Современные химические технологии Термодинамикалық тепе-теңдіктің заңдары
Термодинамикалық тепе-теңдіктің заңдары Взаимодействие атомов элементов-неметаллов между собой. Ковалентная неполярная химическая связь. (Тема 11)
Взаимодействие атомов элементов-неметаллов между собой. Ковалентная неполярная химическая связь. (Тема 11) Бытовая химия в нашей жизни
Бытовая химия в нашей жизни Физические свойства металлов. Сплавы
Физические свойства металлов. Сплавы Микроорганизмы и важнейшие химические факторы среды обитания
Микроорганизмы и важнейшие химические факторы среды обитания Кислоты: классификация, реакции, применение
Кислоты: классификация, реакции, применение №10 зертханалық жұмыс Сірке қышқылы, қасиеттері, алу жолдары
№10 зертханалық жұмыс Сірке қышқылы, қасиеттері, алу жолдары Способы переработки нефти
Способы переработки нефти Влияние фтора на организм человека
Влияние фтора на организм человека Регуляция клеточной активности. Роль регуляторных механизмов для жизнедеятельности клетки
Регуляция клеточной активности. Роль регуляторных механизмов для жизнедеятельности клетки Химиялық реакциялардың кинетикалық жіктелуі.Ферментті катализ.Катализдің организмнің тіршілігіндегі рөлі
Химиялық реакциялардың кинетикалық жіктелуі.Ферментті катализ.Катализдің организмнің тіршілігіндегі рөлі Основные понятия химии
Основные понятия химии Жесткость воды Презентацию выполнила Ученица 10-Б класса Харьковского лицея 149 Сова Ирина
Жесткость воды Презентацию выполнила Ученица 10-Б класса Харьковского лицея 149 Сова Ирина  Органика – 4 галогенпроизводные
Органика – 4 галогенпроизводные Алкандар. (қаныққан көмірсутектер)
Алкандар. (қаныққан көмірсутектер) Определение молекулярной массы белка актина методом электрофореза по Лэммли
Определение молекулярной массы белка актина методом электрофореза по Лэммли Физический процесс и химическая реакция.
Физический процесс и химическая реакция. СПЛАВЫ. КОРРОЗИЯ МЕТАЛЛОВ. Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска Шапошникова Т.С.
СПЛАВЫ. КОРРОЗИЯ МЕТАЛЛОВ. Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска Шапошникова Т.С.  Неделя биологии и химии в школе
Неделя биологии и химии в школе Влияние галогенов на организм человека
Влияние галогенов на организм человека