Содержание
- 2. период VI A группа 2 3 4 5 О S Se Te Po 8 16 34
- 3. 1. Положение серы в ПСХЭ Д.И.Менделеева. Строение атома. 2. Сравнение строения атома кислород и серы 3.
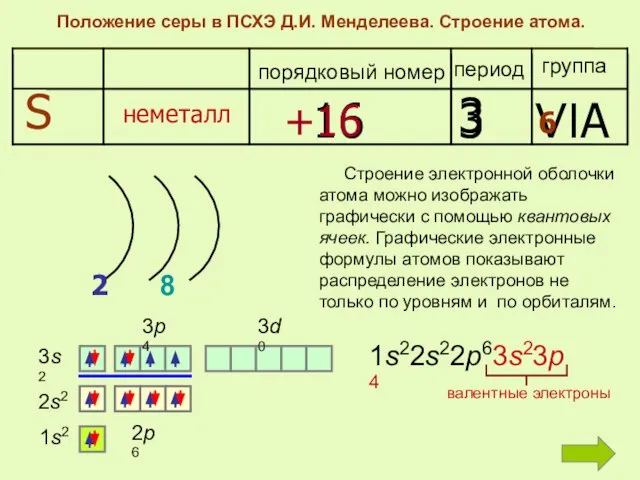
- 4. Положение серы в ПСХЭ Д.И. Менделеева. Строение атома. период группа порядковый номер S неметалл 16 3
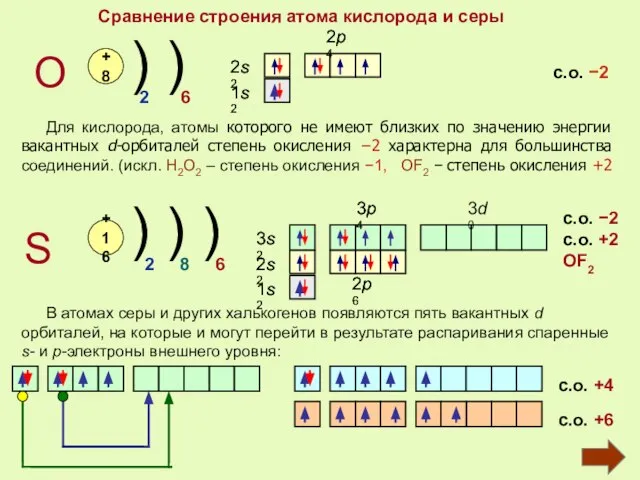
- 5. Сравнение строения атома кислорода и серы О S +8 +16 ) ) ) ) ) 2
- 6. Охарактеризуйте электронное строение атома серы Вставьте пропущенные слова: Порядковый номер серы в Периодической системе , поэтому
- 7. По распространенности сера занимает 15-е место. Содержание в земной коре составляет 0,05 % по весу. В
- 8. Аллотропные модификации серы Характеристика аллотропных модификаций Получение серы Химические свойства серы Применение серы Сера в фармацевтике
- 9. Аллотропные модификации серы
- 10. S∞ Длинные полимерные цепи; пластическая корич-невая масса; нерастворима в воде; tпл. = 160ºС Пластическая сера
- 11. S8 Кристаллическое вещество желтого цвета; нерастворима в воде; растворяется в органи-ческих растворителях; tпл.= 112ºC Ромбическая сера
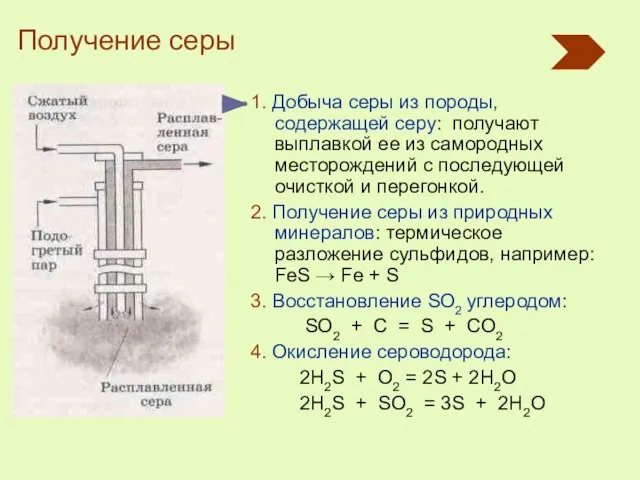
- 12. 1. Добыча серы из породы, содержащей серу: получают выплавкой ее из самородных месторождений с последующей очисткой
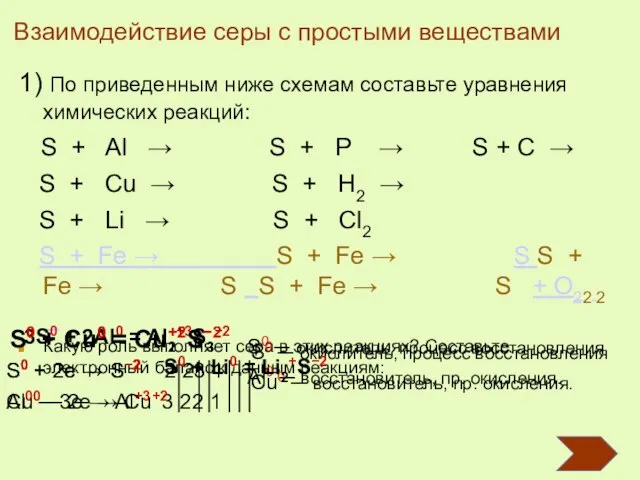
- 13. 1) По приведенным ниже схемам составьте уравнения химических реакций: S + Al → S + P
- 14. Составьте уравне-ние реакции взаимо-действия серы и железа. Fe + S = FeS Взаимодействие серы с железом
- 15. Составьте уравнение реакции горения серы. S + O2 = SO2 Горение серы в кислороде
- 16. S + H2SO4 (конц.) → SO2 + H2O S + HNO3 (конц.) → H2SO4 + NO2
- 17. Fe FeS H2S S SO2 1 2 4 3 1) Fe + S = FeS 2)
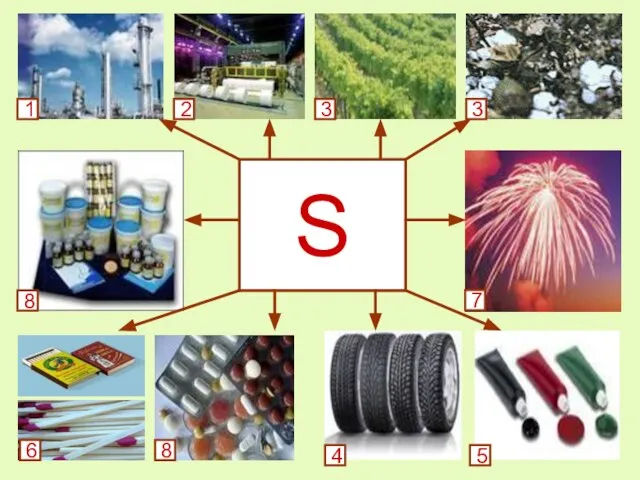
- 18. Применение серы 1. для производства серной кислоты (около 50% всей производимой серы); 2. для производства сульфитов,
- 19. S 1 2 3 3 8 6 8 4 5 7
- 20. Сера в фармацевтике Порошок «серы осажденной» применяют наружно в виде мазей (5 – 10 – 20
- 21. Тест 1. Последовательность цифр 2 — 8 — 18 — 6 соответствует распределению электронов по энергетическим
- 22. Барит BaSO4 «Барос» по-гречески – тяжесть. Химический состав: ВаО 65,7%, SO3 34,3% Практическое значение: Барит находит
- 23. Гипс CaSO4 ·2Н2О марьино стекло селенит гипс пластинчатый «Гипс» - старое греческое название минерала. Химический состав:
- 24. Мирабилит Na2SО4·10H2O Старинное название «удивительная соль Глауберова». Синоним глауберова соль. Химический состав: Na2O 19,3%, SO3 24.8%,
- 25. Самородная сера S Наиболее устойчивую при комнатной температуре α-модификацию серы называют обычно ромбической серой или просто
- 26. Аурипигмент As2S3 Название происходит от латинских слов «аурум» -золото и «пигментум» - краска. Предполагалось, что минерал
- 27. Галенит PbS Название происходит от латинского слова «галена» - свинцовая руда. Синоним свинцовый блеск. Химический состав:
- 28. Киноварь HgS Предполагают, что название перешло из Индии, где так называются красная смола и «кровь дракона».
- 29. Молибденит МоS2 Название происходит от греческого слова «молибдос» - свинец. Синоним молибденовый блеск. Химический состав: Мо
- 30. Пирит FeS2 «Пирос» по-гречески – огонь. По-видимому, это название связано со свойствами пирита давать искры при
- 31. Халькопирит CuFeS2 «Халькос» по- гречески медь, «пирос» - огонь. Синоним медный колчедан. Химический состав: Cu 34,5%,
- 33. Скачать презентацию

























 Пурины. Строение пурина. (Лекция 9)
Пурины. Строение пурина. (Лекция 9) ,1
,1 Презентация по Химии "СИНТЕТИЧНІ ЛІКАРСЬКІ ЗАСОБИ" - скачать смотреть бесплатно
Презентация по Химии "СИНТЕТИЧНІ ЛІКАРСЬКІ ЗАСОБИ" - скачать смотреть бесплатно Презентация по Химии "«Углеводы»" - скачать смотреть
Презентация по Химии "«Углеводы»" - скачать смотреть  Характеристика и свойства истинных растворов
Характеристика и свойства истинных растворов Ацетилен. Физические и химические свойства
Ацетилен. Физические и химические свойства Введение. Физическая и коллоидная химия, ее содержание, задачи, объекты и методы их изучения
Введение. Физическая и коллоидная химия, ее содержание, задачи, объекты и методы их изучения Reactions and equations lab
Reactions and equations lab Аттестационная работа. Методическая разработка по выполнению исследовательской работы Тайны поваренной соли
Аттестационная работа. Методическая разработка по выполнению исследовательской работы Тайны поваренной соли Physical chemistry of nanostructured systems
Physical chemistry of nanostructured systems Периодическая система химических элементов Д.И.Менделеева и строение атомов. (8 класс)
Периодическая система химических элементов Д.И.Менделеева и строение атомов. (8 класс)  Неізогіпсичні перетворення функціональних груп. Реакції окиснення
Неізогіпсичні перетворення функціональних груп. Реакції окиснення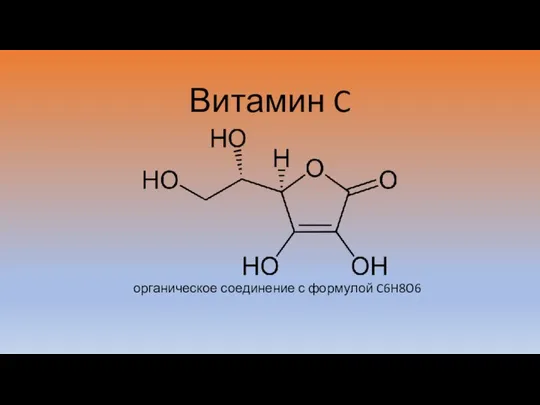 Витамин C
Витамин C Оборотні і необоротні реакції. Хімічна рівновага
Оборотні і необоротні реакції. Хімічна рівновага Разработка препаративных методик получения фосфатсодержащих производных бетулина с улучшенной растворимостью в воде
Разработка препаративных методик получения фосфатсодержащих производных бетулина с улучшенной растворимостью в воде Современные тенденции развития химии
Современные тенденции развития химии Фосфор. Соединения фосфора
Фосфор. Соединения фосфора Розчин та його компоненти: розчинник, розчинена речовина. Вода як розчинник. Будова молекули води, поняття про водневий зв’язок
Розчин та його компоненти: розчинник, розчинена речовина. Вода як розчинник. Будова молекули води, поняття про водневий зв’язок Крахмал (C6H10O5)n
Крахмал (C6H10O5)n  Геохимия урана и тория в гидротермально-метасоматических процессах
Геохимия урана и тория в гидротермально-метасоматических процессах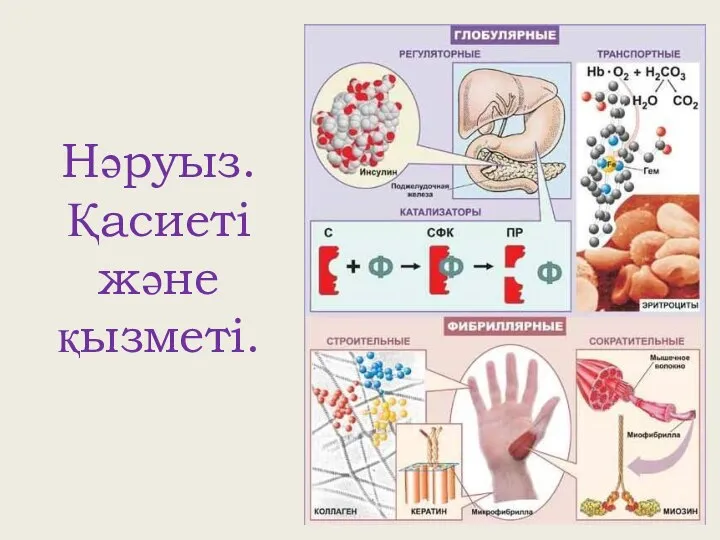 Нәруыз. Қасиеті және қызметі
Нәруыз. Қасиеті және қызметі Получение и свойства азота
Получение и свойства азота Изучение влияния различных факторов на скорость химических реакции
Изучение влияния различных факторов на скорость химических реакции Классификация гормонов
Классификация гормонов Задачи, включаемые в задание 33 тестов ЕГЭ
Задачи, включаемые в задание 33 тестов ЕГЭ Скорость химических реакций. Катализ. Химическое равновесие
Скорость химических реакций. Катализ. Химическое равновесие Тема 1.4 Закономерности химических процессов. Основы химической термодинамики и биоэнергетики
Тема 1.4 Закономерности химических процессов. Основы химической термодинамики и биоэнергетики Реакции при участии катализатора
Реакции при участии катализатора