Содержание
- 2. Химическая связь – это различные виды взаимодействий, обуславливающие устойчивое существование двух- и многоатомных соединений: молекул, ионов,
- 3. Энергией химической связи называется количество энергии, которое выделяется при образовании химической связи [кДж/моль].
- 4. Виды химической связи: ковалентная: полярная, неполярная, донорно-акцепторная; ионная; металлическая; водородная; силы Ван-дер-Ваальса
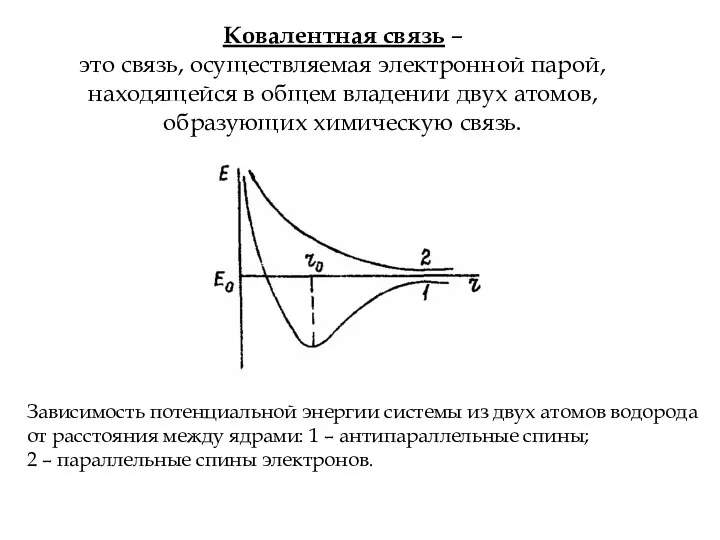
- 5. Ковалентная связь – это связь, осуществляемая электронной парой, находящейся в общем владении двух атомов, образующих химическую
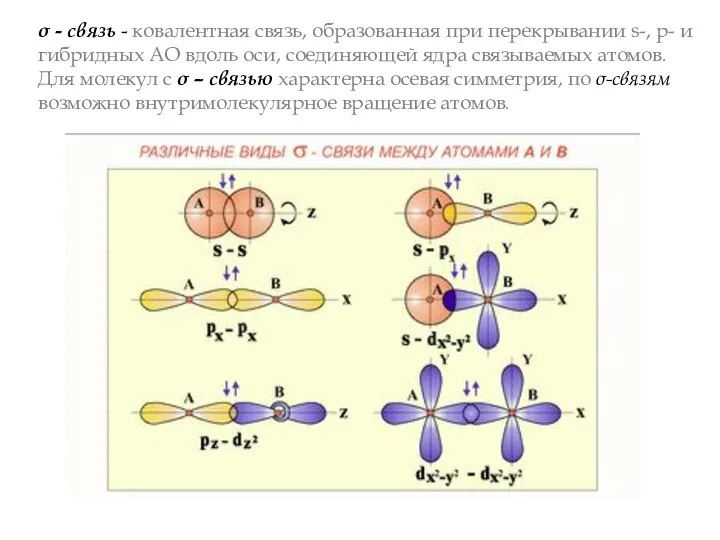
- 6. σ - связь - ковалентная связь, образованная при перекрывании s-, p- и гибридных АО вдоль оси,
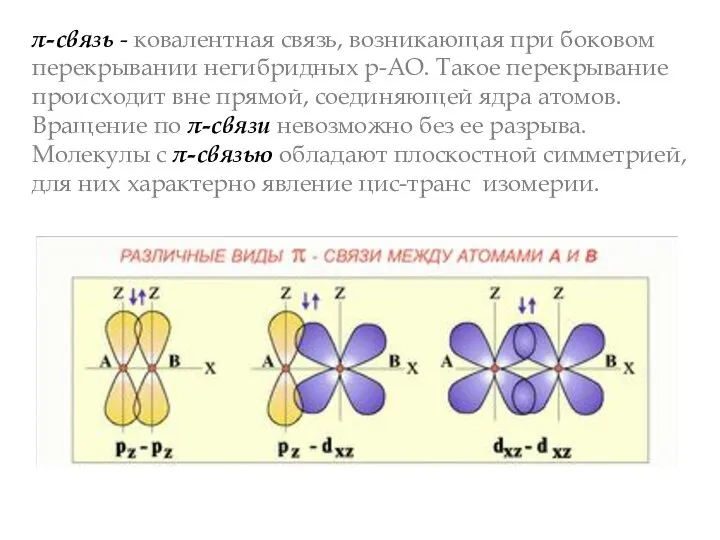
- 7. π-связь - ковалентная связь, возникающая при боковом перекрывании негибридных р-АО. Такое перекрывание происходит вне прямой, соединяющей
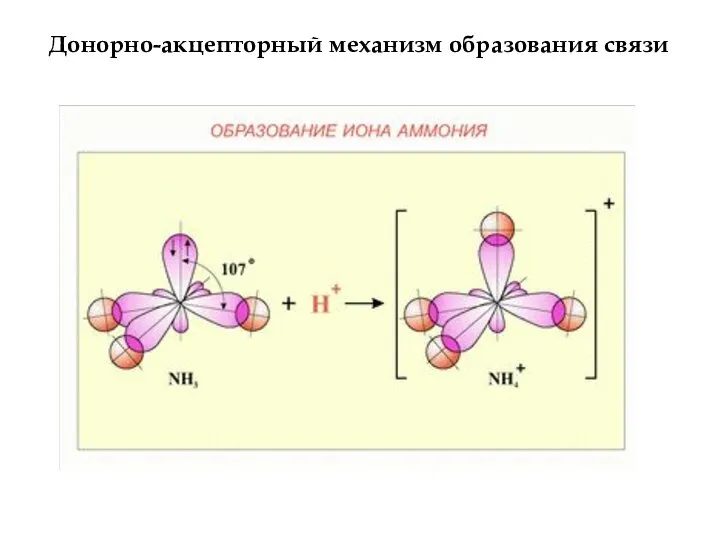
- 8. Донорно-акцепторный механизм образования связи
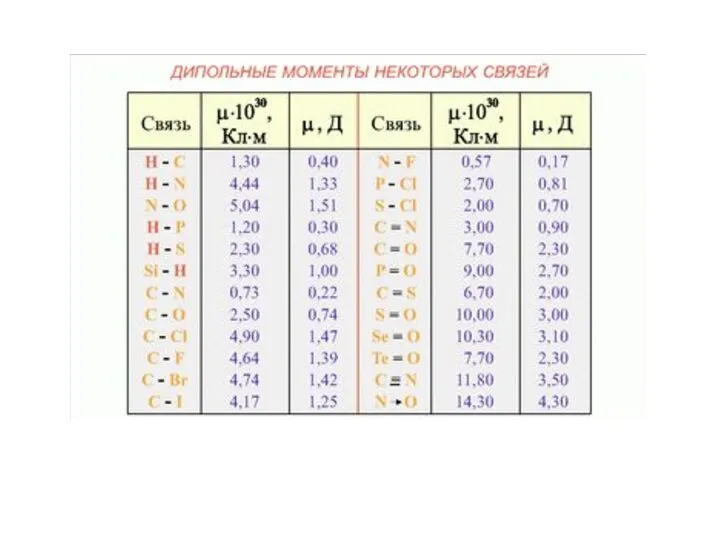
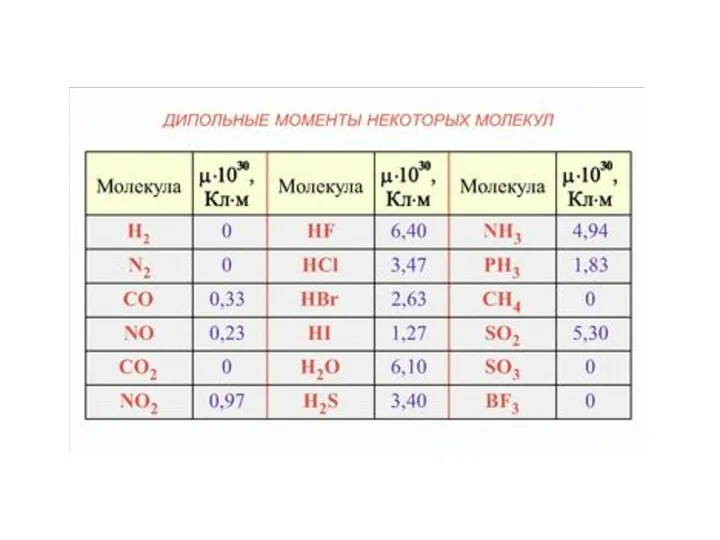
- 9. Полярность химической связи Н Сl l Полярность связи характеризует электрический момент диполя. Символ μ (мю), единица
- 12. Ионную связь можно рассматривать как предельный случай полярной связи, для которой эффективный заряд атома близок к
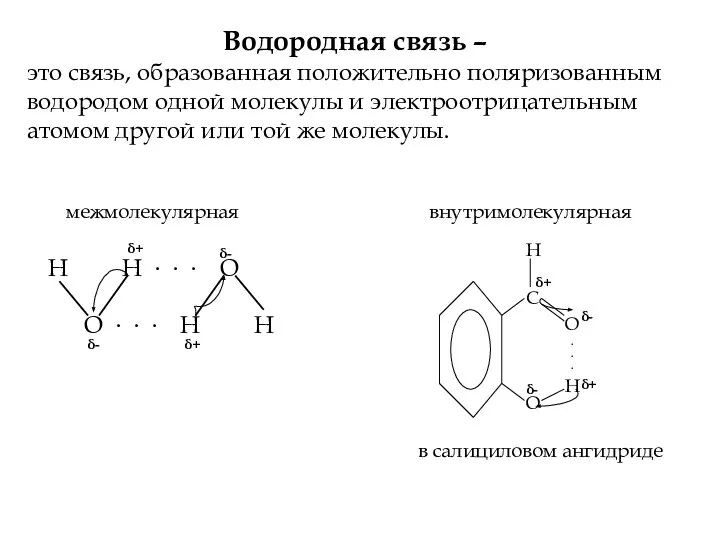
- 13. Водородная связь – это связь, образованная положительно поляризованным водородом одной молекулы и электроотрицательным атомом другой или
- 15. Скачать презентацию

![Энергией химической связи называется количество энергии, которое выделяется при образовании химической связи [кДж/моль].](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1395607/slide-2.jpg)



 Выбраковка результатов химического анализа
Выбраковка результатов химического анализа Учитель химии МБОУ СОШ № 9 МО ЩР станица Новощербиновская Степучева Ольга Викторовна
Учитель химии МБОУ СОШ № 9 МО ЩР станица Новощербиновская Степучева Ольга Викторовна Prezentatsia_2-10_Enoly
Prezentatsia_2-10_Enoly Строение атома углерода
Строение атома углерода Розв’язування розрахункових хімічних задач. Методичні рекомендації для вчителів хімії та школярів
Розв’язування розрахункових хімічних задач. Методичні рекомендації для вчителів хімії та школярів Материалы, используемые в конструкциях космических аппаратов
Материалы, используемые в конструкциях космических аппаратов Амедео Авогадро (1776-1856)
Амедео Авогадро (1776-1856) Кислотно-основное равновесие в процессах жизнедеятельности. Ионное произведение воды. Водородный показатель
Кислотно-основное равновесие в процессах жизнедеятельности. Ионное произведение воды. Водородный показатель Оксиды. Названия оксидов
Оксиды. Названия оксидов Аттестационная работа. Образовательная программа кружка Химия и жизнь
Аттестационная работа. Образовательная программа кружка Химия и жизнь Мәктәптә-химия атналыгы
Мәктәптә-химия атналыгы Номенклатура органических соединений. Строение атома углерода. Изомерия
Номенклатура органических соединений. Строение атома углерода. Изомерия Йодиметрия и йодометрия. (Лекция 9)
Йодиметрия и йодометрия. (Лекция 9) Периодическая система химических элементов Д.И.Менделеева Учитель химии МБОУ СОШ №37 г. Шахты Ростовской области Вабищевич М.В.
Периодическая система химических элементов Д.И.Менделеева Учитель химии МБОУ СОШ №37 г. Шахты Ростовской области Вабищевич М.В. Дисперсные системы
Дисперсные системы Строение атома. Периодичность свойств элементов и их соединений
Строение атома. Периодичность свойств элементов и их соединений Решение задач Вывод молекулярной формулы органического вещества по продуктам сгорания
Решение задач Вывод молекулярной формулы органического вещества по продуктам сгорания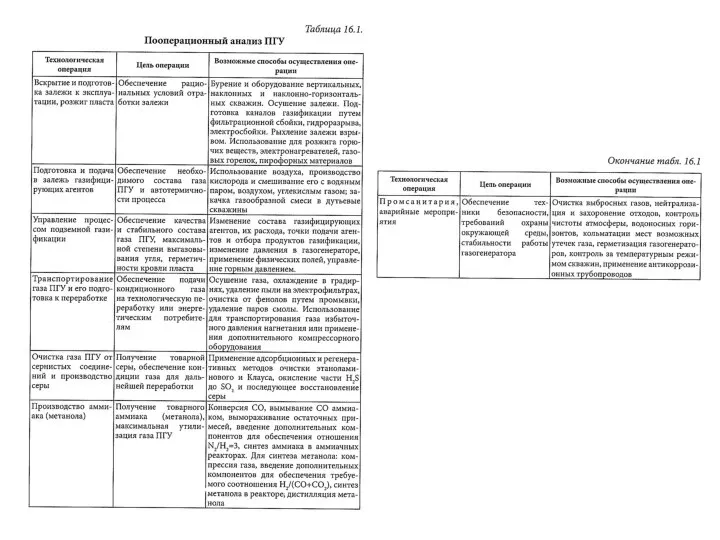 Пооперационный анализ ПГУ
Пооперационный анализ ПГУ Биохимия витаминов 2. (Лекция 26)
Биохимия витаминов 2. (Лекция 26) Квантовая механика и квантовая химия
Квантовая механика и квантовая химия Періодична система Менделєєва. Елементи 6 групи
Періодична система Менделєєва. Елементи 6 групи Химия биогенных элементов. Лекция 14
Химия биогенных элементов. Лекция 14 Нитраты и нитриты. Азотные удобрения
Нитраты и нитриты. Азотные удобрения Галогены
Галогены Растворы. Способы выражения концентрации растворенного вещества
Растворы. Способы выражения концентрации растворенного вещества Презентация ГЛАДКИХ КСЕНИИ НА ТЕМУ: «СЕРНАЯ КИСЛОТА. ПРОИЗВОДСТВО СЕРНОЙ КИСЛОТЫ»
Презентация ГЛАДКИХ КСЕНИИ НА ТЕМУ: «СЕРНАЯ КИСЛОТА. ПРОИЗВОДСТВО СЕРНОЙ КИСЛОТЫ»  Пространственная изомерия органических соединений
Пространственная изомерия органических соединений Ферменты. Функции белков
Ферменты. Функции белков