Сульфідна кислота є двохосновною, тому утворює два типи солей — середні
(сульфіди) і кислі (гідрогенсульфіди), наприклад
K2S — сульфід калію, KHS — гідрогенсульфід калію.
Майже всі гідрогенсульфіди добре розчинні у воді, а більшість сульфідів (крім сульфідів лужних, лужноземельних металів і амонію) практично нерозчинні або малорозчинні у воді.
Деякі сульфіди мають характерне забарвлення, наприклад:
PbS, CuS, HgS, FeS — чорні, ZnS — білий, CdS — жовтий, Fe2S3 — темно-коричневий, що використовують в аналітичній хімії.
Малорозчинні у воді сульфіди можна розчинити у сильних кислотах, кислотах-окисниках або в „царській горілці".
СОЛІ СУЛЬФІДНОЇ КИСЛОТИ (СУЛЬФІДИ)
Застосування.
Сульфіди важких металів промислово важливі і знаходяться в рудах, з яких добувають метали. У вигляді сульфідів осаджують з розчинів йони багатьох d-елементів.






































 Двойной электрический слой (ДЭС)
Двойной электрический слой (ДЭС) Эколого-химическая характеристика качества почвы
Эколого-химическая характеристика качества почвы Основания, их классификация и свойства (8 класс)
Основания, их классификация и свойства (8 класс) Поверхневі явища. Адсорбція
Поверхневі явища. Адсорбція Пируватдегидрогеназный комплекс
Пируватдегидрогеназный комплекс Техника безопасности при работе с серной кислотой
Техника безопасности при работе с серной кислотой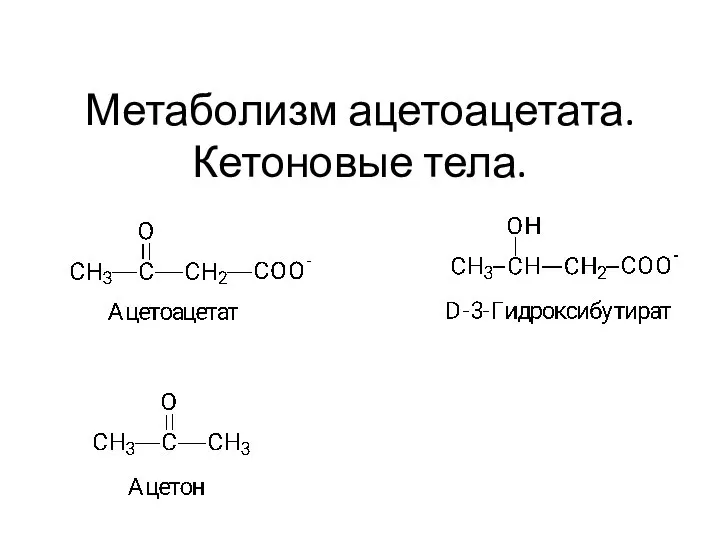 Метаболизм ацетоацетата. Кетоновые тела.Тема 10
Метаболизм ацетоацетата. Кетоновые тела.Тема 10 Гідроліз солей
Гідроліз солей Коррозия металлов
Коррозия металлов Алкены. Непредельные углеводороды ряда этилена
Алкены. Непредельные углеводороды ряда этилена Простой борный суперфосфат
Простой борный суперфосфат Природные смолы: канифоль, янтарь, сандарак (2)
Природные смолы: канифоль, янтарь, сандарак (2) Закономерности управления простым обратимым гомогенным процессом
Закономерности управления простым обратимым гомогенным процессом Проблема содержания нитратов в пищевых продуктах
Проблема содержания нитратов в пищевых продуктах Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Өсімдіктердегі су алмасу физиологиясы. Судың өсiмдiк тiршiлiгiндеri маңызы
Өсімдіктердегі су алмасу физиологиясы. Судың өсiмдiк тiршiлiгiндеri маңызы Липиды. Насыщенные и ненасыщенные жирные кислоты
Липиды. Насыщенные и ненасыщенные жирные кислоты ИЗВЕСТНЫЕ УЧЕНЫЕ – ХИМИКИ Немного из истории химии
ИЗВЕСТНЫЕ УЧЕНЫЕ – ХИМИКИ Немного из истории химии Гранулометрический метод контроля
Гранулометрический метод контроля Colligative properties of solutions
Colligative properties of solutions Общая геохимия
Общая геохимия Презентация по химии Электролиз
Презентация по химии Электролиз  Химическое сопротивление алюминий и его сплавов
Химическое сопротивление алюминий и его сплавов Атом құрылысы
Атом құрылысы Учебно - исследовательский проект «Выращивание кристаллов в домашних условиях»
Учебно - исследовательский проект «Выращивание кристаллов в домашних условиях» Презентация по Химии "Химия – наука о веществах" - скачать смотреть
Презентация по Химии "Химия – наука о веществах" - скачать смотреть  Азот и фосфор
Азот и фосфор Механизмы рекомбинации
Механизмы рекомбинации