Содержание
- 2. План лекции Химические элементы Типы связей Вопросы Список литературы
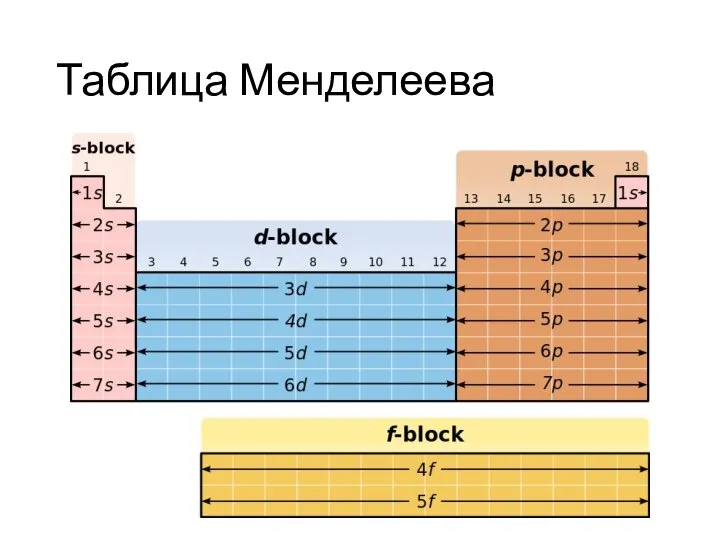
- 3. Таблица Менделеева
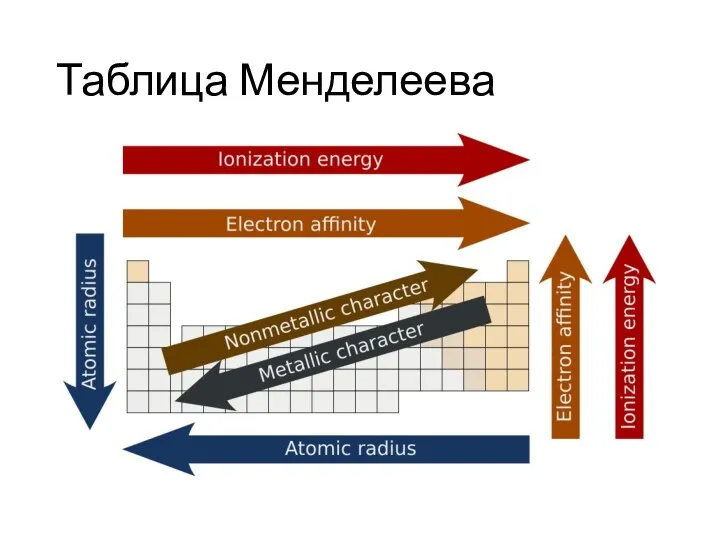
- 4. Таблица Менделеева
- 5. Таблица Менделеева
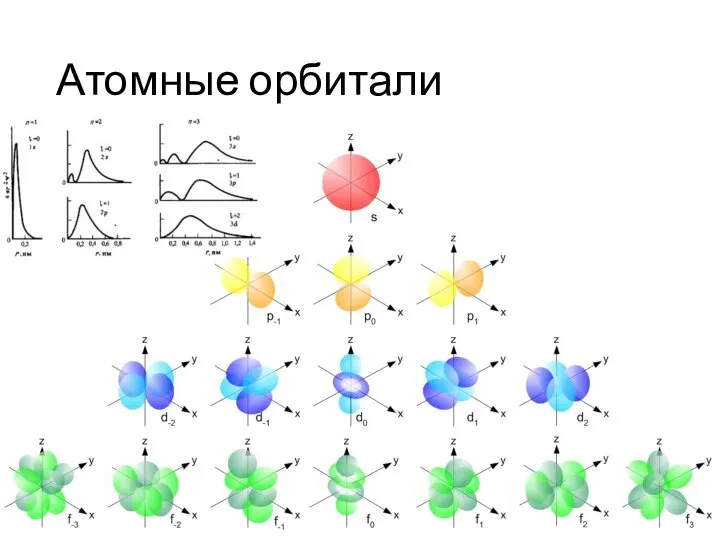
- 6. Атомные орбитали
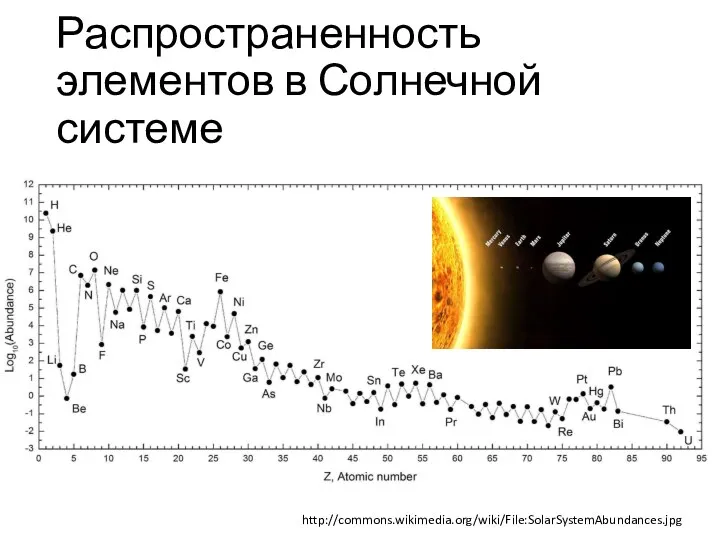
- 7. Распространенность элементов в Солнечной системе http://commons.wikimedia.org/wiki/File:SolarSystemAbundances.jpg
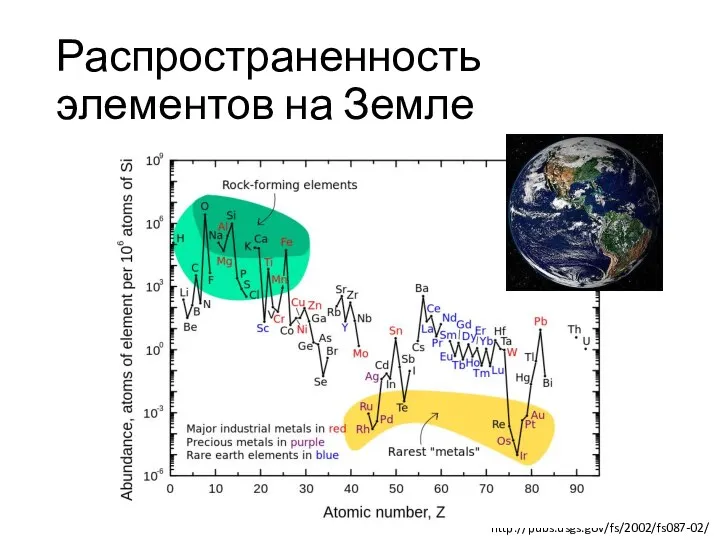
- 8. Распространенность элементов на Земле http://pubs.usgs.gov/fs/2002/fs087-02/
- 9. Химическая связь Химическая связь – взаимное притяжение атомов, приводящее к образованию молекул, кристаллов, конденсированной фазы.
- 10. Химическая связь Тип связи определяет электронные свойства Тип связи определяет колебательные свойства Энергия связи определяет характерную
- 11. Типы химических связей Силы Ван-дер-Ваальса Ионная связь Ковалентная связь Металлическая связь Водородная связь
- 12. Силы Ван-дер-Ваальса Силы межатомного (межмолекулярного взаимодействия) с энергией 10-20 кДж/моль. Классификация ван-дер-ваальсовых сил Ориентационные силы, диполь-дипольное
- 13. Силы Ван-дер-Ваальса-Лондона: кристаллы инертных газов
- 14. Силы Ван-дер-Ваальса-Лондона: кристаллы инертных газов
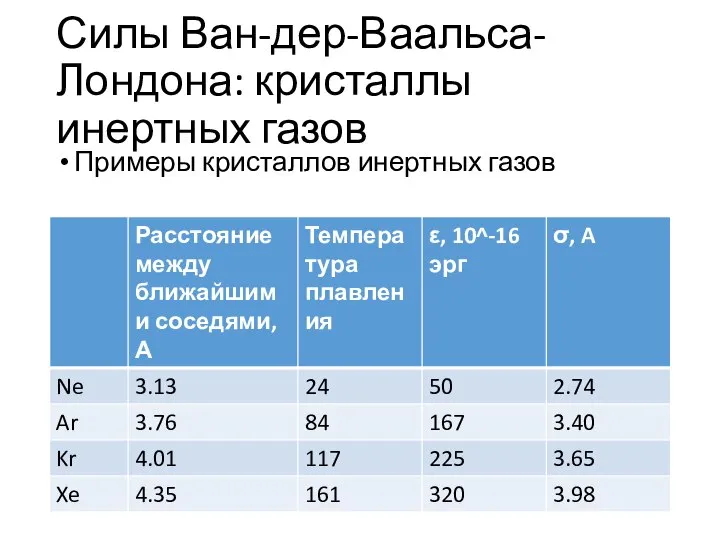
- 15. Силы Ван-дер-Ваальса-Лондона: кристаллы инертных газов Примеры кристаллов инертных газов
- 16. Ионная связь Ионная связь - очень прочная химическая связь, образующаяся между атомами с большой разностью электроотрицательностью,
- 17. Электростатическая энергия или энергия Маделунга
- 18. Постоянная Маделунга
- 19. Объемный модуль упругости
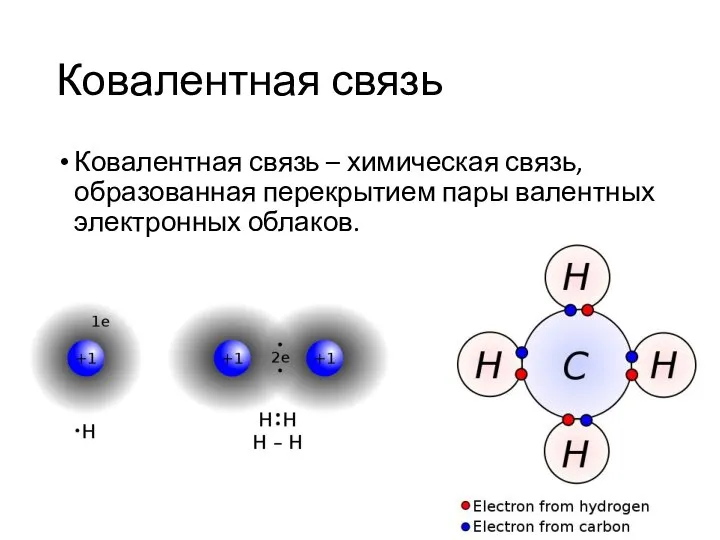
- 20. Ковалентная связь Ковалентная связь – химическая связь, образованная перекрытием пары валентных электронных облаков.
- 21. Ковалентная связь Характерные свойства - направленность, насыщаемость, полярность, поляризуемость. Насыщенность - способность атомов образовывать ограниченное число
- 22. Металлическая связь Химическая связь между атомами, возникающая за счёт обобществления их валентных электронов. Характерна для атомов
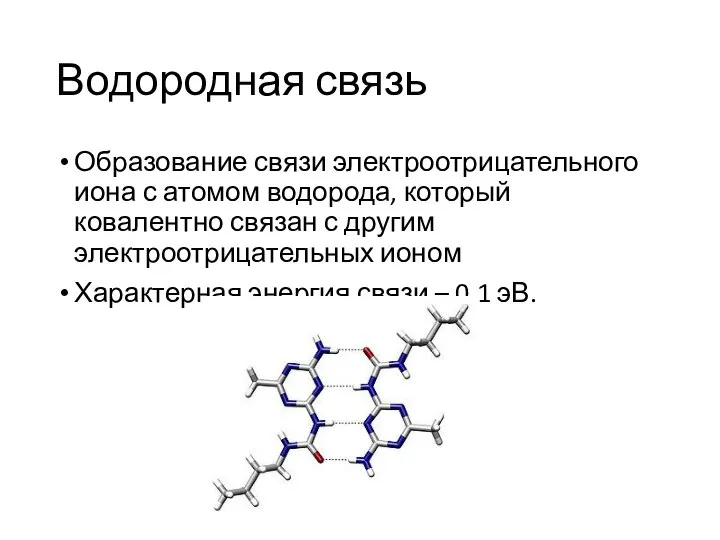
- 23. Водородная связь Образование связи электроотрицательного иона с атомом водорода, который ковалентно связан с другим электроотрицательных ионом
- 24. Вопросы Получить постоянную Маделунга для первых трех координационных сфер кристалла NaCl. Оценить объемный модуль для кристалла
- 26. Скачать презентацию















 Обмен липидов-1
Обмен липидов-1 Типы изомерии 1.Историческая справка 2.Изомерия. Изомеры. 3.Типы изомерии. Классификация изомеров.
Типы изомерии 1.Историческая справка 2.Изомерия. Изомеры. 3.Типы изомерии. Классификация изомеров.  Многообразие углеводородов. Обобщение
Многообразие углеводородов. Обобщение Типы химических реакций
Типы химических реакций Органічні речовини в живій природі
Органічні речовини в живій природі  Отрицательное влияние азотных минеральных удобрений на почву
Отрицательное влияние азотных минеральных удобрений на почву Искусственные материалы. Пластмассы
Искусственные материалы. Пластмассы Структура периодической системы элементов
Структура периодической системы элементов Стекло, его происхождение и значение в жизни человека
Стекло, его происхождение и значение в жизни человека Получение нанокапель методом сверхзвукового разшерения
Получение нанокапель методом сверхзвукового разшерения Энергетика химических процессов
Энергетика химических процессов Презентация по Химии "Углеводы или сахариды" - скачать смотреть
Презентация по Химии "Углеводы или сахариды" - скачать смотреть  Правило смещения. Радиоактивность. Изотопы
Правило смещения. Радиоактивность. Изотопы Железо и его соединения
Железо и его соединения Периодическая система
Периодическая система Важнейшие химические понятия Систематизация и коррекция знаний, умений, навыков
Важнейшие химические понятия Систематизация и коррекция знаний, умений, навыков Мыс және оның қорытпалары
Мыс және оның қорытпалары Тотығып фосфорлану
Тотығып фосфорлану Игра по химии Разработала учитель химии МОУ «Яльчикская СОШ» Левая В.Н.
Игра по химии Разработала учитель химии МОУ «Яльчикская СОШ» Левая В.Н. Фотохимические превращения ДНК. Люминесцентные метки и зонды и их применение в биологии и медицине
Фотохимические превращения ДНК. Люминесцентные метки и зонды и их применение в биологии и медицине Серная кислота. Строение и свойства
Серная кислота. Строение и свойства Белки. Изучение органических веществ в 9-10 классе
Белки. Изучение органических веществ в 9-10 классе Цветные реакции белков Качественные реакции на остатки аминокислот
Цветные реакции белков Качественные реакции на остатки аминокислот  Основные понятия и стехиометрические законы. Химический эквивалент
Основные понятия и стехиометрические законы. Химический эквивалент Химические методы определения U, Pu, Th
Химические методы определения U, Pu, Th Муниципальное общеобразовательное учреждение «Итатская СОШ №2 с.Томское» Томский район Как больше и дешевле получать кисл
Муниципальное общеобразовательное учреждение «Итатская СОШ №2 с.Томское» Томский район Как больше и дешевле получать кисл Галогенпроизводные алифатических углеводородов
Галогенпроизводные алифатических углеводородов Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості
Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості